原料药甘油稳定性试验研究
张延超,刘 帅,刘 菁,吴 燕
(天津市药品检验研究院,天津 300070)
甘油分子式为C3H8O3,分子量为92.09,CAS号:56-81-5,甘油最早由斯柴尔(Scheel)于1779年首先发现,1823年人们逐渐认识到油脂成分中含有Chevreul,希腊语为甘甜的意思,因此命名为甘油(glycerol)。在一战期间,曾作为制造火药的原料而大量生产。此后,甘油作为润滑性泻药或药用辅料,溶剂和助悬剂等,被广泛应用在原料药和药用辅料中。
药品的稳定性是指原料药及其制剂保持其物理、化学、生物学和微生物学性质的能力。稳定性特性也是药品质量控制研究的重要内容,与药品质量研究和质量标准的建立紧密相关[1-2]。药品的稳定性直接关系到临床用药安全,通常条件下,随着储存时间的延长,化学药品会出现降解,导致有效成分的减少和有害物质的增加,有的药品生产企业无法厘清留样、稳定性试验与持续稳定性考查三种行为之间的关系和区别,不同程度地存在着概念不清、措施混淆、质量风险和法律风险并存等情形[3]。
因此,通过对药品稳定性研究,对产品质量稳定性的确定,对推测产品的有效期都具有实际指导意义[2]。本文按照国家新药注册管理办法中药品稳定研究指导原则,以及《中国药典》原料药与药物制剂稳定性试验指导原则,对甘油原料药进行稳定性考查。
1 仪器与试药
1.1 仪器 电子天平(METTLER);折光仪(RUDOLPH J257);红外光谱仪(BRUKER TENSOR 27);气相色谱仪(Agilent 7890A);水分仪(METTLER V20);高温炉(Thermo BF51794JC-1);加热板(莱玻特瑞);紫外-可见分光光度计(岛津UV-2450);pH计(METTLER Seveneasy);电热恒温水浴锅(HBYQ HHS型);纯水仪(MillAdvantage A10)。
1.2 试药 原料药甘油(厂家A,批号072703-01、072803-01、072903-01);氢氧化钠(天津市化学试剂三厂);重铬酸钾(天津市华东试剂厂);甲醇(Merck,色谱纯);硝酸(Merck,色谱纯);盐酸(天津市科密欧化学试剂有限公司);硫酸铜(天津市赢达稀贵化学试剂厂);氢氧化钾(天津市化学试剂三厂);二甘醇(中国食品药品检定研究院,批号101127-201302);乙二醇(中国食品药品检定研究院,批号101111-201904);1,2-丙二醇(Dr.Ehrenstorfer GmbH,批号G1007429);正己醇(Dr.Ehrenstorfer GmbH,批号G1021183);铁单元素标准溶液(国家有色金属及电子材料分析测试中心,国家标准样品编号:GSB 04-1762-2004,批号16031);草酸铵(天津市风帆化学试剂科技有限公司);铅单元素标准溶液(国家有色金属及电子材料分析测试中心,国家标准样品编号:GSB 04-1742-2004,批号208021-1)。
2 方法与结果
2.1 稳定性试验
2.1.1 性状 按照《中国药典》方法[1],本品为无色、澄清的黏稠液体。相对密度:本品在25℃时的相对密度为1.258~1.268。折光率:本品的折光率为1.470~1.475。
2.1.2 酸碱度 按照《中国药典》方法[1],取本品25.0 g,用水稀释至50 ml,摇匀,加酚酞指示剂0.5 ml,溶液应无色,加0.l mol/L氢氧化钠溶液0.2 ml,溶液应显粉红色。
2.1.3 颜色 按照《中国药典》方法[1],取本品50 ml,置50 ml纳氏比色管中,与对照液(取比色用重铬酸钾溶液0.2 ml,加水稀释至50 ml制成)比较,不得更深。
2.1.4 糖 按照《中国药典》方法[1],采用滴加硫酸铜试液的显色反应,应为蓝色澄清溶液,继续在水浴上加热5 min,溶液应仍为蓝色,无沉淀产生。
2.1.5 脂肪酸与脂类 按照《中国药典》方法[1],采用氢氧化钠滴定法,进行测定,消耗的氢氧化钠滴定液(0.1 mol/L)不得过4.0 ml。
2.1.6 丙烯醛与铵盐 按照《中国药典》方法[1],不得显黄色或发生氨臭。
2.1.7 易炭化物 按照《中国药典》方法[1],结果应符合规定。
2.1.8 有关物质 按照《中国药典》方法[1],采用气相色谱加内标方法,扣除内标峰按面积归一化法计算,单个未知杂质不得过0.1%;杂质总量(包含二甘醇、乙二醇和1,2-丙二醇)不得过1.0%。
2.1.9 水分 按照《中国药典》方法[1],含水分不得过2.0%。
2.1.10 含量测定 按照《中国药典》方法[1],采用滴定法,按无水物计算,甘油含量不得少于98.0%。
2.2 影响因素试验 此项试验是在比加速试验更激烈的条件下进行。其目的是探讨药物的固有稳定性、了解影响其稳定性的因素及可能的降解途径与降解产物,为制剂生产工艺、包装、贮存条件和建立降解产物分析方法提供科学依据[4]。
2.2.1 光照试验 取072703-01、072803-01、072903-01共3批样品,开口放在光照箱中,以4 500 lx光照射10 d,分别在5和10 d取样测定。结果本品经强光照射后,外观性状、相对密度、折光率、酸碱度、颜色、糖、脂肪酸与脂类、丙烯醛与铵盐、易炭化物、有关物质、含量测定均未见明显变化,水分稍有增加,表明本品对光照较稳定。见表1。
2.2.2 高温试验 取072703-01、072803-01、072903-01共3批样品,开口放在恒温箱中,于60℃温度下放置30 d,在第5、10和30 d取样测定。结果经60℃高温试验后,外观性状、相对密度、折光率、酸碱度、颜色、糖、脂肪酸与脂类、丙烯醛与铵盐、易炭化物、有关物质、含量测定均未见明显变化,杂质总量为0.05%,最大单个未知杂质含量为0.04%,水分稍有增加,说明本品对热较稳定。见表1。
2.2.3 高湿试验 取072703-01、072803-01、072903-01共3批样品,开口置恒湿密闭容器中,于相对湿度75%RH和92.5%RH下,室温放置5 d,取样测定。结果经75%RH和92.5%RH高湿试验后,外观性状、相对密度、折光率、酸碱度、颜色、糖、脂肪酸与脂类、丙烯醛与铵盐、易炭化物、有关物质未见明显变化,有关物质中杂质总量为0.05%,最大单个未知杂质含量为0.04%,无明显变化。由于本品极具引湿性,高湿条件下水分和含量测定试验无法继续进行,说明本品对高湿环境极不稳定。见表1。
2.3 加速试验 药品稳定性加速试验属于药品上市后阶段的稳定性研究,其考查条件一般等同于长期稳定性试验样品放置条件,供试品在温度(40±2)℃、相对湿度75%±5%的条件下放置6个月[4]。通过考查产品在高于长期贮藏温度和湿度条件下的稳定性,根据试验结果确定是否需要进行中间条件下的稳定性试验及确定长期试验的放置条件。本试验取3批样品,在温度为40℃,相对湿度为RH75%的恒温恒湿箱中放置,于3和6个月取样测定。考查样品外观性状、相对密度、折光率、酸碱度、颜色、糖、脂肪酸与脂类、丙烯醛与铵盐、易炭化物、有关物质、含量测定的变化。结果经40℃加速试验6个月后,外观性状、酸碱度、颜色、糖、脂肪酸与脂类、丙烯醛与铵盐、易炭化物考查指标均符合质量标准要求,相对密度、折光率、有关物质、水分、含量测定均未见明显变化,有关物质有所增加,3批样品总杂质分别为0.11%、0.12%和0.12%,仍符合质量标准要求。见表2。
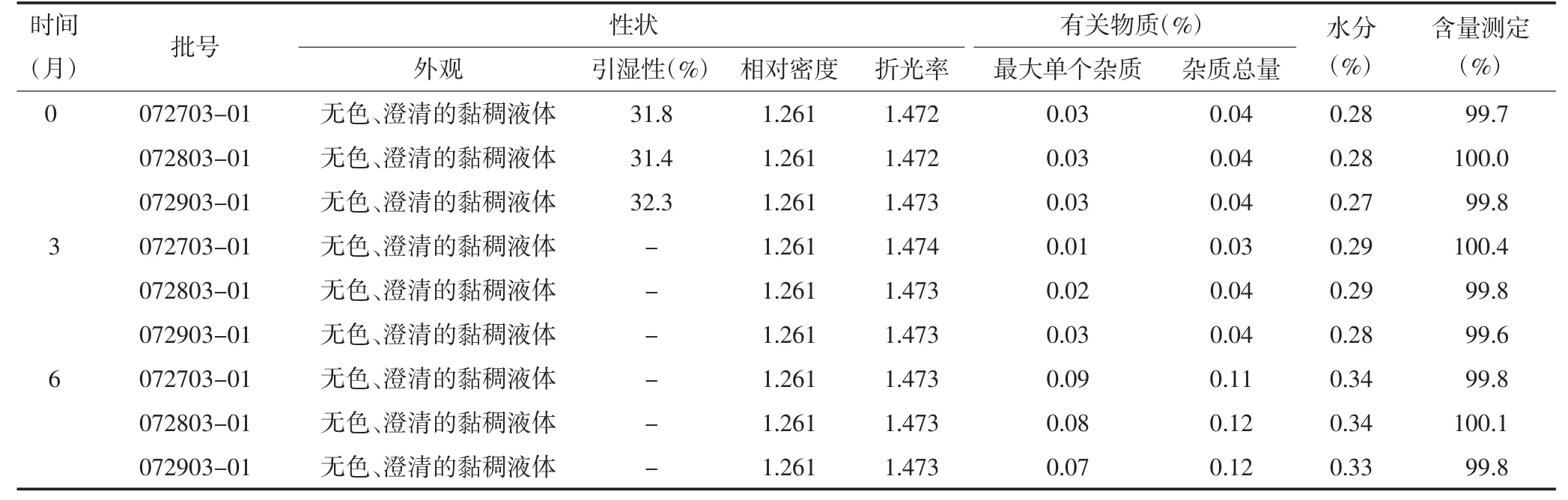
表2 原料药甘油加速试验结果(40℃,RH75%)
3 讨论
稳定性研究是基于对原料药或制剂及其生产工艺的系统研究和理解,通过设计试验获得原料药或制剂的质量特性在各种环境因素(如温度、湿度、光线照射等)的影响下随时间变化的规律,并据此为药品的处方、工艺、包装、贮藏条件和有效期的确定提供信息支持[5]。
影响因素试验表明,经60℃高温试验后,水分稍有增加,其余项目未见明显变化,说明本品对热较稳定。本品对高湿环境极不稳定,极具引湿性,高湿条件下水分和含量变化明显。经强光照射后,水分稍有增加,其余项目未见明显变化,表明本品对光照较稳定。
加速试验表明,本品经40℃加速试验6个月后,外观性状、相对密度、折光率、酸碱度、颜色、糖、脂肪酸与脂类、丙烯醛与铵盐、易炭化物、有关物质、水分和含量测定均未见明显变化,有关物质有所增加,3批样品总杂质分别为0.11%、0.12%和0.12%,仍符合质量标准要求。
本试验通过对原料药甘油稳定性和加速试验研究,考查原料药甘油在质量周期内的变化,为其制备、包装、贮藏条件和有效期的确定与质量控制提供技术支持。也为药品生产企业梳理清留样、稳定性试验与持续稳定性考查三种行为之间的关系和区别提供技术参考。

