参泽舒肝胶囊及其拆方连续多次给药对大鼠肾功能及肾组织形态的影响
纪凤兰,王 鑫,于小雅,刘 博,朱 颖,禹学军,丁 涛,宋莲莲*
(1.吉林省中医药科学院药效毒理评价中心,长春130012;2.吉林省科技创新平台管理中心,长春130012;3.吉林敖东药业集团延吉股份有限公司,延吉133001)
参泽舒肝胶囊为已上市中药复方制剂,具有祛湿降浊、疏肝健脾功效,适用于非酒精性脂肪性肝炎,同时出现肝酶升高等病症人群[1],其配方组成中含有大黄、泽泻、决明子成分。近年来关于大黄、泽泻、决明子等药材不断有报道发现其有肾毒性反应[2-4],为进一步明确该药临床应用的安全性,本研究按该制剂制备工艺生产了参泽舒肝胶囊及其方中大黄、泽泻、决明子拆方后的样品,通过正常健康大鼠灌胃26周观察是否具有肾毒性、毒性反应程度,为参泽舒肝胶囊的使用安全性提供理论依据,指导临床用药。
1 材料
1.1 实验药品及主要试剂
名称 批号 厂家S DH S-Z190401吉林敖东药业集团延吉股份有限公司S-Z190401吉林敖东药业集团延吉股份有限公司ZX S-Z190401吉林敖东药业集团延吉股份有限公司JMZ S-Z190401吉林敖东药业集团延吉股份有限公司BUN测试盒141309011深圳迈瑞生物医疗电子有限公司CRE测试盒20200526潍坊三维生物工程有限公司GSH-PX测试盒YX-151614R美国RD公司SOD测试盒20200513南京建成生物工程研究所HIF1β 14105-1-AP武汉三鹰生物技术有限公司
1.2 主要仪器

名称 型号 厂家全自动生化分析仪CS-600B 长春迪瑞实业有限公司酶标仪 ELX-800 美国BioTeK公司显微镜 BX51 日本奥林巴斯图像分析系统 NIS-ELEMNT BR日本尼康
1.3 动物
SD大鼠,SPF级,101只,雌雄均用,体质量:110~150g,北京维通利华实验动物技术有限公司,合格证号:1100111911074947。
2 方法
2.1 动物分组与给药
本试验随机分为10组:对照组、QFG27.68g生药/kg(相当于人临床用量的60倍)、QFD(人临床等效剂量)2.77g生药/kg、DHG1.43g生药/kg、ZXG3.00g生药/kg、JMZG2.26g生药/kg(分别为QFG中该药材的相同剂量),DHD0.14g生药/kg、ZXD0.30g生药/kg、JMZD0.23g生药/kg(分别为QFD中该药材的相同剂量),雌雄均用,每天灌服给药一次,每周给药6天,连续26周,每周按体重调整给药量,给药体积为15ml/kg。
2.2 指标检测
2.2.1 一般状态观察、体重及饮食饮水量监测、尿微量蛋白及血清CRE、BUN、GSH-PX、SOD含量或酶活性检测
给药期间每天观察大鼠的一般症状及体征,每周对体重、饮食、饮水量进行监测,并于给药第26周结束,收集6小时大鼠尿液,禁食12h,麻醉,腹主动脉采血,分离血清,进行尿微量蛋白、血清CRE、BUN含量检测,其余血清放入冻存管中,-80℃冻存,进行GSH-PX、SOD酶活性检测。
2.2.2 病理组织学检测
肾脏组织经固定、染色、封片,显微镜下观察,显微成像系统拍照记录,每只动物通过图像分析系统测量8个肾小球横截面积,统计比较各组间差异;肾小管形态变化程度参照Radford M G文献[5]进行分级评价。
2.2.3 肾脏HIF1β蛋白表达
免疫组化法,肾组织经石蜡切片脱蜡后进行抗原修复,分别孵育过氧化物酶阻断剂,5%BSA,一抗HIF1β为1∶100,二抗(1∶100),DAB显色,复染,返蓝,梯度脱水,透明,封片。镜下观察目的蛋白表达情况,通过图像分析系统测量阳性表达HIF1β的平均光密度值。
2.2.4 统计学方法
3 结果
3.1 一般状态、体重及摄食摄水量观察
各给药组动物给药期间外观体征、被毛状态、行为活动与对照组比较,均未发现异常,无呼吸音异常,眼、鼻、口周围无分泌物,未出现稀便、硬便等异常现象。体重增长、饮食、饮水量变化与对照组比较均未呈现显著性差异。
3.2 对尿微量蛋白的影响
结果可见,JMZG组尿微量蛋白有降低趋势(P<0.01),其它各给药组与对照组比较均未呈现显著性差异。详见表1。
表1 尿微量蛋白结果(±S)Table 1Urine microprotein results(±S)
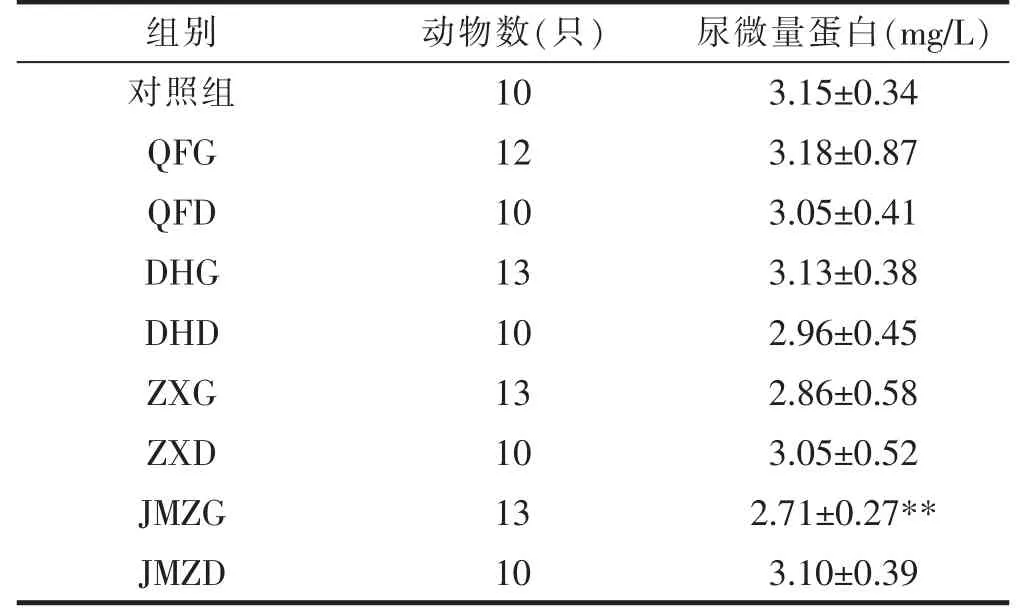
表1 尿微量蛋白结果(±S)Table 1Urine microprotein results(±S)
注:与对照组比较:**P<0.01。
组别 动物数(只) 尿微量蛋白(mg/L)对照组 QFG 10 3.15±0.34 12 10 3.18±0.87 QFD 3.05±0.41 DHG 13 3.13±0.38 DHD 10 2.96±0.45 ZXG 13 2.86±0.58 ZXD 10 3.05±0.52 JMZG 13 2.71±0.27**JMZD 10 3.10±0.39
3.3 对血清BUN、CRE、GSH-PX、SOD含量或酶活性的影响
结果可见,ZXG、ZXD、JMZD组血清CRE含量有降低趋势(P<0.01、P<0.05),ZXG、ZXD、JMZG组血清GSHPX酶活性有降低趋势(P<0.01、P<0.05),DHG、JMZD组血清SOD酶活性有降低趋势(P<0.05)。详见表2。
表2 血清BUN、CRE、GSH-PX、SOD含量或酶活性(±S)Table 2 Serum BUN,CRE,GSH-PX,SOD content or enzyme activity(±S)

表2 血清BUN、CRE、GSH-PX、SOD含量或酶活性(±S)Table 2 Serum BUN,CRE,GSH-PX,SOD content or enzyme activity(±S)
注:与对照组比较:*P<0.05,**P<0.01。
组别 动物数(只) BUN(mmol/L) CRE(μmol/L) GSH-PX(酶活力单位) SOD(U/ml)对照组 10 6.53±0.70 82.38±13.74 352.60±40.21 138.87±40.76 QFG 12 6.91±1.20 75.68±15.72 366.31±25.77 121.57±25.45 QFD 10 6.14±0.74 76.41±18.10 330.03±55.75 121.40±20.23 DHG 13 6.71±0.99 71.16±15.52 319.80±51.28 106.43±17.30*DHD 10 6.30±0.83 73.93±15.37 331.44±52.17 110.36±20.30 ZXG 13 6.57±1.15 66.55±6.77** 300.35±12.66** 130.89±16.54 ZXD 10 6.47±0.88 69.87±6.78* 317.73±36.81* 117.76±28.45 JMZG 13 5.92±0.80 73.52±11.58 303.89±16.15** 110.14±13.09 JMZD 10 5.96±1.00 67.20±7.23** 324.94±31.71 103.42±17.84*
3.4 对肾脏病理组织的影响
3.4.1 对肾小管形态变化的影响
结果可见,对照组、QFG、QFD组均有个别动物肾小管发生轻微肿胀;QFG、QFD组与对照组肾小管形态评分比较未见显著性差异;单独DH、ZX、JMZ各剂量组不同程度出现肾小管形态评分高于对照组(P<0.01、P<0.05)。详见表3、图1。

表3 肾小管变化程度分级评价结果Table 3 Renal tubule change grading evaluation results

图1 肾脏病理照片(HE,×400)Figure 1 Pathological photos of kidney(HE,×400)
3.4.2 对肾小球横截面的影响
结果可见,DHD、ZXG、JMZG组肾小球横截面面积明显大于对照组(P<0.01、P<0.05)。详见表4。
表4 对肾小球横截面的影响(±S)Table 4 Cross section of glomeruli(±S)

表4 对肾小球横截面的影响(±S)Table 4 Cross section of glomeruli(±S)
注:与对照组比较:*P<0.05,**P<0.01。
组别 动物数(只) 面积(μm2)对照组 10 7051.85±2763.95 QFG 12 10 6887.81±2505.27 QFD 6636.57±2465.49 DHG 13 7503.61±2978.00 DHD 10 8031.50±1952.43**ZXG 13 7744.38±2253.69*ZXD 10 7200.25±1731.56 JMZG 13 7565.37±2139.54*JMZD 10 7351.11±2706.74
3.5 对肾脏组织中HIF1β的表达的影响
结果可见,DH、ZX、JMZ各剂量组肾组织HIF1β表达高于对照组(P<0.01、P<0.05);QFG、QFD组与对照组比较无显著性差异。DHG、DHD、ZXG、ZXD组中HIF1β表达以肾脏远曲小管胞浆为主(图中箭头所示),近曲小管细胞胞浆中表达稍弱于远曲小管表达量;ZXG、ZXD组中HIF1β表达以肾脏近曲小管胞浆为主(图中箭头所示),远曲小管细胞胞浆中表达稍弱于远曲小管表达量。详见表5、图2。
表5 肾组织中HIF1β的表达的变化(±S)Table 5 Cross section of glomeruli(±S)

表5 肾组织中HIF1β的表达的变化(±S)Table 5 Cross section of glomeruli(±S)
注:与对照组比较:*P<0.05,***P<0.001。
组别 动物数(只) 肾脏组织中HIF1β表达对照组 QFG 10 0.257±0.018 12 0.270±0.014 QFD 10 0.260±0.017 DHG 13 0.312±0.011***DHD 10 0.276±0.017*ZXG 13 0.309±0.015***ZXD 10 0.274±0.011*JMZG 13 0.289±0.015***JMZD 10 0.274±0.008*

图2 肾脏HIF1β蛋白表达(×400)Figure 2 Expression of HIF1β protein in kidney(×400)
4 讨论
DH、ZX、JMZ是我国应用广泛、历史悠久的中药材,近年有研究报道长期大量服用会造成一定的肝损害及肾毒性反应[6-8]。QF为已上市复方中成药,由山楂、泽泻、茵陈等10味中药组成,鉴于上述报道考虑本产品长期应用是否存在安全隐患,我们有针对性的对组方中报道有肾毒性反应的DH、ZX、JMZ 3味中药分别按组方工艺进行制备,按该药材在组方中的相同剂量进行拆方研究。
正常时肾脏呈现出强大的储备和代偿能力,肾功能轻度受损时BUN、CRE可无变化,只有当肾损害达到明显程度时,BUN、CRE才明显增高[9]。在本试验条件下,ZXG、ZXD、JMZD组大鼠血清CRE含量有降低趋势,CRE的这种变化提示ZXG、ZXD、JMZD组大鼠机体可能处于代偿阶段[10]。
有文献报道[11],药物经直接作用和(或)氧化应激作用出现肾脏药源性损伤。本研究中对照组、QFG、QFD组均有个别动物肾小管发生轻微肿胀,与对照组评级比较,未见明显形态差异;单独DH、ZX、JMZ各剂量组不同程度的增加肾小管变性程度的等级及变性数量,明显高于对照组。DH、ZX、JMZ组中可以使肾小球横截面积不同程度的扩张增大,肾小管和肾小球的形态变化可能体现为药物的直接损伤作用反应。
人体内存在一套稳定的氧化和抗氧化的机制,药物诱导肾脏缺氧反应通路,其中缺氧诱导因子(HIF-1)是介导缺氧反应的重要缺氧诱导因子,当氧化应激作用超过正常水平时,将损伤机体细胞和组织进而影响肾脏,如损伤细胞组织功能,影响肾血流动力学、肾小球滤过、肾小管再吸收和分泌。SOD是体内清除自由基的主要成分,能有效缓解体内氧化应激,其活力呈现机体清除氧自由基的能力;GSH-Px为内源性抗氧化物酶,呈现机体的抗氧化能力,因此通过SOD、GSH-Px活性变化可以评价机体清除氧自由基的能力。在本试验条件下,ZXG、ZXD、JMZG组血清GSHPX酶活性及DHG、JMZD组血清SOD酶活性均明显低于对照组,说明机体的抗氧化能力可能呈现降低趋势,提示药物可能通过氧化应激作用导致肾脏出现自由基氧化代谢紊乱。
HIF-1是目前发现的唯一在缺氧状态下发挥活性的特异性转录因子,其功能介导机体适应低氧环境。存在于人体内的HIF-1是由HIF-1α和HIF-1β2个亚基组成的一种异源二聚体转录因子,目前对HIF-1α的研究较多,很少有报道关于药物导致动物肾组织中HIF-1β表达变化的研究。大黄素是一种蒽醌类物质,可以上调重症胰腺炎肾损伤模型大鼠血清中HIF-1α的表达[12]。本试验中DHG、JMZG、JMZD组中肾远曲小管上皮细胞胞浆中表达HIF1β蛋白为主、呈上调趋势,DH和JMZ中均含有大黄素,试验中HIF1β上调结果与现有报道相吻合。结合QFG、QFD组中HIF1β蛋白未见明显升高,推测单独DH、JMZ中相关成分可能诱导肾小管上皮细胞出现缺氧状态,导致HIF1β蛋白表达升高;QF配伍后相关成分可能发生了变化,因而未表现出HIF1β蛋白表达的变化。ZX主要化学成分为三萜及倍半萜类成分,和DH和JMZ的化学成分具有差异,本试验ZX组中,HIF1β蛋白在肾近曲小管上皮胞浆中表达升高为主,HIF1β的表达主要位置与DH和JMZ组具有差异。提示ZX长期服用可以诱导肾近曲小管上皮表达HIF1β升高。本试验研究发现的DH、ZX和JMZ长期给药可以上调肾小管上皮细胞中HIF1β的表达,尚需进一步探讨HIF1β在药物性肾损害中的病理机制和调控机制,HIF1β可能是药物肾脏损伤的潜在作用靶点,进行相关研究可为临床药物应用提供理论依据。
QFG、QFD组长期给药肾毒性反应程度与对照组比较均未见明显差异,提示组方以后可能具有减毒作用[13-15],QF虽然制剂中单味药DH、ZX、JMZ单独长期服用可能会增加肾脏负担,但全方长期服用并未显示出对肾脏明显的毒性反应,说明该制剂长期服用是安全的。

