UHRF1在口腔黏膜鳞癌中的表达及其对临床预后的价值研究
段贤捷,翁海燕,沈国栋,司呈云,安星妃,章礼玉,周 瑜
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)约占口腔颌面部恶性肿瘤的90%左右,具有很强的侵袭性和隐匿性,1990—2017年,我国口腔鳞癌新发病例增长280.0%,病死人数增长196.8%[1]。尽管治疗水平一直不断进步,多学科讨论模式也在持续发展,但OSCC患者的总体生存率并未得到显著改善[2]。准确的诊断和预后标志物有助于改善OSCC患者的预后,然而这方面的研究尚不完善,仍需继续筛选出与OSCC相关的新的生物标志物。
泛素样含PHD和环指域1(ubiquitin like with PHD and ring finger domains 1,UHRF1),也被称为ICBP90,是DNA甲基化和组蛋白修饰之间的重要联系[3]。UHRF1的分子结构包含多个功能域,可以通过其独特的SET和环指相关蛋白结构域与组蛋白去乙酰化酶1和DNA甲基转移酶1形成复合物[4],并将DNA甲基化模式复制到新合成的DNA中,以调节组蛋白修饰和DNA甲基化[5]。研究已证实UHRF1在多种恶性肿瘤如肝母细胞瘤、肺癌、膀胱癌、食管鳞状细胞癌等中高表达,可被用作诊断、治疗和预后效果评估的生物标志物[6-9]。UHRF1的高表达可以促进癌细胞的增殖、降低肿瘤细胞的凋亡水平并调节各种癌细胞的迁移、侵袭[10]。
这些研究表明,UHRF1是一个有价值的预后生物标志物,但迄今为止,UHRF1在口腔鳞癌发生、发展及预后中的作用尚不清楚。因此,我们对UHRF1在口腔鳞癌组织中的表达水平及其对预后的影响进行分析,了解UHRF1在口腔鳞癌中的表达情况及其临床意义。
1 资料与方法
1.1 一般资料
收集2008年12月至2016年12月间,于中国科学技术大学附属第一医院口腔颌面外科接受手术治疗的OSCC病例资料共210例。纳入标准包括:①年龄>18周岁;②病理证实的原发性口腔黏膜鳞状细胞癌;③病理资料完整;④术后随访资料完整。排除标准包括:①复发性或转移性肿瘤;②术前接受过放射治疗;③无法获得完整的临床资料或术后失访。根据以上标准,共计111例患者纳入研究。本研究符合医院伦理委员会的伦理标准,并已获得伦理委员会的批准(批件号:2022KY伦审第036号)。
1.2 免疫组织荧光染色
所有患者的病理石蜡切片均从医院病理科获得,肿瘤组织的石蜡切片固定在带电载玻片上,在二甲苯溶液中脱蜡,使用乙醇溶液再水化。抗原修复及血清封闭后,应用UHRF1特异性一级抗体(1∶200稀释;abs136449;中国上海Absin)滴加在标本上,4 ℃孵育过夜,加入相应二抗,DAPI复染细胞核。使用Ⅸ71荧光显微镜(奥林巴斯,日本)对两种抗原的定位及定量分析,并采集图片。肿瘤浸润前沿(Invasive tumor front,ITF)定义为位于肿瘤与宿主组织和器官交界处的3~6层细胞或散在浸润的细胞团,癌旁正常组织为距离肿瘤边缘>1 cm的正常组织。
1.3 浸润深度的测量
所有肿瘤石蜡切片的病理标本均由两名的头颈病理学专家单独进行评估,并通过数字显微镜和计算机(奥利巴斯生物显微镜,BX53F,日本)测量浸润深度。浸润深度按照国际公认的标准,其定义为:从邻近正常黏膜基底膜距肿瘤侵袭最前沿的垂直距离。具体测量是根据口腔鳞癌患者肿瘤标本的HE染色切片,连接距离肿瘤两侧最近正常黏膜上皮的基底膜做一条直线,将此直线至肿瘤侵袭最深处的垂直距离作为浸润深度。
1.4 染色结果判定及分组依据
染色结果均由两位头颈病理学专家单独观察,通过免疫反应强度分布指数(immunoreactivity intensity distribution index, IRIDI)进行定量分析。IRIDI是染色强度的评分与阳性细胞分布的评分的乘积[11]。染色强度得分如下,不染色:0分;染色:1分;中等染色:2分;强染色:3分。阳性细胞分布得分如下:阳性细胞<5%,0分;6%~25%阳性细胞,1分;26%~50%阳性细胞,2分;51%~75%阳性细胞,3分;阳性细胞超过75%,4分。对于每个样本,最终得分是5个随机视野的IRIDI平均值。根据IRIDI,我们按患者UHRF1表达水平分为低表达组(得分≤4)和高表达组(得分>4)。
1.5 预后指标
病理淋巴结阳性是术中行选择性颈淋巴结清扫,术后病理显示清扫的颈淋巴结有癌细胞累及;术后局部复发和颈淋巴结转移的标准为手术后至少3个月以上发生的由组织病理学证实的局部肿瘤再生或颈部淋巴结转移[12]。
1.6 统计学分析
统计软件采用SPSS(26.0,IBM)进行数据分析,计量资料采用方差分析,组间比较使用LSD法分析,分类资料采用卡方检验,精准检验使用Fisher确切概率法。运用Kaplan-Meier法分析口腔鳞癌组织中UHRF1表达水平对患者生存时间的影响,组间差异采用Log-rank方法比较。采用Cox比例风险模型对影响口腔鳞癌患者预后的危险因素进行分析,计算危险比(hazard ratios,HR)。若P<0.05则认为结果具有统计学意义。
2 结 果
2.1 UHRF1在口腔鳞癌中的表达
UHRF1在口腔鳞癌组织中表达如图1所示,在111例口腔鳞癌患者的组织切片中,UHRF1在肿瘤组织中明显高表达。使用方差分析比较了肿瘤组织与癌旁正常组织、以及肿瘤组织与肿瘤侵袭前沿的UHRF1表达水平的差异,结果显示,肿瘤组织的UHRF1表达水平较癌旁正常组织(P<0.001)或肿瘤侵袭前沿(P<0.001)均显著增高(图1)。

口腔鳞癌患者癌旁正常组织(A)、肿瘤侵袭前沿(B)及肿瘤组织(C)HE染色切片;口腔鳞癌患者癌旁正常组织(D)、侵袭前沿(E)及肿瘤组织(F)UHRF1蛋白免疫荧光染色切片;G:患者肿瘤组织、侵袭前沿及正常组织UHRF1表达差异。****为P<0.0001
2.2 UHRF1表达水平与患者临床病理特征的关系
我们根据染色结果,将患者分为UHRF1高表达组和低表达组,其中高表达组66例,占59.5%;低表达组45例,占40.5%。患者的临床病理特征及其与UHRF1表达的关系如表1所示,与UHRF1表达水平相关的临床病理特征包括:患者的性别(P=0.014)、肿瘤大小(P=0.024)及浸润深度(P<0.001)。

表1 UHRF1表达水平与患者基本临床病理特征的关系
2.3 UHRF1表达水平对患者术后局部复发的影响
入组患者中出现肿瘤术后局部复发的共有40人,占36.0%。UHRF1高表达组患者术后肿瘤局部复发有33人,复发率为50.0%,低表达组复发7人,复发率为15.6%。使用Fisher确切概率法比较两组患者术后局部复发的差异,结果如图2所示,UHRF1高表达的患者其术后复发率明显高于低表达组(P<0.001)。

***:P<0.001
2.4 UHRF1表达水平对患者颈淋巴结转移的影响
本研究中,出现术后颈淋巴结转移的患者共20例,占18.0%,其中UHRF1高表达组中,颈淋巴结转移的患者有16例,占24.2%;低表达组术后颈淋巴结转移4例,占8.9%。使用Fisher确切概率法比较两组患者颈淋巴结转移的差异,结果如图3所示,高表达组的颈淋巴结转移率明显高于低表达组(P=0.046)。

*:P<0.05
2.5 UHRF1表达水平对患者病理淋巴结阳性的影响
入组患者术中接受选择性颈淋巴结清扫的有83人,19人病理淋巴结阳性,占22.9%。其中,UHRF1高表达组中18人病理淋巴结阳性,占所有病理淋巴结阳性患者的94.7%。使用Fisher确切概率法比较两组患者病理淋巴结阳性的差异,结果显示,在UHRF1高表达组与低表达组患者之间,病理淋巴结阳性率存在显著差异(36.0%vs.3.0%,P<0.001,图4)。

***:P<0.001
2.6 UHRF1表达水平对患者生存率的影响
UHRF1表达水平对患者生存率的影响如图5所示,使用Log rank比较两组间生存率的差异,结果显示,UHRF1高表达组与低表达组之间,患者的5年总体生存率(33.3%vs.73.3%,P<0.001)、疾病特异性生存率(37.3%vs.76.7%,P<0.001)和无疾病生存率(28.8%vs.71.1%,P<0.001)均存在明显差异。

UHRF1低表达组与高表达组患者总体生存率(A)、疾病特异性生存率(B)及无疾病生存率(C)之间的差异(P<0.001)
2.7 Cox风险回归模型
在单变量分析中,浸润深度的大小(P=0.001)、UHRF1表达(P<0.001)、隐匿性淋巴结阳性(P=0.005)、术后局部复发(P<0.001)及术后颈淋巴转移(P<0.001)均与患者的生存率有关(表2)。通过单变量分析,我们筛选出与患者生存率相关的危险因素进行多变量分析,结果显示,肿瘤组织的UHRF1表达水平(P=0.002)、颈淋巴结转移(P<0.001)及术后局部复发(P<0.001)是影响患者生存率的重要危险因素(表3)。
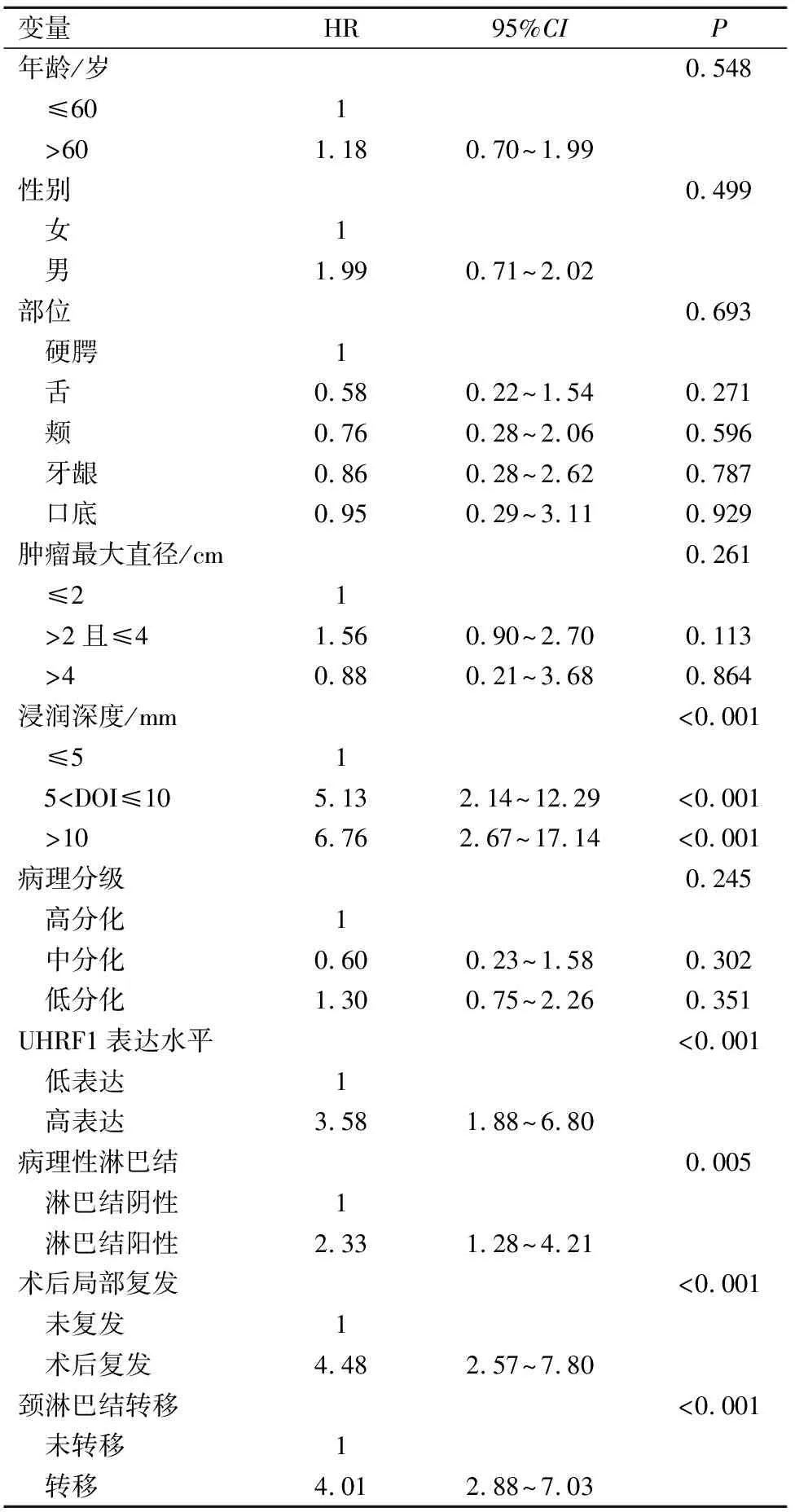
表2 患者单变量Cox回归分析

表3 患者多变量Cox回归分析
3 讨 论
口腔鳞状细胞癌(OSCC)是头颈部鳞状细胞癌的重要组成部分,其发病率占全身恶性肿瘤的3%~5%[13]。尽管治疗技术和理念在不断进步,但口腔鳞癌的总体生存率并没有显著改善。术后复发及转移是导致患者手术失败的主要原因,一旦出现复发或转移,患者的生存率则明显下降[14]。因此,如何控制术后复发及转移是改善患者预后的关键。
影响口腔癌患者预后的主要因素包括肿瘤的发生部位、大小、病理分级、浸润深度(depth of Invasion,DOI)、淋巴结外扩展(extranodal extension,ENE)、神经周侵犯(perineural invasion,PNI)、脉管栓塞、切缘阳性等[15]。但在临床上发现,即使一些预后指标良好的口腔癌患者,术后复发及颈淋巴结转移率也很高。因此,影响口腔鳞癌预后的指标可能远不止以上这些。随着对口腔鳞癌生物学分子机制的探索,许多影响肿瘤侵袭与增殖的相关分子也被用于指导患者的治疗及预后,如DLX6、CLDN17等[16-17]。而大量的研究显示,UHRF1在许多恶性肿瘤中高表达,并与肿瘤的转移、侵袭、增殖等恶性行为密切相关[6-9],但是UHRF1在OSCC中的表达及功能研究甚少。
本研究通过免疫荧光染色,发现UHRF1在OSCC肿瘤组织中明显高表达(P<0.001),UHRF1表达水平与患者的性别、肿瘤大小及浸润深度有关(P<0.05)。另外,浸润深度已被纳入第八版TNM分期系统,对口腔癌患者的颈淋巴结转移、术后局部复发及生存率有很好的预测作用,是影响患者预后的重要危险因素[18]。而本研究数据表明,UHRF1高表达的患者,其浸润深度也较高(P<0.001)。其次,数据显示,患者的性别也与UHRF1表达水平有关,男性患者的UHRF1表达水平明显高于女性患者(P=0.014),这可能与男性患者吸烟量多于女性有关。据报道,安徽省30岁以上的男性吸烟人数比例高达57.6%,而女性仅为5.8%[19]。在Unoki等[7]的研究中也发现,UHRF1在男性患者中的表达水平显著高于女性患者,且与患者的吸烟有关,这与本研究结果发现一致。
肿瘤的转移与复发是导致口腔鳞癌患者预后不良的主要因素[14]。本研究发现,UHRF1的表达水平与患者的术后局部复发(P<0.001)及颈淋巴结转移密切相关(P=0.046)。UHRF1高表达的口腔癌患者通常存在着较高的术后局部复发率及颈淋巴结转移率,因此对于UHRF1高表达的患者,应给予更为积极的治疗方式,包括同期颈淋巴结清扫或增加术后辅助治疗,提高患者的生存率。
为提高患者生存率,如何在早期识别出颈部转移及何时选择颈淋巴清扫术尤为重要,因为即使是早期OSCC中仍约有20%的颈部隐匿性淋巴结转移无法发现[20]。对转移风险较大的OSCC患者,可以在术中选择颈淋巴结清扫,提高患者术后的生存率。本研究入组患者共有83例术中行颈淋巴结清扫,术后19例病理示淋巴结阳性,其中18例的UHRF1高表达。数据显示UHRF1表达水平与病理淋巴结阳性有显著关系(P<0.001),UHRF1高表达的口腔鳞癌患者,其病理淋巴结阳性率也较高。通过分析OSCC患者中UHRF1表达水平与生存率之间的相关性,结果显示,UHRF1高表达的OSCC患者的5年总体生存率、疾病特异性生存率和无疾病生存率均显著低于低表达组的患者(P<0.001)。在单变量分析中,UHRF1表达水平、浸润深度、病理淋巴结阳性、术后局部复发及术后颈淋巴结转移影响患者生存率的暴露因素(P<0.05,表2)。而多变量分析结果显示,UHRF1表达水平(HR:2.93,95%CI:1.48~5.81,P=0.002)、术后颈淋巴结转移(HR:2.75,95%CI:1.56~4.83,P<0.001)及术后局部复发(HR:3.20,95%CI:1.81~5.68,P<0.001)是影响患者生存率的危险因素,UHRF1作为影响OSCC患者生存率的重要危险因素,其高表达组死亡风险是低表达组的2.93倍。
目前,UHRF1在肿瘤中的作用尚存在争议。尽管大量的研究表明,高表达的UHRF1与患者的不良预后有关[6-9],但在肝癌细胞中发现,UHRF1缺陷型的癌细胞,可以诱导上皮间充质转化的发生,从而增加细胞的增殖、迁移及侵袭能力[21]。而我们的研究结果显示,UHRF1在口腔鳞癌肿瘤组织中表达水平明显高于侵袭前沿及癌旁正常组织(P<0.001)。在口腔鳞癌患者中,UHRF1的高表达的意味着更高的肿瘤局部复发率及颈淋巴结转移率(P<0.05),这些患者的生存率也明显降低(P<0.001),UHRF1可以作为口腔鳞癌重要的预后指标。但UHRF1引起口腔鳞癌发生、发展、迁移、侵袭等生物学行为的机制还需进一步探索。

