水-甘油通道蛋白与砷代谢对人类疾病的影响
王晓臻,王晓雯,王 乙,王倩倩,曹亦菲
(杭州师范大学 公共卫生学院,浙江 杭州 311121)
砷广泛分布在自然界的土壤和矿藏中,是一种类金属物质,也是公认的致癌物。人类长期暴露于砷会导致肺癌、膀胱癌和皮肤癌等癌症,还会导致心血管疾病、肠胃炎、糖尿病、生殖疾病和外周神经病变等疾病[1-2]。虽然砷具有毒性,但砷化合物被用作药物治疗疾病在东西方已有千年历史[3]。
水-甘油通道蛋白(aquaglyceroporins, AQPs)是转运水、甘油和二氧化碳等小分子的特异性通道蛋白,砷进入机体的主要方式为通过AQPs进出细胞。本文讨论AQPs在砷运输中的作用、AQPs与p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)的相互关系,以及对各种人类疾病的功能影响。
1 水-甘油通道蛋白作为类金属转运蛋白
水-甘油通道蛋白是主要内在蛋白(major intrinsic protein,MIP)超家族的成员,水、甘油、二氧化碳和尿素等小分子溶质可以借助该家族蛋白在细胞间转运。MIP超家族有三个亚家族:水通道蛋白,水-甘油通道蛋白和超水通道蛋白[4-5]。其中AQPs在大多数生物中广泛存在[6],在原核生物、真核生物和哺乳动物中皆有发现。有研究显示,将砷作用于小鼠的不同组织中,AQPs mRNA在小鼠的食道、肾脏、心脏和肝组织的表达水平都有明显升高[7]。AQPs主要负责三价砷进入细胞[8]。亚砷酸盐[As(Ⅲ)]和砷酸盐[As(Ⅴ)]是砷的两种重要的氧化形态,As(Ⅴ)的毒性远小于As(Ⅲ)。As(Ⅴ)在溶液中,以氧阴离子的形式存在,它的性质与磷酸盐类似,是许多酶的竞争性抑制剂。一般情况下,当细胞内磷酸盐水平足够高时,As(Ⅴ)不会直接引起砷毒性。而As(Ⅲ)则以As(OH)3的形式在溶液中存在,其性质类似于甘油,是一种无机多元醇,又因为AQPs是一种双向通道,它的孔隙可以让甘油等分子通过,因此,As(Ⅲ)可以通过AQPs进入细胞[9]。
2 砷在生物体中的运输
2.1 砷在原核生物中的运输 1972年,Richey等[10]证明水-甘油通道蛋白(glycerol facilitator protein,GlpF)可以促进甘油的扩散。1997年,Barry P. Rosen团队[11]首次发现在大肠杆菌中,As(Ⅲ)可以通过GlpF进入细胞。2004年,该团队在缺失砷抗性操纵子arsRBC的AW3110大肠杆菌和利用转位子TnphoA插入glpF基因建立的OSBR1突变体中,观察As(Ⅲ)的吸收率,结果发现破坏glpF基因会大大降低As(Ⅲ)的吸收率[12],这表明GlpF是As(Ⅲ)进入细胞的主要吸收途径。水-甘油通道蛋白还可与其他蛋白合作产生累加效应。2008年,Singh等[13]在一种名为墨角藻的耐砷海藻中鉴定出一种砷螯合金属硫蛋白(arsenic-chelating metallothionein,fMT),在大肠杆菌中表达fMT时,fMT和GlpF在一起可以增加亚砷酸盐的吸收。同时AQPs也是砷的一种外排途径。豆科植物共生体苜蓿中华根瘤菌会利用水-甘油通道蛋白(AqpS,GlpF同系物)作为砷的解毒途径[14]。研究表明,当苜蓿根瘤菌暴露于As(Ⅴ)环境时,As(Ⅴ)通过磷酸盐转运系统进入细胞,并被砷酸盐还原酶ArsC还原为As(Ⅲ),然后通过AqpS沿着浓度梯度流出细胞[15]。同样,甲基亚砷酸盐[Mas(Ⅲ)]也可通过AqpS沿着浓度梯度流入苜蓿细胞,在那里被抗Mas(Ⅲ)蛋白ArsH氧化成甲基砷酸盐Mas(Ⅴ),然后Mas(Ⅴ)也通过AqpS沿着浓度梯度流出细胞,是Mas(Ⅲ)的解毒途径[15]。
因此,在原核生物中,水-甘油通道蛋白既可以吸收As(Ⅲ),也可以外排As(Ⅲ)。如图1所示,在大肠杆菌和苜蓿根瘤菌中,砷酸盐都是由磷酸盐转运体带入细胞的[9]。大肠杆菌arsRDABC操纵子编码的砷伴侣蛋白ArsD与As(Ⅲ)的外排泵蛋白ArsA之间的交互作用,可以在较低的亚砷酸盐浓度下提高其ATPase活性,提高As(Ⅲ)的排出速率[16]。Mas(Ⅲ)通过AqpS沿着浓度梯度流入苜蓿细胞,被抗Mas(Ⅲ)蛋白ArsH氧化成甲基砷酸盐Mas(Ⅴ),然后Mas(Ⅴ)通过AqpS沿着浓度梯度流出细胞。
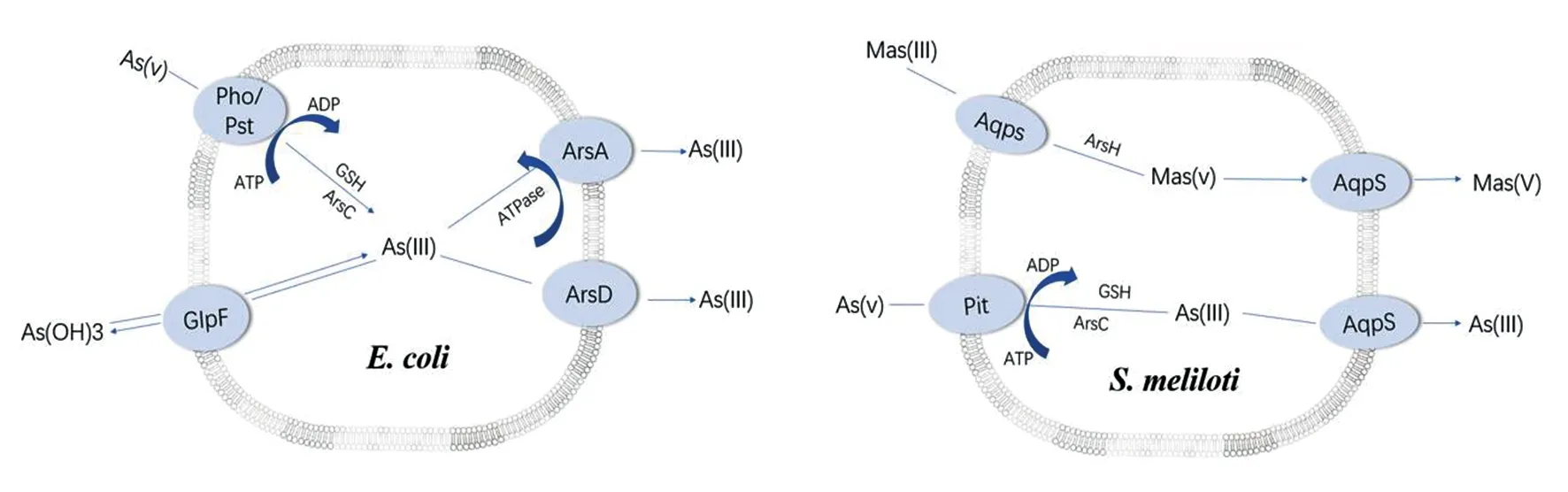
图1 砷在大肠杆菌和苜蓿中华根瘤菌的进入和流出途径
2.2 砷在真核生物中的运输 2001年,Wysocki等[17]首次发现酿酒酵母FPS1基因编码的水-甘油通道蛋白Fps1p可以介导As(Ⅲ)的摄取,FPS1基因的缺失可提高对As(Ⅲ)的耐受性。Fps1p通道组成性表达的细胞对砷高度敏感。在高渗透压条件下,当Fps1p通道关闭时,野生型细胞显示出与fps1Δ突变体(缺失FPS1基因)同等程度对As(Ⅲ)的耐受性。因此,Fps1p介导的通路参与酵母中类金属的吸收。在进一步的研究中,Maciaszczyk等[18]发现在培养基中加入As(Ⅲ)后,为了阻止细胞吸收As(Ⅲ),FPS1基因早期的表达会下调,但当砷中毒持续存在时,它的表达反而会再次增加,Fps1p与亚砷酸盐转运蛋白Acr3p协同调节排出As(Ⅲ)。这表明Fps1p在砷的解毒中也起着生理作用。另外在酵母水通道蛋白无效突变体和非洲爪蟾卵母细胞的异源系统中表达了三种已知的布氏锥虫水-甘油通道蛋白(TbAQPs),发现这两种表达系统中,三种TbAQPs在合适的PH下都介导了As(Ⅲ)在细胞内的摄入和排出[19],表明TbAQPs也是砷进出细胞的通道之一。
在哺乳动物中,1993年,Agre等[20]首次从红细胞膜上发现了AQP1,直到目前,已发现13个水通道蛋白(AQP)[21]。其中水-甘油通道蛋白主要有AQP3、AQP7、AQP9和AQP10。2002年,Liu等[22]发现非洲爪蟾卵母细胞显微注射AQP7或AQP9 cRNA探针后,73As(Ⅲ)转运增加。这些结果表明,AQP9和AQP7可能是哺乳动物细胞摄取As(Ⅲ)的主要途径。2004年,Liu等[23]进一步发现AQP7和AQP9在酿酒酵母和卵母细胞中表达时可以转运73As(Ⅲ),并且AQP9似乎是As(Ⅲ)最有效的转运体。在具体的动物实验中,王春等[24]使用SPF级雄性ICR小鼠研究三价砷在小鼠胃肠道中的转运与AQPs表达的关系,发现胃肠组织均表达AQP3,胃组织表达水平最高,AQP9在胃组织中也表达,小肠组织表达AQP7,给予AQPs抑制剂后能抑制小鼠胃肠组织吸收砷,提示AQPs与砷在胃肠道的生物转运有关。Hamdi等[25]从斑马鱼cDNA中克隆了5个与人AQP3,AQP9和AQP10同源的基因,将它们命名为aqps。在砷的刺激下,检测到它们在斑马鱼多个器官中表达,表明aqps是斑马鱼中砷摄入的主要途径。本团队之前的研究发现,在哺乳动物细胞中,砷能调节AQP9的表达和磷酸化水平,表明AQP9也是哺乳动物细胞中砷摄入的主要途径[26]。
2.3 p38 MAPK蛋白激酶对AQP9表达和砷运输的影响 AQP9是主要的肝脏水-甘油通道蛋白,它同时传导无机As(Ⅲ)和有机单甲基亚砷酸[MMA(Ⅲ)],MMA(Ⅲ)是细胞甲基化过程中产生的中间产物。已证明AQP9是一种参与砷吸收的跨膜蛋白[8],它可能在无机As(Ⅲ)从血液流入肝脏和As代谢物MMA(Ⅲ)从肝脏流出到血液的过程中发挥重要作用[27]。过量表达AQP9能提高肝癌细胞的增殖抑制率和凋亡率,抑制AQP9表达则相反[28]。2012年,有研究首次报道利什曼原虫水-甘油通道蛋白的活性受MAPK蛋白激酶的调节[29]。不同的AQP可以由不同的MAPKs信号转导途径调节。Yang等[30]研究表明,砷刺激增加了大鼠星形胶质细胞中的AQP3、-4、-5、-8和-9的表达,细胞外调节蛋白激酶抑制剂可减弱砷暴露后AQP3、-5和-8的表达,而p38 MAPK蛋白激酶抑制剂抑制了AQP4和AQP9的表达。邓卢翠等[31]的研究显示,p38 MAPK在正常肝细胞L-02中对AQP9磷酸化有一定的调控作用。这表明调节MAPKs活性将影响AQP的表达,p38 MAPK与AQP4和AQP9的表达有关联。2013年,Johnson等[32]通过筛选酿酒酵母(Saccharomycescerevisiae)的全套基因缺失突变体,发现了75个对As(Ⅲ)敏感的突变体和39个对As(Ⅲ)抗性突变体。他们首次将转录因子yap3p与细胞对As(Ⅲ)的解毒作用联系在一起,证实Hog1p MAPK通路在抗砷中毒的作用[32],Maciaszczyk等[18]也发现蛋白激酶Hog1p可以使酿酒酵母中的Fps1p下调从而减少As(Ⅲ)的摄取。还有研究发现p38 MAPK在砷诱导细胞凋亡时期具有抑制作用,但也有研究显示当p38 MAPK受到砷刺激时,表达量也会增高,加速细胞凋亡[33]。以上研究表明p38 MAPK的表达在抗砷毒性的过程中,可能与AQP9的表达关联紧密,但目前相关方面的研究未见较多报道,还有待深入。对于砷诱导细胞凋亡的机制,p38 MAPK的作用也仍有争议。
3 水甘油通道蛋白与砷运输对人类疾病的影响
砷作为药物已经有悠久的历史。As2O3现在常被用作治疗急性早幼粒细胞白血病(APL)。2004年,Bhattacharjee等[34]首次发现AQP9可以调节人白血病细胞的药物敏感性,低剂量的As2O3与维生素D联合使用,与避免毒性的化疗方案一样有效。他们用维生素D对HL60细胞进行预处理,结果显示AQP9的表达较高,并且对As(Ⅲ)和Sb(Ⅲ)有超敏性。这种敏感性归因于随着AQP9药物吸收系统表达的增加,三价类金属的吸收率增高。同样,Iriyama等[35]发现过表达AQP9后,肝癌细胞的增殖抑制率和凋亡率高于单纯As2O3组,抑制AQP9表达则相反,提示AQP9的表达增多,可增强某些肿瘤细胞对As2O3化疗的敏感性。这与唐洁[28]的研究结果一致。
全反式维甲酸(all-trans retinoic acid, ATRA)和三氧化二砷(ATO)是治疗APL的有效诱导疗法。由于APL治疗期间,早期血栓出血并发症和死亡率仍然很高,为了研究ATRA启动时间和ATO的纳入对患者预后的影响,一项2000—2017年期间接受APL治疗的所有患者临床记录的回顾性研究显示,早期运用ATRA治疗降低了APL患者的早期不良事件,ATO的加入有助于进一步改善APL的早期和晚期预后,结果显示ATRA和As2O3之间可能存在着协同作用[36]。Leung等[37]研究表明,ATRA预处理髓系白血病细胞株HL-60后,可上调AQP9,显著增加砷吸收。但也有研究发现AQP1和AQP5是一些肿瘤增殖的参与蛋白,会减少砷类化合物在肿瘤灶内的积蓄程度[38]。
除了治疗白血病,三氧化二砷也可以联合其他化疗药物、激素类药物等治疗其他肿瘤疾病。一项研究哺乳动物砷转运蛋白AQPs和葡萄糖转运蛋白1(GLUT1)在1型糖尿病(T1DM)小鼠中的表达研究表明,AQPs的表达受胰岛素水平的调节,在糖尿病模型中,胰岛素降低了肝脏和大脑中AQP9基因的表达,T1DM可能增加了三价无机砷转运蛋白的表达,从而增加了特定组织对砷的摄取[39]。因此,了解含砷药物的作用机制及与各类药物的联合作用机制,阐明药物输导的途径及其调节因子非常重要。
4 小结
目前,大量研究均表明砷剂能够应用于临床治疗多种疾病,且具有较好的疗效。AQPs的功能与砷在人体的代谢过程密切相关,了解AQPs与砷之间的作用机制对研究如何使用砷剂对疾病进行靶向治疗具有重要意义。然而同砷既具毒性又具药性的性质类似,在一定的条件下,AQPs协助砷出入细胞,既可以发挥砷治疗疾病的特性,也可能会增加砷毒性在机体的累积而引起砷相关疾病。AQP在饥饿状态下与肝细胞的糖异生水平有关,在饥饿状态下,AQP9的表达会增加[40],因此,在营养不良时摄入砷会增加发生肝砷中毒的可能[41]。Sumi等[7]研究发现在小鼠腹腔注射As(Ⅲ)后,食道是砷高度积累的器官,其中AQP3高表达、mrp2抗体低表达、谷胱甘肽合成能力低和Nrf2通路激活少都可能增加了砷暴露对食道功能产生不利影响的可能性[7]。p38 MAPK信号通路等调节因子对AQPs的表达和砷对机体作用之间的相关机制也还具有争议。因此,研究在砷转运中起重要作用的AQPs以及多种信号通路和调节因子的相互作用机制,对研究砷的毒作用机制及药用机制可以提供重要的依据,AQPs与p38 MAPK信号通路和砷之间的相互作用的研究也是我们继续深入研究的方向。

