产朊假丝酵母富硒条件的优化及发酵罐培养
马楚楚,陈帅君,赵宝顶,唐伦霞,童应凯,边嘉宾
(天津农学院 农学与资源环境学院,天津 300392)
硒元素是1817年由ALLAN等[1]首次发现,在之后的几十年里,硒被认为是一种有毒的重金属物质,高剂量的硒对生物体有较大的毒性和致癌性[2]。但在1949年,CLAYTON等[3]研究发现,摄入适量的硒能够减少肿瘤的发生率。1957年,SCHWARZ等[4]通过大鼠试验证明在食物中加入适量的硒能够阻止肝脏坏死。1973年,TURNER等[5]证实硒元素是组成甘氨酸还原酶系统的必需元素。1976年,对该酶硒蛋白组分的化学特征进行研究,证实了有机硒组分为硒代半胱氨酸[6]。
缺硒会引发许多疾病,如抑郁症、心血管疾病、肿瘤、甲状腺功能紊乱、病毒性疾病(如流行性感冒,HIV,埃博拉),精子活性低等[7-9]。补充适量的硒可有效预防此类疾病的发生。1988年,我国把硒元素列为食物中必需的营养元素之一[10]。当今富硒产品主要有富硒植物、富硒鸡蛋、富硒牛奶和富硒酵母,其中最常见的市售硒源是富硒酵母[11]。
产朊假丝酵母(Candida utilis)可以产生大量单细胞蛋白,作为美国食品药品监督管理局评价食品添加剂安全性指标(Generally regarded as safe,GRAS)微生物,具有十分广阔的应用前景[12]。本研究以产朊假丝酵母为出发菌株,向酵母培养液中加入一定量的Na2SeO3,通过酵母的生物转化作用,把无机硒转变为有机硒[13],以获得富硒产朊假丝酵母,将其制备成饲料添加剂饲喂家畜家禽,从而获得富硒农产品。
1 材料与方法
1.1 试验材料
1.1.1 菌种
产朊假丝酵母(C. utilis),保藏于天津农学院生物技术系微生物菌种保藏中心。
1.1.2 培养基
斜面培养基:葡萄糖20.0 g/L,蛋白胨 10.0 g/L,酵母膏 10.0 g/L,琼脂20.0 g/L,pH 6.0。
种子培养基:葡萄糖 20.0 g/L,蛋白胨 10.0 g/L,酵母膏 10.0 g/L,pH 6.0。
发酵培养基:葡萄糖30.0 g/L,硫酸铵8.0 g/L,磷酸二氢钾3.0 g/L,硫酸镁0.25 g/L,pH 6.0。
补料培养基:葡萄糖150 g/L,硫酸铵18 g/L,磷酸二氢钾6.75 g/L,硫酸镁1.125 g/L(灭菌时,葡萄糖与其他成分分开灭菌)。
1.1.3 仪器设备
可见分光光度计(UNIC-UV2100)、电热恒温培养箱(DHP-9052B,上海一恒科学仪器有限公司)、立式压力蒸汽灭菌锅(LDZX-30FBS,上海申安医疗器械厂)、电子天平(ACR120,梅特勒-托利多仪器)、摇床(HNY-2112F,天津欧诺仪器股份有限公司)、电热鼓风干燥箱(DHG-9140A,上海一恒科学仪器有限公司)、离心机(LXJ-IIB,飞鸽牌)、数显恒温水浴锅(HH-4,瑞华仪器制造有限公司)。
1.1.4 药品
亚硒酸钠、硫酸镁、亚硒酸、盐酸苯肼、变色酸、3,5-二硝基水杨酸,成都艾科科技有限公司;EDTA二钠、氯酸钾、高氯酸、浓盐酸、浓硝酸、葡萄糖、重苯酚、亚硫酸钠、硫酸氢二钾,国药集团化学试剂有限工商网;酵母浸出膏、蛋白胨、氢氧化钠、酒石酸钾钠,北京奥博星生物技术有限公司。
1.2 试验方法
1.2.1 菌株生长曲线的绘制
将石蜡管封存的菌种接种在斜面培养基中,培养12 h后挑取一环接于种子培养基中,培养18 h后按8%接种量接种于发酵培养基中,然后每2 h取样1次,样品稀释10倍,测定在600 nm处的吸光度,绘制标准曲线。
1.2.2 硒质量浓度对酵母富集有机硒的影响
设置初始硒质量浓度为0,5,10,15,20,25,30 μg/mL,装液量为40 mL/250mL广口三角瓶(下同),初始pH 6.0,培养时间35 h,温度29 ℃,转速200 r/min。在发酵对数期后期(12 h)向培养基中添加Na2SeO3[14],发酵至35 h时,取出发酵液,离心洗涤3次,测定生物量和硒含量。
1.2.3 硒添加方式对酵母富集有机硒的影响
设置5组试验方案:①在12 h一次性添加10 μg/mL Na2SeO3;②分别在12 h 和 16 h 添加5 μg/mL Na2SeO3;③在 12 h 一次性添加 15 μg/mL Na2SeO3;④分别在12 h和16 h添加5 μg/mL和10 μg/mL Na2SeO3;⑤分别在12 h和16 h添加10 μg/mL和5 μg/mL Na2SeO3。发酵条件按照1.2.2试验中最优方案操作。
1.2.4 初始pH对酵母富集有机硒的影响
调节发酵培养基初始pH分别为4.0、4.5、5.0、5.5、6.0、6.5、7.0,发酵条件按照1.2.3试验中最优方案操作,发酵完毕后测定生物量和硒含量。
1.2.5 摇瓶装液量对酵母富集有机硒的影响
设置装液量分别为30、35、40、45、50、55、60 mL 7个梯度,试验方案按照1.2.4试验中最优方案操作,发酵完毕后测定生物量和硒含量。
1.2.6 正交试验
根据上述单因素试验,选择硒质量浓度(μg/mL),接种量(%),培养基初始 pH,装液量(mL)4个因素,制定3个水平,进行L9(34)正交试验,正交试验表如表1所示。

表1 正交试验实施表
1.2.7 发酵罐分批培养
试管斜面活化12 h后接种于种子培养基中培养18 h,然后按10%接种量接于发酵罐中,装液量为4 L/7 L发酵罐,温度为29 ℃,通过自动流加3 mol/L H2SO4或3 mol/L NaOH进行调节,pH恒定为5.5,初始搅拌转速为300 r/min,溶氧控制在30%,接种0.5 h后与转速偶联。每2 h取一次样,测定糖含量和生物量。
1.2.8 发酵罐分批补料培养
前期同分批培养,在葡萄糖消耗完后以 100 mL/h流加补料培养基补料10 h。每2 h取样一次,测定生物量和残糖量。
1.2.9 发酵罐分批补料加硒试验
培养条件与方法同分批补料培养,在26 h和37 h 分别加入 Na2SeO320 μg/mL 和 10 μg/mL,测定硒含量。
1.3 指标分析方法
1.3.1 酵母生物量(DCW)的测定[14]
取30 mL发酵液于50 mL离心管中,3 000 r/min离心10 min,蒸馏水离心漩涡震荡洗涤3次,将得到的湿菌体于80 ℃烘箱中烘干至恒重,计算酵母细胞干重。
1.3.2 葡萄糖浓度的测定
采用3,5-二硝基水杨酸法[15]。
1.3.3 硒含量的测定
采用催化分光光度法[16]。
发酵液中总有机硒含量(μg/L)=菌体有机硒(μg/g)×DCW(g/L)
发酵液中有机硒得率/%=发酵液中总有机硒含量(μg/L)/初始添加的无机硒质量浓度(μg/L)
2 结果与分析
2.1 菌株生长曲线
研究表明,酵母细胞在对数期吸收硒的能力最高[17]。由菌株生长曲线可知,酵母在培养 12 h时开始由对数期进入稳定期(图1)。因此选择在培养时间12 h时加入无机硒Na2SeO3。
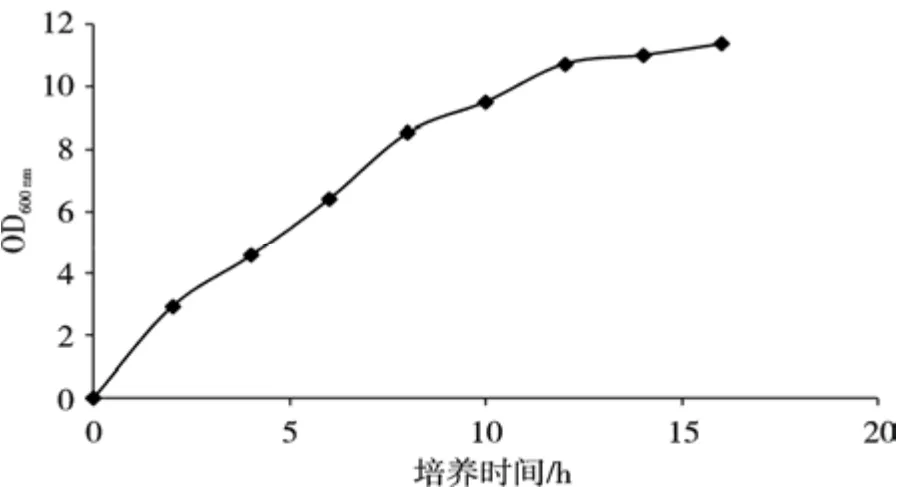
图1 菌体生长曲线
2.2 硒质量浓度对酵母富集有机硒的影响
由图2可知,在硒质量浓度0~30 μg/mL范围内,随着硒质量浓度的增加,酵母生物量逐渐下降,由9.893 g/L下降至3.908 g/L,可见无机硒对酵母的生长具有抑制作用,且质量浓度越大,这种抑制作用越强。在硒质量浓度为25 μg/mL和30 μg/mL时,发酵液颜色略显红色,这是由于处于较高的质量浓度时,无机硒被还原为单质硒,致使发酵液颜色呈红色。在硒质量浓度为20 μg/mL时,总有机硒含量最高,达到9 954.4 μg/L,但有机硒得率(49.77%)和生物量(4.75 g/L)普遍比硒质量浓度为15 μg/mL(有机硒得率56.8%,生物量5.84 g/L)时偏低。由于所获得的产品为菌液,在获得有机硒越来越多的同时,应保证菌液中无机硒不能增长过快,否则对饲养动物有较大毒害作用。因此,选择15 μg/mL为最适硒添加质量浓度。

图2 硒质量浓度对酵母富集有机硒的影响
2.3 硒添加方式对酵母富集有机硒影响
由图3可知,从发酵液中总有机硒含量、DCW两个指标来看,在培养12 h一次性加入无机硒15 μg/mL时,两个指标在5组数据中均最高。因此,在后续试验中,选择培养12 h时一次性加入无机硒 15 μg/mL。

图3 硒添加方式对酵母富集有机硒的影响
2.4 初始pH对酵母富集有机硒的影响
pH对酵母细胞膜的透性有重要影响,从而影响酵母对硒元素的生物转化。由图4所示,初始pH对酵母生物量及硒富集量均有一定的影响。pH过低或过高都会抑制酵母的生长和对硒的吸收,当培养基初始pH值为6.0时,发酵液中总有机硒含量最高。因此,后续试验中培养基适宜的初始pH为6.0。

图4 初始pH对酵母富集有机硒的影响
2.5 摇瓶装液量对酵母富集有机硒的影响
由图5可知,摇瓶装液量越多,越有利于菌株对硒的富集,但得到的生物量较少,而摇瓶装液量越少,菌体对硒的富集量越少,但有较高的生物量。根据发酵液中总有机硒曲线,可知当装液量为40 mL时,其发酵液中总有机硒含量较高,达到 9 821.75 μg/L。因此,选择最适装液量为40 mL。

图5 摇瓶装液量对酵母富集有机硒的影响
2.6 正交试验结果分析
张帆等[18]研究表明,在单因素试验基础上,Na2SeO3质量浓度、初始pH和培养温度对产朊假丝酵母富硒工艺的影响较大,本试验选取这3个因素对提取工艺进行优化。由表2可见,在发酵液中总有机硒和菌体有机硒的影响因素方面,各因素所占比重有所不同,5号试验组的发酵液中总有机硒含量最高,达到9 792.732 μg/L,8号试验组的菌体有机硒含量最高,为2 643.071 μg/g。以发酵液中总有机硒含量为分析对象,各因素的比重大小依次为:硒质量浓度>接种量>装液量>初始pH。以发酵液中总有机硒含量来看,5号试验组最好,可以达到菌体有机硒含量和生物量之间的平衡,即:硒质量浓度15 μg/mL、接种量8%、初始pH 6.5、装液量为35 mL。此时发酵液中的总有机硒含量为9 792.732 μg/L,菌体有机硒含量为1 400.362 μg/g。

表2 正交试验结果分析表
以菌体有机硒为分析对象,各因素的比重大小依次为:硒质量浓度>初始pH>装液量>接种量,并且硒质量浓度是两个指标的最重要影响因素。这是因为硒质量浓度越大,对生物量产生的抑制作用越大,造成生物量减少,虽然单位菌体有机硒含量高,但生物量较少,导致发酵液中总有机硒含量也不是很高[19]。
2.7 分批培养结果分析
由图 6可知,产朊假丝酵母开始发酵在第 6小时进入对数期,葡萄糖消耗明显加快,直到发酵12 h时糖量基本耗尽,在18 h后生物量趋于稳定,并在24 h时达到最大,为13.07 g/L。因此,在分批补料培养时,在12 h左右开始补料为宜。

图6 分批培养生物量和残糖量
2.8 分批补料培养结果分析
补料分批培养比分批培养具有明显的优势[20],这种培养方式解除了底物抑制、产物反馈抑制和葡萄糖分解阻遏效应,从而提高了产率。由图 7可知,葡萄糖在11 h时基本耗尽,此时开始补料。在开始补料前6小时残糖量处于较低水平,但在后4小时残糖量上升较快,并在停止补料后残糖量缓慢下降。初步分析在补料前6小时酵母迅速繁殖,对发酵液中的溶解氧要求越来越多,而在补料后期发酵罐中溶解氧满足不了菌量的需求,补料时溶解氧降至0,酵母细胞在缺氧条件下,菌体进行无氧呼吸,葡萄糖利用率下降,不再进行繁殖,这可能也是在补料后期残糖量上升的原因之一,此时很难获得较高的生物量[21]。发酵罐供氧不足也是影响酵母高密度培养的一个重要因素。在后续试验中,可以利用纯氧来缓解供氧的不足。
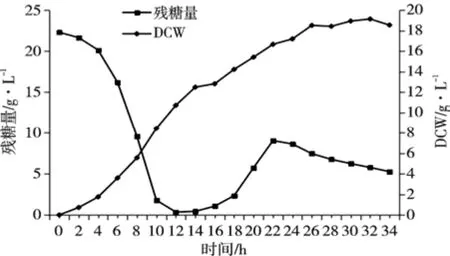
图7 分批补料培养生物量和残糖量
2.9 分批补料加硒试验结果分析
由表3可知,随着培养时间的延长,36 h和48 h时总有机硒含量和有机硒得率均比30 h和42 h高,在48 h时发酵液中总有机硒含量为10 089.00 μg/L。

表3 分批补料加硒试验结果分析表
3 结论
本文以产朊假丝酵母为研究对象,将无机硒转化为有机硒,研究硒质量浓度、硒添加方式、初始pH、摇瓶装液量对酵母富集硒的影响,以这些单因素的试验结果来分析设计L9(34)正交表以进一步优化培养条件,获得发酵液中总有机硒含量最高时的培养条件,即:硒质量浓度15 μg/mL、接种量8%、初始pH 6.5、装液量为35 mL,此时总有机硒含量为9 792.732 μg/L,相比于邹艳等[22]的总有机硒含量为8 790 μg/L有所提高。菌体有机硒最高时的条件为:硒质量浓度20 μg/mL、接种量8%、初始pH 5.5、装液量45 mL,菌体有机硒含量为2 750.41 μg/g,此时生物量为3.1 g/L。本研究在发酵罐分批培养过程中也获得比较满意的结果,但在获得高浓度菌体方面还有待于进一步研究优化。

