健脾益肾泄浊汤大鼠灌肠的含药血清对脂多糖诱导人结肠上皮细胞炎症损伤模型的影响*
何玉华 瞿波 陈文 何金室 朱家恒 李明权
(成都中医药大学附属医院,四川 成都 610072)
慢性肾脏病(Chronic Kidney Disease,CKD)是一种并发症多,破坏性强,不可逆转的疾病。近年来,诸多证据表明CKD患者的肠道微生物组与宿主的病理生理状态相关[1-2],有学者据此提出了“肠-肾轴(Gut-Kidney Axis)”理论[3]。该理论的核心观点认为肠道与CKD之间存在双向作用,一方面肾脏功能受损导致肠道菌群失调、肠道屏障功能破坏;另一方面肠道菌群及其代谢毒素通过受损的肠黏膜屏障入血,激活单核巨噬细胞系统,释放大量细胞因子、炎症因子、氧自由基等细胞毒性物质,诱发慢性炎症,从而加速肾脏损伤。由此可知,肠道屏障功能受损是“肠-肾轴”致病过程中的关键环节。我国自20世纪60年代开始就把结肠作为中药治疗CKD的靶点,利用大肠传导糟粕以降浊的功能特点,祛邪外达,调整阴阳,延缓疾病进展。本研究旨在通过观察大鼠灌肠含药血清对脂多糖诱导人结肠上皮细胞炎症模型的干预效果,探讨中药灌肠对肠道机械屏障的影响,为中药灌肠治疗CKD提供更多理论支撑。
1 材料与方法
1.1 材料、试剂 人正常结肠上皮细胞(NCM460,CL0172,丰晖生物),SPF级SD大鼠,体质量(200±26)g。96孔细胞培养板(07-6096,山东Biologix),6孔细胞培养板(07-6006,山东Biologix),离心管(LPLXG,15 mL,杭州LABSELECT),高糖培养基(DMEM,PM150210,武汉普诺赛),胎牛血清(FBS,10100,500 mL,北京Gibco),双抗(SV30010,100 mL,美国HyClone),胰酶(+EDTA,S310JV,100 mL,上海源培生物),CCK-8(BS350B,5*100T,安徽Biosharp),二甲基亚砜(DMSO,D5879,100 mL,美国Sigma-Aldrich),PBS缓冲液干粉(201201A17,1L,上海远慕生物),Rat IL-6 ELISA KIT(ZC-36404,48Test,上海茁彩生物),Rat TNF-α ELISA KIT(ZC-37624,48 Test,上海茁彩生物),Western、IP细胞裂解液(P0013,上海Beyotime),BCA蛋白浓度测定试剂盒(P0009,上海Beyotime),PAGE凝胶快速制备试剂盒(PG112,上海雅酶生物),预染蛋白Marker(180kDa,RM19001,武汉ABClonal),预染蛋白Marker(250kDa,26619,美国Thermo Fisher Scientific),ECL发光试剂盒(KF001,江苏Affinity Biosciences),Immobilon-PSQ PVDF膜(ISEQ00010,美国Sigma-Aldrich),Glycine (1275GR500,广州Biofroxx),Tris for molecular biology (1115GR500,广州Biofroxx),十二烷基磺酸钠(SDS,1177GR500,广州Biofroxx),过硫酸铵溶液(天津市致远化学试剂有限公司),盐酸异丙醇溶液(天津市致远化学试剂有限公司),ZO-1抗体(兔克隆抗体,AF5145,江苏Affinity Biosciences),Claudin1抗体(兔克隆抗体,AF0127,江苏Affinity Biosciences),Occludin抗体(兔克隆抗体,91131,美国Cell Signaling Technology),β-actin抗体(兔克隆抗体,AC026,武汉ABClonal),生物素化山羊抗兔IgG(H+L,ab6721,英国Abcam)。
1.2 实验设备 倒置生物显微镜(DMI1,德国LEICA),台式低速离心机(TDZ4-WS,长沙湘仪集团),高速低温离心机(H2050R,长沙湘仪集团),二氧化碳培养箱(MCO-15AC,日本SANYO),压力蒸汽灭菌器(SYQ-DSX-280B,上海宜川仪表厂),水浴锅(HH-1,金坛市荣华仪器制造有限公司),优谱超纯水制造系统(UPH-II-10T,成都超纯科技有限公司),酶标仪(SpectraMAX Plus 384,美国Molecular Devices),移液枪(2、10、20、200、1000 μL,北京大龙兴创实验仪器有限公司),枪头(20、200、1000 μL,美国Axygen),EP管(1.5 mL、0.2 mL、100 μL,美国Axygen),垂直电泳槽(JY-SCZ4+,北京君意东方电泳设备有限公司),电泳仪(JY200C,北京君意东方电泳设备有限公司),水平脱色摇床(TY-80A,江苏科析仪器有限公司),化学发光凝胶成像仪(5200,上海天能科技有限公司),全功能酶标仪(MK3,美国Thermo Fisher Scientific),超低温冰箱(DW-86L386,海尔集团)。
1.3 方法
1.3.1 中药灌肠液制备 课题组前期通过数据挖掘结果创立健脾益肾泄浊汤,含黄芪、大黄、煅牡蛎、蒲公英、丹参、附子。上述药物均采购于成都中医药大学附属医院中药房,中药灌肠液由成都中医药大学附属医院药剂部自动煎药机煎煮。
1.3.2 含药血清提取 40只SPF级SD大鼠,随机分为空白组、低剂量中药灌肠组、中剂量中药灌肠组、高剂量中药灌肠组,每组10只。根据公式测算[4]并结合前期预实验结果,空白组不予灌肠,低、中、高剂量组按1∶2∶4分别予0.4、0.8、1.6 mL中药灌肠。大鼠固定于鼠板,头朝斜下,尾朝斜上,露出肛门。药液与大鼠肛门温度相近(37.5~39℃)。将直头灌肠软管缓慢轻柔插入大鼠肛门,固定软管,缓慢注射药物,灌肠后予固定体位30 min。大鼠每天灌肠2次,连续灌肠5 d。于末次灌肠1 h后腹主动脉取血,3000 r/min离心15 min,分离血清,收集上层血清,微孔滤膜过滤后置-80℃保存备用。
1.3.3 细胞培养 细胞复苏:将NCM460细胞冻存管放入37℃水浴锅中,轻轻晃动管身,待冻存液融化后转入超净台,转移入15 mL离心管,按冻存液3倍体积加入新鲜培养基,250 g离心5 min,吸弃上清,加入新鲜培养基,放置孵箱培养。细胞传代:吸弃旧培养基,用PBS洗涤2次,吸弃液体,加入孵温的胰酶,轻晃培养瓶以使消化液完全浸润细胞。倒置显微镜下观察细胞,若胞质回缩,细胞之间不再连接成片,则加入胰酶体积3倍的新鲜培养基终止消化。将消化后的细胞转移入15 mL离心管,250 g离心5 min,吸弃上清,加入新鲜培养基,以1∶3传代培养。
1.3.4 细胞模型建立及分组 细胞分为空白组(Blank Group,BG)、模型组(Model Group,MG)、低剂量中药灌肠血清组(Low-dose Enema Group,LDEG)、中剂量中药灌肠血清组(Medium-dose Enema Group,MDEG)、高剂量中药灌肠血清组(High-dose Enema Group,HDEG)。除空白组外,其余各组均加入脂多糖(Lipopolysaccharide,LPS)100 μg/mL诱导细胞炎症损伤。中药灌肠血清组于加入LPS前2 h,将细胞培养液更换为10%含药血清,模型组加入空白组大鼠血清,各组均孵育24 h后检测相应指标。
1.3.5 CCK-8检测细胞活性、抑制率 取对数生长期的NCM460细胞,经PBS洗涤,胰蛋白酶消化后收集,250 g离心5 min,吸弃上清液,加入适量培养基使其成为单细胞悬液。调节细胞密度5×104/mL,100μL/孔接种于96孔板中(边缘孔用无菌PBS填充),37℃、5% CO2恒温培养。待细胞贴壁后,设置空白组(BG)、模型组(MG)、低剂量中药灌肠血清组(LDEG)、中剂量中药灌肠血清组(MDEG)、高剂量中药灌肠血清组(HDEG),每组重复4个样本。待药物作用24 h后,每孔加入10 μL CCK-8试剂, 37℃、5% CO2恒温继续培养2 h。使用酶标仪在450 nm波长处测定各孔的吸光度(OD值)。抑制率=(1-实验组OD/空白组OD)×100%。
1.3.6 ELISA检测细胞上清IL-6、TNF-α水平 将所有试剂平衡至室温。空白对照孔不加样品,只加显色剂A、B和终止液;标准品孔,加入配好的标准品50 μL,然后加入辣根过氧化物酶100 μL。待测样品孔,加入样本50 μL,然后辣根过氧化物酶100 μL,盖上封板膜,37℃温育60 min。每孔加满洗涤液,静置1 min后吸弃,如此重复5次,拍干。显色:每孔先加入底物液A 50 μL,再加入底物液B 50 μL,轻轻震荡混匀,37℃避光显色15 min。终止:每孔加终止液50 μL,终止反应。在15 min内,450 nm波长依序测量各孔的吸光度(OD值)。
1.3.7 Western Blot检测Claudin-1、Occludin、ZO-1蛋白水平 取NCM460细胞样本,加入RIPA裂解液(细胞:裂解液=1:10),裂解10min后收集裂解液,4℃、12000 rpm离心10 min。后取上清液,用BCA蛋白定量试剂盒测定蛋白浓度。各实验组取50 μL,按4∶1比例加入5×Loding buffer,混匀后热循环仪95℃,15 min,-80℃保存。待积层胶凝固后拔出,置入电泳槽中电泳。将PVDF膜与分离胶同时放入转膜液中平衡10 min。将凝胶面与负极相连,PVDF膜与正极相连,接通电源,200 mA转膜1~2 h。将PVDF膜放入一抗(一抗浓度 ZO-1 1∶1000;Cladudin-1 1∶1000;Occludin 1∶1000;β-actin 1∶100000),4℃孵育过夜。用TBST冲洗3次,后将PVDF膜放入二抗(稀释浓度:1∶5000),室温孵育2~3 h,再次用TBST冲洗洗3次。滴加ECL发光液显色曝光,用天能GIS机箱控制软件V2.0对条带进行曝光扫描,结果以目的蛋白相对表达量表示。目的蛋白相对表达量=目的蛋白积分光密度值(IOD)/内参积分光密度值(IOD)。

2 结果
2.1 各组细胞活性、抑制率比较 经LPS造模后,细胞活性降低;与空白血清干预相比,中药灌肠的含药血清可增强炎症损伤细胞的活性,但不同剂量之间的作用效果未见差异;LPS造模后,细胞抑制率增加;与空白血清干预相比,高剂量中药灌肠的含药血清可降低炎症损伤细胞的抑制率,低剂量与中剂量均未发现该效应。见表1。
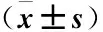
表1 不同分组细胞OD、抑制率Table 1 Determination of OD value of cells in different groups
2.2 各组细胞上清IL-6、TNF-α比较 经LPS造模后,细胞上清IL-6水平升高;与空白血清干预相比,中药灌肠的含药血清可降低炎症损伤细胞的上清IL-6水平,且高剂量的作用效果较低剂量与中剂量更为显著。经LPS造模后,细胞上清TNF-α水平升高;与空白血清干预相比,中药灌肠的含药血清可降低炎症损伤细胞的上清TNF-α水平,且高剂量的作用效果较低剂量更为显著。见表2。

表2 不同分组细胞IL-6、TNF-α比较Table 2 Determination of IL-6 in cells of different groups
2.3 各组细胞Claudin-1、Occludin、ZO-1相对表达量比较 经LPS造模后,细胞Claudin-1相对表达量下降;与空白血清干预相比,中药灌肠的含药血清可增加炎症损伤细胞的Claudin-1相对表达量,且作用强度与剂量成正比。与BG相比,MG的Occludin相对表达量降低;与MG相比,LDEG、MDEG、HDEG的Occludin相对表达量升遍;LDEG与HDEG间的Occludin相对表达量比较差异有统计意义;LDEG与MDEG、MDEG 与HDEG之间的Occludin相对表达量比较差异无统计意义。结果表明,经LPS造模后,细胞Occludin相对表达量下降;与空白血清干预相比,中药灌肠的含药血清可增加炎症损伤细胞的Occludin相对表达量,且高剂量的作用效果较低剂量更为显著。经LPS造模后,细胞ZO-1相对表达量下降;与空白血清干预相比,中药灌肠的含药血清可增加炎症损伤细胞的ZO-1相对表达量,且高剂量的作用效果较低剂量更为显著。见图1~3,表3。

图2 不同分组细胞Occludin表达电泳图Figure 2 Electrophoresis of Occludin expression in different groups of cells
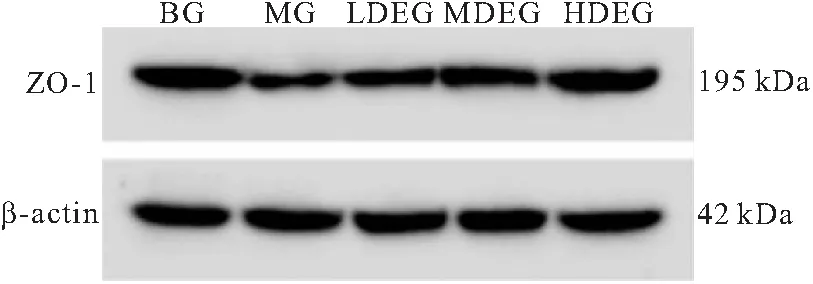
图3 不同分组细胞ZO-1表达电泳图Figure 3 Electrophoresis of ZO-1 expression in different groups of cells
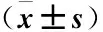
表3 不同分组细胞Claudin-1、Occludin、ZO-1相对表达量比较Table 3 Relative expression of Claudin-1 in cells of different groups
3 讨论
本实验基于“肠-肾轴”理论,以健脾益肾泄浊汤大鼠灌肠的含药血清为干预手段,观察人结肠上皮细胞肠道屏障相关蛋白及炎症指标的变化,探讨该方灌肠对肠道机械屏障以及局部炎症状态的影响。研究结果显示,健脾益肾泄浊汤方灌肠含药血清可增加炎症损伤后NCM460细胞的OD值,增加Claudin-1、Occludin及ZO-1相对表达量,降低IL-6、TNF-α水平,且高剂量的效果更为显著。
在肠道机械屏障功能正常的情况下,LPS无法进入血液循环,而CKD患者肠道黏膜通透性增高,LPS可借此移位进入血液循环,刺激炎症细胞因子释放,导致全身性炎症状态。多项研究证实了CKD患者/动物模型存在肠道机械屏障功能受损[5-7]。在体外试验中,LPS/内毒素亦可引起内皮细胞损伤[8]。因此本实验通过对NCM460细胞进行LPS造模,模拟CKD患者肠上皮细胞炎症状态。结果显示,经LPS处理后,细胞抑制率升高,细胞活性下降,提示细胞损伤。同时,LPS能诱导细胞产生炎性因子,导致细胞上清IL-6、TNF-α水平均不同程度升高,与CKD患者的微炎症状态类似。
虽然中药灌肠已广泛应用于CKD的治疗当中,但鲜有关于该法对肠道机械屏障功能影响的研究。肠道机械屏障,由肠上皮细胞和顶端连接复合体组成有滤过和屏蔽的双向作用[9]。其中,紧密连接是顶端连接复合体最主要的连接方式[10],主要由三个部分组成:粘附性跨膜蛋白,包括紧密连接蛋白(Claudin)和闭锁蛋白(Occludin)家族;闭锁小带蛋白(Zonula Occluden,ZO)家族;肌动蛋白和肌球蛋白连接环。多项试验表明,从紧密连接处去除Occludin,会降低紧密连接的稳定性,导致屏障功能受损[11-12]。Claudin多种异构体可以调节屏障功能[13]。本研究中,NCM460细胞经过LPS处理后,其紧密连接相关结构破坏,如Claudin-1、Occludin和ZO-1的表达量均下降,提示肠上皮细胞屏障功能受损。其他动物实验也发现,CKD大鼠空肠和回肠上皮紧密连接的关键蛋白成分(Claudin-1、Occludin)显著减少[14]。本实验采用的健脾益肾泄浊汤来自于前期数据挖掘结果,含黄芪(30g)、大黄(30g)、煅牡蛎(30g)、蒲公英(20g)、丹参(20g)、附子(10g)。实验结果显示,该方灌肠含药血清较空白血清能显著提高肠上皮细胞活性,减少IL-6、TNF-α含量,增加Claudin-1、Occludin和ZO-1的表达。表明健脾益肾泄浊汤大鼠灌肠的含药血清可以增强肠上皮细胞活性、增加肠上皮细胞间紧密连接相关蛋白的表达,可能有助于保护肠道机械屏障功能,从而减轻局部炎症状态。有研究者利用单药大黄灌肠,同样发现中药灌肠能改善大鼠肠道机械屏障功能,调节肠道菌群失调,抑制全身炎症反应,减轻肾纤维化[15]。钟丹等[16]利用中药复方(黄芪20 g、大黄30 g、牡蛎30 g、蒲公英30 g)对CKD大鼠模型灌肠,也发现通腑泄浊法能保护肠黏膜屏障功能。恢复肠道机械屏障功能可有效阻止肠腔内的诸多有害物质,如微生物、微生物代谢毒素、炎症因子等进入全身血液循环,理论上可减轻全身微炎症状态,减少肠源性毒素的蓄积,缓解尿毒症毒素引起的临床症状,延缓CKD持续进展。一项针对IgA肾病的临床研究表明,经过4年的随访,肠道通透性增高患者的肾小球滤过率,其下降程度明显大于肠道通透性正常的患者[17]。
当中药灌肠液进入肠腔后,主要通过被动扩散吸收入血,因此药液吸收量与药液的体积和浓度密切相关。本实验发现,与模型组相比,高剂量中药灌肠组在多项指标中均具有统计学差异,并且在IL-6、Claudin-1中显示了药液剂量-效应关系。由此推导,在中药灌肠的临床应用当中,可提高药液浓度,并在患者耐受程度内增加药液剂量,以求最大疗效。本研究采用了中药复发制剂,药物成分复杂,现有条件难以确定目标血药浓度,因此无法进行精确的血药浓度测算,仅以剂量的倍数1∶2∶4确定低、中、高剂量分组,所以并未在全部实验指标中观察到剂量-效应关系。另外,中药煎煮工艺的干扰因素多,不同批次药液的浓度参差不齐,难以保证药物等效性,也是造成这一实验现象的可能原因。
受限于时间及经费,本研究仅使用了Western blot检测肠道紧密连接关键蛋白的表达,未使用实时荧光定量PCR进一步验证。另外,本研究仅为细胞实验,虽然结果表明中药灌肠能够一定程度的修复肠道机械屏障功能,但具体机制尚未可知。肠道通透性与肠道屏障功能相反,由于肠道黏膜必须同时促进水分和营养物质的运输,同时起到保护屏障的作用,因此需要更多的研究去揭示这两种功能的转换机制。
目前,针对肠道上皮屏障损伤的最佳疗法是治疗基础疾病,而靶向修复上皮细胞具有治疗前景,包括肠道干细胞植入[18]以及增强上皮细胞扩增相关信号通路的表达[19],但上述方法可能导致上皮细胞恶性增殖[20]。本研究发现健脾益肾泄浊汤灌肠的含药血清能修复人结肠上皮细胞间的紧密连接,减轻局部炎症状态,对肠道机械屏障功能有一定的保护作用,理论上可延缓CKD进展。此外,阐明参与紧密连接调控的信号通路将有助于发现新的屏障修复剂,从而提供更加有效的CKD治疗方法。
4 结论
健脾益肾泄浊汤大鼠灌肠的含药血清可以增强肠上皮细胞活性,增加肠上皮细胞间紧密连接相关蛋白的表达,可能有助于保护肠道机械屏障功能,从而减轻局部炎症状态。

