鹅去氧胆酸对重症急性胰腺炎大鼠胰腺及肠道损伤的影响及意义*
张帆 汤礼军 黄竹 吴俊,3 黄尚卿
(1.西南医科大学临床医学院,四川 泸州 646000;2.西部战区总医院全军普通外科中心,四川 成都 610083;3.西南交通大学医学院,四川 成都 610031)
重症急性胰腺炎(Severe acute pancreatitis,SAP)是以胰腺的广泛炎症反应伴组织坏死为主要特征的病变,病情发展迅速,当疾病进展为多器官功能障碍综合征(Multiple organ dysfunction syndrome,MODS)时,死亡率较高[1]。肠道是重症急性胰腺炎胰腺外并发症最常见的器官之一,SAP所继发的肠道炎性介质的过度释放、缺血-再灌注及一氧化氮损伤、氧化应激反应和肠上皮细胞凋亡在肠道损伤中起到了重要作用,也与SAP的严重程度和愈后密切相关[2-5]。因此,减轻肠道损伤成为治疗SAP时胰腺外并发症中尤为重要的一步。 在胆道梗阻性胰腺炎中,血清总胆汁酸浓度会明显上升[6],排入肠道的胆汁酸量会明显减少,并且血清循环总胆汁酸的水平与急性胰腺炎患者的多器官功能衰竭密切相关[7-8]。而在非胆道梗阻性胰腺炎中,已经证实牛磺熊去氧胆酸(Tauroursodeoxycholic acid,TUDCA)能显著减轻急性胰腺炎中内质网的应激反应以及腺泡细胞的损伤[9-10],并且通过肠道细菌的代谢作用减轻胰腺炎的肠道损伤[11]。那么,与TUDCA同为治疗胆固醇性结石,且已经证实在多种疾病的肠道损伤具有保护作用的鹅去氧胆酸(Chenodeoxycholic acid,CDCA)是否也具有类似于TUDCA的胰腺炎中胰腺和肠道保护的功能,值得研究。基于此,本研究探讨补充外源性胆汁酸CDCA对急性重症胰腺炎大鼠胰腺及肠道损伤的影响和意义,以期为SAP早期胰外并发症的治疗提供新的方向。
1 材料与方法
1.1 实验动物 SPF级SD健康雄性大鼠(6~8周龄)45只购自成都达硕实验动物有限公司,体重200~300 g, 随机分为Sham组(n=15)、SAP组(n=15)、CDCA组(n=15)。实验前,先进行一周的适应性喂养,室温和湿度适宜,交替光照和黑暗各12 h。 本实验所有检测方法和动物实验程序均经过中国人民解放军西部战区总医院动物伦理委员会批准。
1.2 试剂和仪器 牛磺胆酸钠(中国索莱宝)用生理盐水配制成5%浓度,水合氯醛(成都艾泽威生物科技有限公司)用生理盐水配制成5%浓度,鹅去氧胆酸(浙江英沃迪生物科技有限公司)配制成含0.5%CDCA的特殊饲料,淀粉酶、脂肪酶、二胺氧化酶(Diamine Oxidase,DAO)、肠型脂肪酸结合蛋白(Intestinal Fatty Acid-Binding Protein,IFABP)、D-乳酸(D-lactic acid)、白细胞介素-1β(Interleukin-1β,IL-1β)、白细胞介素-6(Interleukin-6,IL-6)、白细胞介素-18(Interleukin-18,IL-18)和肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)检测的ELISA试剂盒均购自武汉华美生物工程有限公司,TGR5抗体购自爱必信生物科技有限公司,核苷酸结合寡聚化结构域样受体蛋白3(NOD-like receptor protein 3,NLRP3)购自Affinity公司。
1.3 模型制备 SAP组:SD大鼠术前禁食、自由饮水12 h,随后腹腔注射5%的水合氯醛0.7 mL/100 g进行麻醉。麻醉后,大鼠固定于操作台,作一长约5 cm的上腹部正中切口,上至剑突,随后铺无菌手术单并暴露腹腔,找到十二指肠降部,向左翻转,暴露肠系膜右侧面,定位胆胰管近十二指肠开口处,随后用小动脉夹夹闭肝门处的胆总管,使用4号针头逆行穿刺,成功后使用1 mL注射器缓慢推注5%牛磺胆酸钠1 min,推注用量为0.1 mL/100 g,推注完成后依次去掉小动脉夹和4号针头,停留观察5 min后关腹,然后置于室温23~25℃的复苏室待醒。CDCA组:先喂养含0.5% CDCA的饲料一周,随后造SAP模。Sham组:喂养方法同SAP组,麻醉开腹仅拨动十二指肠降部后关腹。造模成功后24 h取标本,小肠取回肠末端近盲肠处4~5 cm,血液通过腹主动脉采集。
1.4 小肠和胰腺组织病理学检测 经4%多聚甲醛溶液固定24 h,严格按照病理实验检测的程序进行修剪、梯度脱水、包埋、切片、HE染色、封片,最后镜检合格的样片。胰腺组织病理评分参照Kusske评分方法[12],小肠组织病理评分参照Chiu′s评分方法[13]。
1.5 酶联免疫吸附测定(Enzyme linked immunosorbent assay,ELISA)法检测血清淀粉酶、脂肪酶、炎性因子、肠道损伤相关指标 血清淀粉酶、脂肪酶、DAO、IFABP、D-Lac、IL-1β、IL-6 、IL-18、TNF-α水平均采用 ELISA 法测定。实验方法以订购的试剂盒说明书为标准,经过包被、封闭、洗涤、加样、温育、加酶结合物、加显色底物等标准步骤进行检测。
1.6 脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TdT-mediated dUTP Nick-End Labeling,TUNEL)法检测肠黏膜上皮细胞凋亡情况 小肠组织采用TUNEL 法检测肠上皮细胞的凋亡情况,经过脱蜡、水化、浸洗、固定、反应、DAB显色等标准实验步骤后,使用荧光显微镜观察,计算凋亡指数。
1.7 蛋白免疫印迹法(Western blot)检测小肠组织TGR5以及NLRP3的蛋白表达情况 小肠组织采用Western blot检测TGR5以及NLRP3的蛋白表达情况,按照小肠组织总蛋白提取、蛋白浓度测定、变性、SDS-PAGE电泳、转膜、封闭、免疫反应、化学发光、图像采集等步骤,最后计算TGR5以及NLRP3蛋白在各组小肠组织的相对表达量。

2 结果
2.1 CDCA对大鼠胰腺组织病理损伤观察结果比较 HE染色后在光镜下观察到Sham 组大鼠的胰腺组织大体结构正常,SAP组大鼠的胰腺组织可见小叶间明显水肿,腺泡间隔变大,腺泡细胞排列紊乱、萎缩,同时呈现溶解性坏死(黑色箭头),呈嗜酸性的无结构纤维状,并可见大量炎性细胞浸润(黄色箭头),间质可见明显出血(绿色箭头)。与 SAP 组比较,CDCA组胰腺组织病理损伤显著减轻,主要表现为胰腺组织镜下大体结构清晰,但仍可见小叶间水肿,少量的腺泡细胞坏死(黑色箭头)及少量的炎性细胞弥散性浸润(黄色箭头),见图1。

图1 CDCA对大鼠胰腺组织病理损伤观察结果以及病理评分比较Figure 1 Observation on histopathological damage of rat pancreas by CDCA and comparison of pathological scores注:A.Sham组、SAP组以及CDCA组大鼠胰腺组织HE染色(标尺=100 μm);B.各组大鼠胰腺组织病理评分。与Sham组相比,①P<0.05;与SAP组相比,②P<0.05
2.2 CDCA对大鼠胰腺炎的血清指标影响的比较 SAP组大鼠的胰腺炎血清指标淀粉酶、脂肪酶的水平较Sham组有明显升高(P<0.05),经CDCA干预后均有明显下降(P<0.05),见表1。

表1 各组大鼠胰腺炎相关指标血清淀粉酶、血清脂肪酶水平比较Table 1 Comparison of serum amylase and serum lipase levels in rats of each group
2.3 CDCA对大鼠血清全身炎症指标影响的比较 与Sham组相比,SAP组大鼠血清全身炎性因子IL-1β、IL-6、IL-18 以及TNF-α水平均有明显升高(P<0.05);而经过CDCA干预后,大鼠的全身炎症指标均有明显下降(P<0.05),见表2。

表2 各组大鼠血清IL-1β、IL-6、IL-18、TNF-α表达水平比较Table 2 Comparison of serum IL-1β, IL-6, IL-18 and TNF-α expression levels in rats of each group
2.4 CDCA对大鼠肠道组织病理损伤观察结果的比较 HE染色结果显示,Sham组大鼠小肠组织结构正常,SAP 组大鼠的小肠结构明显破坏,小肠绒毛形态明显异常,大量的肠绒毛上皮细胞脱落(绿色箭头),部分组织的肠绒毛相互融合、断裂、脱落(蓝色箭头),伴有大量炎性细胞浸润(黄色箭头),同时可见固有层裸露,毛细血管充血、扩张;而经过CDCA干预后大鼠的小肠病理损伤有明显缓解,但仍可见少量的上皮细胞脱落(绿色箭头)及炎性细胞浸润(黄色箭头),见图2。
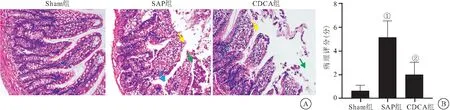
图2 CDCA对大鼠小肠组织病理损伤观察结果比较Figure 2 Comparison on the results of histopathological damage observed in the small intestine of rats by CDCA注:A.Sham组、SAP组以及CDCA组大鼠小肠组织HE染色(标尺=100 μm);B.各组大鼠小肠组织病理评分。与Sham组相比,①P<0.05;与SAP组相比,②P<0.05
2.5 CDCA对大鼠肠道组织的肠道损伤标志物影响的比较 与Sham组相比,SAP 组大鼠的肠道组织损伤的特异性标志物DAO、IFABP以及D-Lac水平较sham组有明显升高(P<0.05),经CDCA干预后均下降(P<0.05),见表3。
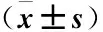
表3 各组大鼠肠道损伤标志物血清DAO水平、IFABP、D-Lac水平表达比较Table 3 Comparison on expression of serum DAO, IFABP and D-Lac levels in rats in each group
2.6 CDCA对小肠黏膜上皮细胞凋亡影响的观察结果及凋亡率的比较 TUNEL法检测小肠黏膜上皮细胞凋亡的结果显示,SAP组大鼠的小肠黏膜细胞凋亡指数及凋亡率较Sham组明显升高(P<0.05);经过CDCA干预后,小肠黏膜细胞凋亡指数及凋亡率较SAP组有明显下降(P<0.05),见图3。

图3 CDCA对小肠黏膜上皮细胞凋亡影响的观察结果及凋亡率的比较 Figure 3 Observations on the effect of CDCA to the apoptosis of small intestinal mucosal epithelial cells and comparison of the apoptosis rate注:A.TUNEL 法检测小肠黏膜上皮细胞的凋亡;B.各组大鼠小肠黏膜上皮细胞凋亡率的比较。与Sham组比较,①P<0.05;与SAP组比较,②P<0.05
2.7 CDCA对小肠组织TGR5以及NLRP3蛋白表达的影响 Western blot检测小肠组织的TGR5及NLRP3蛋白表达结果显示,SAP造模后大鼠的小肠组织中TGR5蛋白的表达较Sham组明显增多(P<0.05);同时,小肠组织的NLRP3在进行SAP造模后也明显增多,而在进行CDCA干预后表达明显下降(P<0.05),见图4。

图4 CDCA对小肠组织TGR5蛋白以及NLRP3表达影响的比较Figure 4 Comparison of the effects of CDCA on the expression of TGR5 protein and NLRP3 in small intestine tissues注:TGR5以及NLRP3蛋白表达;B.各组大鼠小肠组织TGR5及NLRP3蛋白相对表达量。与 Sham组比较,①P<0.05;与 SAP 组比较,②P<0.05
3 讨论
研究证实,肠道是人体内最大的免疫器官,SAP并发胰外损伤时首当其冲;在发生SAP时,肠黏膜屏障以及肠道免疫功能受损,导致肠内细菌穿过受损的黏膜进入肠外器官和血液循环,从而继发SIRS和MODS[14]。因此,阻止肠道这一“扳机点”部位的损伤,不仅可以减轻SAP的严重程度, 还能改善疾病的预后,降低死亡率,使此研究具有了现实的临床意义。
胆汁酸作为胆汁的主要成分,不仅可以促进脂肪和脂溶性维生素的吸收[15],还能与胆汁酸受体相互作用来调节自身代谢和肠道功能稳态[16]。在以往的研究中,主要聚焦于胆汁酸在肝胆疾病中的作用,直到最近几年才将其影响逐步扩展到肝胆以外:主要包括在肠道缺血再灌注损伤中的保护作用[17],对肠道干细胞的激活、促进肠上皮细胞再生的作用[18],对肠道免疫细胞群组成的调节[19]以及癌症预防和治疗的新方向等[20-21]。CDCA作为胆汁酸中的一种,口服后在肠道内变成石胆酸(Lithocholic acid,LCA), LCA又能在肠道内代谢为3-oxoLCA 和 isoalloLCA,随后被修饰成特定的免疫调节分子,进而在肠道发挥促炎或抗炎的免疫调节作用[22]。因此,本实验探究了CDCA在SAP大鼠的胰腺及肠道中是否也具有类似的效果。本研究结果表明,经过CDCA干预后再进行SAP造模的大鼠胰腺组织病理损伤较Sham组有明显的减轻,病理评分也显著下降;同时,血清淀粉酶、脂肪酶以及全身炎性因子(IL-1β、IL-6、IL-18、TNF-α)的表达水平也明显降低,使大鼠的全身炎症反应得到了有效的控制。研究显示[23],在进行急性胰腺炎造模后,胰腺中胆汁酸受体TGR5的表达水平会明显升高,作为保护性因素,被特异性激动剂激活后,通过抑制活性氧等途径来减轻胰腺损伤及全身炎症反应。 因此,探明CDCA在SAP肠道损伤中的作用,有助于为临床治疗SAP的胰腺外并发症提供新的思路。
肠道损伤的转归也是影响SAP进展和预后的重要因素,肠道的损伤不仅能刺激机体进一步产生炎性因子,肠黏膜屏障的破坏还能导致细菌入血造成全身感染而进一步加重SAP。因此,接下来我们研究了CDCA对肠道本身的影响。本研究发现,CDCA干预后可以显著减轻肠道损伤的严重程度,表现为小肠的病理评分以及肠道上皮细胞的凋亡率显著降低;同时,肠道损伤的特异性血清标志物DAO、IFABP和D-Lac的水平较SAP组也有明显下降。对于CDCA减轻肠道损伤的作用机制,在其他疾病模型中已有研究,主要是通过激活肠道胆汁酸受体——法尼酯X受体(farnesoid X receptor,FXR)来发挥作用。肌球蛋白轻链激酶(Myosin light-chain kinase,MLCK)是一种能够影响肠道连接蛋白表达,进而改变肠黏膜屏障通透性和完整性的蛋白激酶。Song等[24]研究发现 CDCA可以通过FXR-MLCK途径在脂多糖诱导的大鼠肠上皮损伤中发挥保护作用;同时,在肠道的缺血再灌注损伤中,CDCA也能通过促进肠道连接蛋白的表达,维持肠黏膜屏障的完整,以发挥保护肠道的作用[17]。但是,同为胆汁酸受体的TGR5在肠道中的影响目前报道鲜少,前文已述,TGR5受体的激活对于胰腺具有一定保护作用,对于全身炎症反应也有一定的抑制作用[25];而在肠道组织中也广泛表达的TGR5受体是否在CDCA的激活下发挥其作用,值得探究。因此本研究中我们推测胆汁酸CDCA减轻SAP大鼠胰腺和肠道损伤的作用机制,可能与激活肠道特异性的胆汁酸受体TGR5有关。
TGR5受体作为G蛋白偶联受体家族(G protein-coupled receptors,GPCRs)中的一种,在人类的多种组织器官如胰腺、肠道中广泛表达[26]。本研究用Western blot试验证实了小肠组织的TGR5受体在进行SAP造模后表达会明显升高;而CDCA作为TGR5受体的强激动剂,在激活TGR5受体后可以通过TGR5-cAMP-PKA轴来抑制NLRP3的表达[27]。NLRP3是多种蛋白质组成的复合物,其表达增高提示炎性小体的激活增多,能够调节胱冬肽酶-1的活化,促使前体IL-1β和前体IL-18的成熟及分泌。IL-1β是早期炎症扩散和无菌性炎症的重要细胞因子,而IL-18也在机体内发挥促炎效果,两者的分泌增多会导致炎细胞浸润,进一步加重组织的损伤[28];另外,NLRP3还介导了急性胰腺炎中胰腺的炎症和损害[29]。在本文中,由于SAP造模后血清炎症因子IL- 1β和IL-18分泌增多,因此我们将目光聚焦于NLRP3炎性小体上,通过Western blot实验表明NLRP3在SAP大鼠的小肠组织中表达升高,而在CDCA干预后的小肠组织中NLRP3的表达降低。以上结果提示了胆汁酸受体TGR5和NLRP3炎性小体参与了SAP大鼠中胰腺及肠道损伤的过程。推测SAP造模后,TGR5受体作为保护性因素在肠道组织中的表达升高,经过CDCA干预后TGR5受体激活,通过抑制肠道NLRP3的表达,从而抑制了全身的炎症反应,减轻了胰腺及肠道的损伤。
4 结论
胆汁酸CDCA可能通过激活SAP大鼠肠道组织的TGR5蛋白,从而抑制NLRP3的表达及炎性小体的激活,减轻大鼠全身的炎性反应,缓解胰腺和小肠损伤的严重程度,在SAP中发挥了一定的保护作用。本研究为SAP早期胰外并发症的治疗提供了新的方向,但具体的作用机制还需要更深一步的研究证实。

