基于分子对接及酶抑制动力学探究红景天提取物体外α-葡萄糖苷酶抑制活性
王丽萍,高彩雯,冯海月,曾嵩玉,陈士恩
1西北民族大学生命科学与工程学院;2西北民族大学生物研究中心 中国-马来西亚国家联合实验室,兰州 730124
糖尿病是一种常见疾病,分为1型糖尿病(diabetes mellitus type 1,T1DM)和2型糖尿病(diabetes mellitus type 2,T2DM)2种类型,T2DM占糖尿病患者90%以上,主要由胰岛素抵抗、胰岛素分泌异常而导致的餐后血糖升高引起[1]。α-葡萄糖苷酶是引起餐后血糖升高的主要酶之一,抑制α-葡萄糖苷酶活性已成为控制餐后血糖、治疗T2DM的主要途径[2]。目前临床所用α-葡萄糖苷酶抑制剂多为阿卡波糖、米格列醇等,虽抑制活性较高,但价格昂贵且易引发消化不良等一系列胃肠道反应[3]。植物来源的天然产物因其毒性和副作用小成为治疗剂的优质来源,因此,从天然活性物质中寻找安全、不良反应小的α-葡萄糖苷酶抑制剂成为研究热点。
红景天作为传统药食同源性中药材之一,含红景天苷、儿茶素、酪醇等多种活性成分[4],目前国内外研究主要集中于抗缺氧[5]、抗凋亡[6]、抗肿瘤[7]、缓解应激损伤[8]等方面,也有研究表明,其在糖尿病啮齿动物模型中具有一定作用[9,10],可通过激活5'-单磷酸腺苷依赖的蛋白激酶(AMPK)相关信号通路缓解糖尿病小鼠的高血糖、高血脂、尿糖症状[11]。近日研究人员发现红景天提取物可显著降低小鼠的餐后血糖水平[12],其活性成分在体外表现出一定程度的抑制作用,但具体抑制方式并不明确。我们团队前期研究发现红景天中多酚类物质具有一定体外α-葡萄糖苷酶抑制活性[13]。基于上述研究背景,本研究结合酶抑制动力学、UHPLC-QE-MS、分子对接技术,以可视化的方式探索红景天提取物对α-葡萄糖苷酶的抑制作用。研究旨为降血糖药物、保健食品的开发提供理论参考,以期促进红景天的进一步开发利用。
1 材料与方法
1.1 材料与仪器
大花红景天Rhodiolacrenulata(HK.f.et Thoms.) H.Ohba采自西藏昌都,经西北民族大学生命科学与工程学院陈士恩教授鉴定为真;无水碳酸钠、磷酸二氢钠、磷酸氢二钠、氢氧化钠、甲醇(分析纯,天津市大茂化学试剂厂);4-硝基苯-α-D-吡喃葡萄糖苷(4′-nitrophenyl-α-D-galactopyranoside,PNPG)(质量分数≥98.0%,美国Sigma公司);α-葡萄糖苷酶(G5003-100UN,美国Sigma公司);阿卡波糖(质量分数≥98.0%,美国Sigma公司);磷酸盐缓冲液(phosphate buffered solution,PBS)(北京索莱宝科技有限公司);甲醇、乙腈(LC-MS级,CNW Technologies);乙酸铵(LC-MS级,SIGMA-ALDRICH);乙酸(fisher chemical),水为超纯水。
L8型紫外可见分光光度计(上海仪电分析仪器有限公司);1510型酶标仪(美国赛默飞世尔科技公司);DL1500型超声波提取仪(中科都菱公司);LGJ-20F型冷冻干燥机(日本松源华兴科技有限公司);X1R高速冷冻离心机(美国赛默飞世尔科技公司);Vanquish超高效液相色谱(美国赛默飞世尔科技公司);Waters ACQUITY UPLC HSS T3(2.1 mm × 100 mm,1.8 μm)液相色谱柱(美国赛默飞世尔科技公司);Q Exactive HFX高分辨质谱(美国赛默飞世尔科技公司)。
1.2 实验方法
1.2.1 红景天提取物的制备
将红景天根、茎洗净后于烘箱中100 ℃烘干、粉碎、过50目筛,得红景天粉末,放入干燥器皿中备用。精密称取红景天粉末于三角瓶中,加入50%乙醇,进行超声提取,结束后将固体与液体10 000 r/min离心5 min,取上清液即可,将所得提取液旋转蒸发浓缩体积至1/3,真空冷冻干燥后得红景天提取物(R.crenulataextract,RCE)。
1.2.2 RCE体外α-葡萄糖苷酶活性抑制测定
用超纯水将RCE溶解且稀释至不同浓度后,进行体外α-葡萄糖苷酶抑制实验[14]。取10 μL适量质量浓度的RCE溶液与45 μL 5U/mLα-葡萄糖苷酶磷酸盐溶液(0.2 mol/L,pH=5.0)振荡混匀后于54 ℃培养箱孵育10 min。加入45 μL 2.5 mol/L PNPG溶液开始启动反应,振荡混匀,54 ℃孵育 30 min后,加入100 μL 0.2 mol/L Na2CO3溶液终止反应,振荡混匀后,于波长405 nm测定吸光度。
以PBS替代α-葡萄糖苷酶溶液测定样品空白;以PBS替代供测样品测定酶液空白。按照以下公式计算抑制率,并用SPSS件求出相应的半抑制浓度。

式中:Ac为未添加样品反应液的吸光值;A0为酶液空白吸光值;AS为添加样品反应液的吸光值;Ab为样品空白吸光值。
1.2.3 酶抑制动力学测定
以酶浓度为横坐标,酶促反应初速率V(ΔOD/min)为纵坐标作图,以判断其是否为可逆抑制;以底物浓度的倒数(1/[S])为横坐标,反应初速率的倒数(1/V)为纵坐标,得Lineweaver-Burk双倒数曲线,判断其抑制类型,并计算米氏常数(Km)及最大反应速率(Vmax)。
1.2.4 RCE的UHPLC-QE-MS检测
精密称取25 mg RCE,加入500 μL提取液(甲醇∶水=3∶1(V/V),含同位素标记内标混合物);35 Hz研磨处理4 min,超声5 min(冰水浴),重复3次;-40 ℃静置1 h;将样品4 ℃,12 000 r/min,离心15 min;取上清于进样瓶中上机检测。
色谱条件:Vanquish超高效液相色谱仪,通过Waters ACQUITY UPLC HSS T3液相色谱柱对目标化合物进行色谱分离。流动相为:含5 mmol/L乙酸铵的5 mmol/L乙酸水溶液(A相)和乙腈(B相),样品室温度:4 ℃,柱温箱温度40 ℃,流速0.35 mL/min,进样体积:2 μL,洗脱程序:0~1 min,30% B;1 min~12 min,30%→100% B;12~15 min,100% B。
质谱条件:Thermo Q Exactive HFX质谱仪进行一级、二级质谱数据采集,离子源为电喷雾离子源(ESI),在正离子与负离子下进行质谱分析。详细参数如下:鞘气流速:30 Arb,辅助气体流速:10 Arb,毛细管温度:350 ℃,Full MS分辨率:120 000,MS/MS分辨率:7 500,碰撞能量:10/30/60,喷雾电压:4.0 kV(+)或-3.8 kV(-),扫描范围:m/z50~1 500 Da。
原始数据经ProteoWizard软件转成mzXML格式后,使用自主编写的R程序包(内核为XCMS)进行峰识别、峰提取、峰对齐和积分等处理,然后与BiotreeDB(V2.1)二级质谱数据库匹配进行物质注释,算法打分的Cutoff值设为0.3。
1.2.5 RCE活性成分与α-葡萄糖苷酶的分子对接
从蛋白质数据库(http://www.rcsb.org)下载α-Glucosidase(PDB ID:3WY1)的结晶复合物,使用PyMOL软件对去除其水分子及原配体,保存为PDB格式,再使用AutodockTools1.5.6进行加氢、计算电荷等,保存为PDBQT格式备用。从ZINC(http://zinc.docking.org/)小分子数据库中下载RCE 20种化合物的结构(mol2格式),并使用AutodockTools1.5.6进行处理,保存为PDBQT格式备用。采用Autodock预测化合物与α-葡萄糖苷酶的结合,采用软件默认参数进行对接,并计算活性成分与靶点蛋白的最低结合能,最后使用PyMOL将分子对接结果进行可视化。
1.2.6 统计分析

2 结果与分析
2.1 RCE对α-葡萄糖苷酶的抑制活性
RCE对α-葡萄糖苷酶的抑制活性如图1所示,结果表明,RCE对α-葡萄糖苷酶具有一定抑制能力,且抑制率随浓度增加而逐渐增加,并呈量效关系。其半数抑制浓度IC50为1.538 mg/mL,低于阳性对照阿卡波糖(IC50为3.36 mg/mL)。当RCE浓度为50 mg/mL时,抑制率可达95%,具有良好的抑制效果。

图1 RCE对α-葡萄糖苷酶的抑制活性Fig.1 Inhibitory activity of RCE on α-glucosidase
2.2 RCE对α-葡萄糖苷酶的抑制机制
不同RCE浓度下,以酶浓度([E])对反应初速率([V])作图,所得结果(见图2)为一组经过原点的直线,且所有直线存在较好的线性关系。添加RCE的直线斜率均小于未添加RCE直线斜率,随着提RCE浓度增加,直线斜率逐渐减小,表明RCE添加并没有改变酶数量,而是通过降低酶活性使得分解底物能力降低,因此RCE对α-葡萄糖苷酶的抑制作用是可逆的,本实验结果与Lin[15]研究结果较为一致。RCE对α-葡萄糖苷酶抑制作用的Lineweaver-Burk双倒数图如图3所示,抑制动力学参数如表1所示,LB直线交于第二象限,随着RCE浓度增加,酶促反应最大反应速率Vmax减小,米氏常数Km增大,因此RCE对α-葡萄糖苷酶的抑制类型为竞争性与非竞争性的混合型抑制类型。

表1 RCE 对α-葡萄糖苷酶的抑制动力学参数Table 1 Inhibitory kinetic parameters of RCE on α-glucosidase
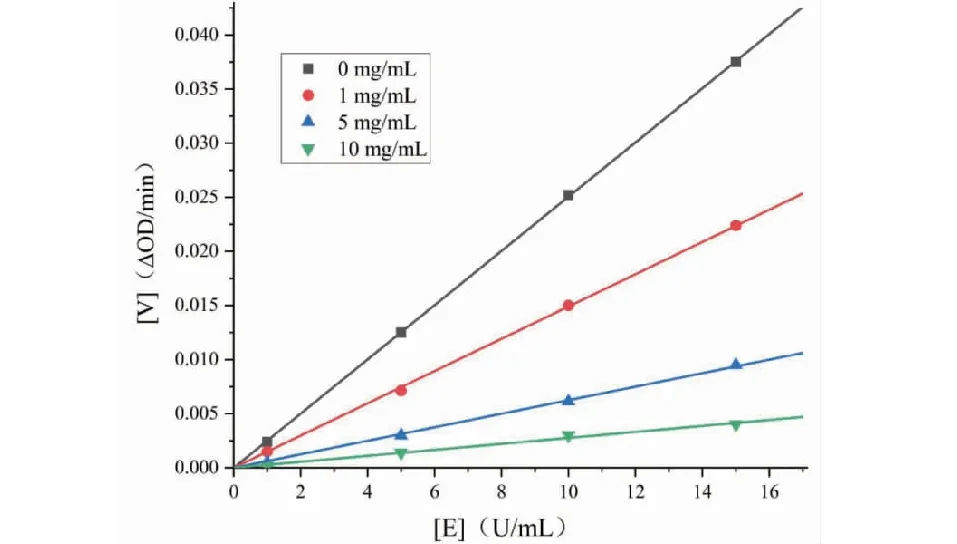
图2 酶浓度与反应初速率图Fig.2 Graph of enzyme concentrationand initial reaction rate

图3 RCE对α-葡萄糖苷酶抑制作用的Lineweaver-Burk双倒数图Fig.3 Lineweaver-Burk double-reciprocal plot of RCE inhibiting α-glucosidase
2.3 RCE的UHPLC-QE-MS分析
采用UHPLC-QE-MS对RCE进行成分分析,总离子流图(TIC)如图4所示,图中A为正离子模式,图B为负离子模式。对TIC进行提取后根据化合物保留时间和碎片离子峰等信息,结合BiotreeDB(V2.1)、HMDB数据库及文献报道对RCE化学成分进行鉴定,共检测出1 245种化合物,负离子模式下263种,正离子模式下982种。其中氨基酸类66种,醇类8种,脂肪酸类107种,黄酮类及异黄酮类78种,生物碱类42种,酚类34种,萜类及其衍生物85种,核苷酸及其衍生物10种,甾体类36种,糖类及其衍生物44种,木脂素类40种,芳香类66种,苯丙素类22种,有机酸类23种,香豆素类31种,脂肪酰类47种及其他类。以色谱峰的面积代表该物质的相对含量,筛选出相对含量较高的20种物质,如表2所示:其中黄酮类有7种,脂肪酸类有3种,糖类2种,有机酸类2种等。

表2 RCE中相对含量较高的20种化合物Table 2 Twenty compounds with high relative content in RCE

续表2(Continued Tab.2)

图4 RCE的UHPLC-QE-MS总离子流图Fig.4 Total ion chromatograms of RCE by UHPLC-QE-MS
2.4 RCE活性成份与α-葡萄糖苷酶的分子对接
近年来,分子对接方法已成为计算机辅助药物研究领域的一项重要技术,也广泛应用于天然化合物虚拟筛选。分子对接技术是研究分子间(如配体和受体)相互作用,并预测其结合模式和亲合力的一种理论模拟方法,涉及分子间的空间匹配与能量匹配。采用Auto Dock将红景天提取物中含量较高的20种活性成分与α-葡萄糖苷酶进行分子对接,并预测其结合能(binding energy)。结合能越低,对接物构象越稳定,活性成分与蛋白结合越牢固,亲和力越好;结合能低于0 kJ/mol表明分子间具有结合活性;结合能低于-20.93 kJ/mol时,表明分子间具有较强结合能力[16]。结果表明,RCE的20种化合物有11种可与α-葡萄糖苷酶的氨基酸残基通过氢键进行结合(表3)。其中咖啡酸形成的氢键最多,为5个,可与His-515、Arg-437、Glu-432及His-348 4个氨基酸残基相连;(+)-表儿茶素结合能最低(-17.08 kJ/mol),与Asn-443、His-515残基形成的键长分别为2.2、2.4,其结合性最好;咖啡酸、L-苹果酸、槲皮素和酪醇具有相同结合位点Arg-437;(-)-epicatechin 3-O-gallate、咖啡酸和(+)-表儿茶素具有相同结合位点His-515,山奈酚和红景天苷具有相同结合位点Asn-46。分子对接结果从理论上验证了红景天提取物中化合物与α-葡萄糖苷酶具有一定的结合活性,并明确了可能进行结合的具体化合物(见图5)。

表3 化合物与α-葡萄糖苷酶的分子对接结果Table 3 Molecular docking results of compounds and α-glucosidase
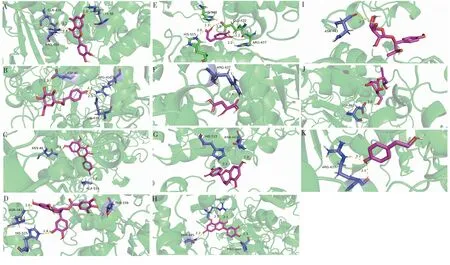
图5 化合物与α-葡萄糖苷酶的分子对接可视化结果Fig.5 Visualization results of molecular docking between compounds and α-glucosidase注:图中黄色虚线代表氢键,绿色表示α-葡萄糖苷酶蛋白结构,蓝色表示化合物结构。A:木犀草素;B:红景天苷;C:山奈酚;D:(-)-Epicatechin 3-O-gallate ;E:咖啡酸;F:L-苹果酸;G:(+)-表儿茶素;H:槲皮素;I:(-)-Erythro-anethole glycol 1-glucoside;J:3-Hydroxy-4,6-heptadiyne-1-yl 1-glucoside;K:酪醇。Note:The yellow dotted line in the figure represents hydrogen bonds,green represents the protein structure of α-glucosidase,and blue represents the compound structure.A:Luteolin;B:Salidroside;C:Kaempferol;D:(-)-Epicatechin 3-O-gallate;E:Caffeic acid;F:L-Malic acid;G:(+)-Epicatechin;H:Quercetin;I:(-)-Erythro-anethole glycol 1-glucoside;J:3-Hydroxy-4,6-heptadiyne-1-yl 1-glucoside;K:Tyrosol.
3 讨论与结论
α-葡萄糖苷酶存在于机体小肠黏膜刷状缘,可将寡糖或二糖分解为单糖,抑制其活性可减缓碳水化合物水解和葡萄糖生成速率,从而降低小肠对葡萄糖的吸收及餐后血糖。研究表明星苹果、象腿蕉、黑枸杞、五味子、紫山药、黔产蒲公英[17]等多种植物提取物均对α-葡萄糖苷酶具有抑制活性。半数抑制浓度(IC50)可以评判抑制剂对酶的抑制效果,IC50越小,抑制活性越高,团队前期研究表明,红景天多酚对α-葡萄糖苷酶具有较好的抑制效果[13],IC502.83 mg/mL,本实验所得RCE IC50为1.538 mg/mL,不仅低于阿卡波糖,而且低于红景天多酚,这可能是由于RCE中还含有黄酮类、有机酸类等物质。抑制剂对酶的抑制类型可分为可逆抑制与不可逆抑制,本研究所得RCE与α-葡萄糖苷酶为可逆抑制,这种抑制类型特点是抑制物与酶的结合方式为非共价键结合,通过物理方法可使酶恢复活性,可逆抑制类型又可分为4类,分别为竞争性抑制、非竞争性抑制、反竞争性抑制、混合型抑制,混合型抑制类型有竞争性与非竞争性混合型,该类型特点为抑制物浓度的增加会使酶促反应最大反应速率(Vmax)减小,米氏常数(Km)增大,本研究显示RCE浓度增大后Vmax减小、Km增大,符合上述特点,因此确定RCE对α-葡萄糖苷酶的抑制类型为竞争性与非竞争性的混合型抑制,表明红景天提取物是一种有效的天然α-葡萄糖苷酶抑制剂。RCE与红景天多酚、五味子多糖和网地藻多糖[18]对α-葡萄糖苷酶抑制类型一致,但需明确哪种化合物属于竞争性抑制,哪种化合物属于非竞争性抑制还需进一步探究。RCE具有较好的α-葡萄糖苷酶抑制活性,但在体内是否效果显著还需进一步动物模型进行验证。目前α-葡萄糖苷酶的来源较多,主要有酿酒酵母、黑曲霉、嗜热脂肪芽孢杆菌、肠膜明串珠菌等。不同来源α-葡萄糖苷酶的性质相差较大,本研究所用α-葡萄糖苷酶为酿酒酵母来源,因此RCE是否对其他来源酶具有相同的抑制效果还需进一步探究。
UHPLC-QE-MS具有快速、准确等特点,可非靶标分析复杂中药材中的化合物,本研究对RCE进行分析,通过与数据库进行对比鉴定出1 245种化合物,负离子模式下263种,正离子模式下982种。红景天活性成分提取溶剂主要为乙醇和水,与纯水相比有机溶剂的水溶液可提取出更多化合物,水提物中没食子酸含量高于醇提物,酪醇、绿原酸和单宁含量低于水醇提取物[19],因此本实验为提取出更多种化合物,以50%乙醇作为溶剂进行RCE提取制备。但由于提取溶剂的单一,检测出的化合物并不一定是红景天全部化合物,还存在部分化合物不能被提取或鉴定,因此还需进一步增加不同提取溶剂的对比实验。Zakharenko[20]研究表明,红景天中主要活性成分为红景天苷、木犀草素、儿茶素、槲皮素、草本素、没食儿茶素等,这与本研究结果较为一致,RCE中具有较高含量的木犀草素、槲皮素。分子对接可预测小分子配体与受体蛋白之间是否可发生结合及结合的作用力,本研究将UHPLC-QE-MS所得20种含量较高的化合物与α-葡萄糖苷酶进行分子对接,结果表明11种化合物可与α-葡萄糖苷酶结合,分别为木犀草素、红景天苷、山奈酚、(-)-epicatechin 3-O-gallate、咖啡酸、L-苹果酸、(+)-表儿茶素、槲皮素、(-)-erythro-anethole glycol 1-glucoside、3-hydroxy-4,6-heptadiyne-1-yl 1-glucoside、酪醇,其中咖啡酸形成氢键最多,可与His-515、Arg-437、Glu-432、His-348残基结合。(+)-表儿茶素与Asn-443和His-515具有最佳的结合活性,结合能最低(-17.08 kJ/mol);将PNPG与α-葡萄糖苷酶进行对接,发现Arg-437和Glu-432为其2个结合位点,咖啡酸与PNPG拥有相同的结合位点Arg-437和Glu-432,L-苹果酸、槲皮素和酪醇与PNPG具有相同的结合位点Arg-437,因此推断咖啡酸、L-苹果酸、槲皮素和酪醇对α-葡萄糖苷酶的抑制类型可能为竞争性抑制,其他6种化合物为非竞争性抑制,但如需验证还需进一步将化合物纯化后做Lineweaver-Burk双倒数图,分别确定其抑制类型。
综上所述,本研究通过酶抑制动力学、UHPLC-QE-MS、分子对接技术,以可视化的方式探索了RCE对α-葡萄糖苷酶的抑制作用,抑制类型为竞争性与非竞争性的混合型抑制, RCE中(+)-表儿茶素与α-葡萄糖苷酶结合活性最佳。本文为RCE开发成为天然α-葡萄糖苷酶抑制剂及红景天资源的开发利用提供了基础研究。

