2021年国际癌症报告联盟甲状腺癌规范化报告数据集解读
刘志艳,王馨培
肿瘤的传统治疗方法包括手术、放疗和化疗。新兴的个体化诊疗是通过对肿瘤患者携带的个体信息进行检测,制定针对肿瘤患者的预防和治疗策略,使肿瘤患者获得最佳的治疗效果。肿瘤的个体化诊疗模式已成为恶性肿瘤等重大疾病临床治疗的发展方向。甲状腺癌的治疗在近20年取得了重大进展。随着时代的发展,传统的甲状腺癌治疗方法,如甲状腺全切除或次全切除术以及术后放射性碘(radioactive iodine,RAI)治疗等,已越来越难以满足患者的治疗需求[1-2]。以临床和细胞病理学及组织病理学参数为依据对甲状腺癌患者进行预后分层的个体化诊疗模式,更有助于为患者选择个体化的治疗方案。降低患者的复发和死亡风险[3-5]。
国际癌症报告联盟(International Collaboration on Cancer Reporting,ICCR)是一家成立于2010年的非营利性组织,致力于推进基于循证研究的国际公认标准化病理报告[3,6-7]。ICCR甲状腺规范化报告旨在收录病理报告的所有元素,界定甲状腺报告的核心元素和非核心元素,辅助临床医师进行危险分层,以采用最佳的个体化治疗[3,6-7]。甲状腺癌手术标本风险分层的关键元素包括:是否存在血管侵犯(blood vessel invasion,BVI)、甲状腺外侵犯(extrathyroidal extension,ETE)和区域性淋巴结转移及其程度。
1 ICCR甲状腺规范化报告的适用范围
ICCR甲状腺规范化报告适用于原发性甲状腺癌的切除标本,不适用于具有乳头状核特征的非浸润性甲状腺滤泡性肿瘤(noninvasive follicular thyroid neoplasm with papillary-like nuclear features,NIFTP)、恶性潜能未定的肿瘤、卵巢甲状腺癌、甲状舌管囊肿、肉瘤、淋巴瘤和甲状腺转移癌。
2 ICCR甲状腺规范化报告的核心元素与非核心元素
ICCR甲状腺规范化报告包括19个核心元素和8个非核心元素(表1)。核心元素的定义是对肿瘤的临床治疗、分期或预后至关重要的元素,不仅需要Ⅲ-2级或更高的证据支持,还需要被认为对所描述的疾病至关重要,并且在病理报告中必不可少。非核心元素可能不适用于规范化报告的所有使用者,并且(或)可能无法满足上述标准。

表1 国际癌症报告联盟(International Collaboration on Cancer Reporting,ICCR)甲状腺规范化报告的核心元素与非核心元素
2.1 手术方式、手术结果和送检标本
外科医师在手术报告单中记录所行术式、术中是否可见ETE以及肿瘤是否完整切除[6,8]。病理科医师应在病理报告中指出是否缺少术中ETE或者肿瘤切缘有否肿瘤的数据。
2.2 肿瘤部位、病灶和肿瘤大小
肿瘤是单灶还是多灶是核心问题,如为多灶时,应注明数量。如果有5个以上的肿瘤灶,则仅需简单说明而无需统计肿瘤的确切数目。整个规范化报告只应用于优势肿瘤。优势肿瘤是临床相关性最大的肿瘤,即侵袭性强和(或)T分期较高的肿瘤。优势肿瘤多是(但不总是)其中最大的肿瘤。例如,一个较小的侵犯邻近肌肉组织的甲状腺乳头状癌(papillary thyroid carcinoma,PTC)与一个孤立的较大的无预后不良组织学特征的PTC相比,应将具有ETE的肿瘤定义为优势肿瘤。如果在同一标本中出现不同种类的肿瘤,规范化报告应完整收录所有种类的肿瘤。例如,腺叶切除术后标本中同时包含髓样癌和PTC,则应为每一类肿瘤建立一个规范化报告;但是,如果2个孤立的PTC分属不同的亚型,则仅注释优势肿瘤。对无关治疗方案的非优势肿瘤,病理科医师可自行决定是否报告其基本的病理学特征。
需要基于影像学,宏观和微观地综合分析优势肿瘤的大小。肿瘤的最大尺寸是核心元素,可以影响预后,并且是TNM分期的组成部分[9]。
2.3 组织学类型
参考2017年世界卫生组织(World Health Organization,WHO)甲状腺肿瘤分类标准。
2.3.1 PTC
PTC最常见,并且存在许多亚型,目前只报告部分具有临床意义的亚型。
2.3.1.1 经典型、高细胞型和微小乳头状癌
经典型是PTC的普通亚型。高细胞型比经典型PTC更具侵略性,具有较高的BRAF突变率,并且RAI治疗的疗效较差(图1A)。微小乳头状癌的体积小(直径≤1 cm),并且为惰性,常于偶然中发现,预后极好。有研究表明93%的微小乳头状癌患者无病生存,亦无远处转移。
2.3.1.2 滤泡型及其相关病变
滤泡型PTC(follicular variant PTC,FVPTC)可以细分为2个亚型:完全包裹或边界清楚的包裹型,以及完全或部分缺乏包膜的浸润型[10]。FVPTC与经典型PTC的生物学行为相似。包裹型FVPTC的生物学行为更为惰性[11]。非浸润性包裹型FVPTC现被重新命名为NIFTP[12],2017年WHO将其归类为甲状腺交界性肿瘤,具有极低度恶性潜能,临床处理以单纯手术切除为主[13-15]。然而,由于NIFTP细胞核特征判读一致性存在差异[16-18],因此2018年NIKIFOROV等[19]进一步指出,诊断NIFTP需除外BRAFV600E突变或其他高风险突变(TERT启动子、TP53)[19]。NIFTP诊断在亚洲的影响可能不大,因为亚洲的NIFTP仅占所有PTC的1.6%,而其他地区可达13.3%。中国大陆2家医院的研究结果显示,NIFTP的比例仅为0.3%,因此这一概念对中国FVPTC诊断的总体影响不大[20]。
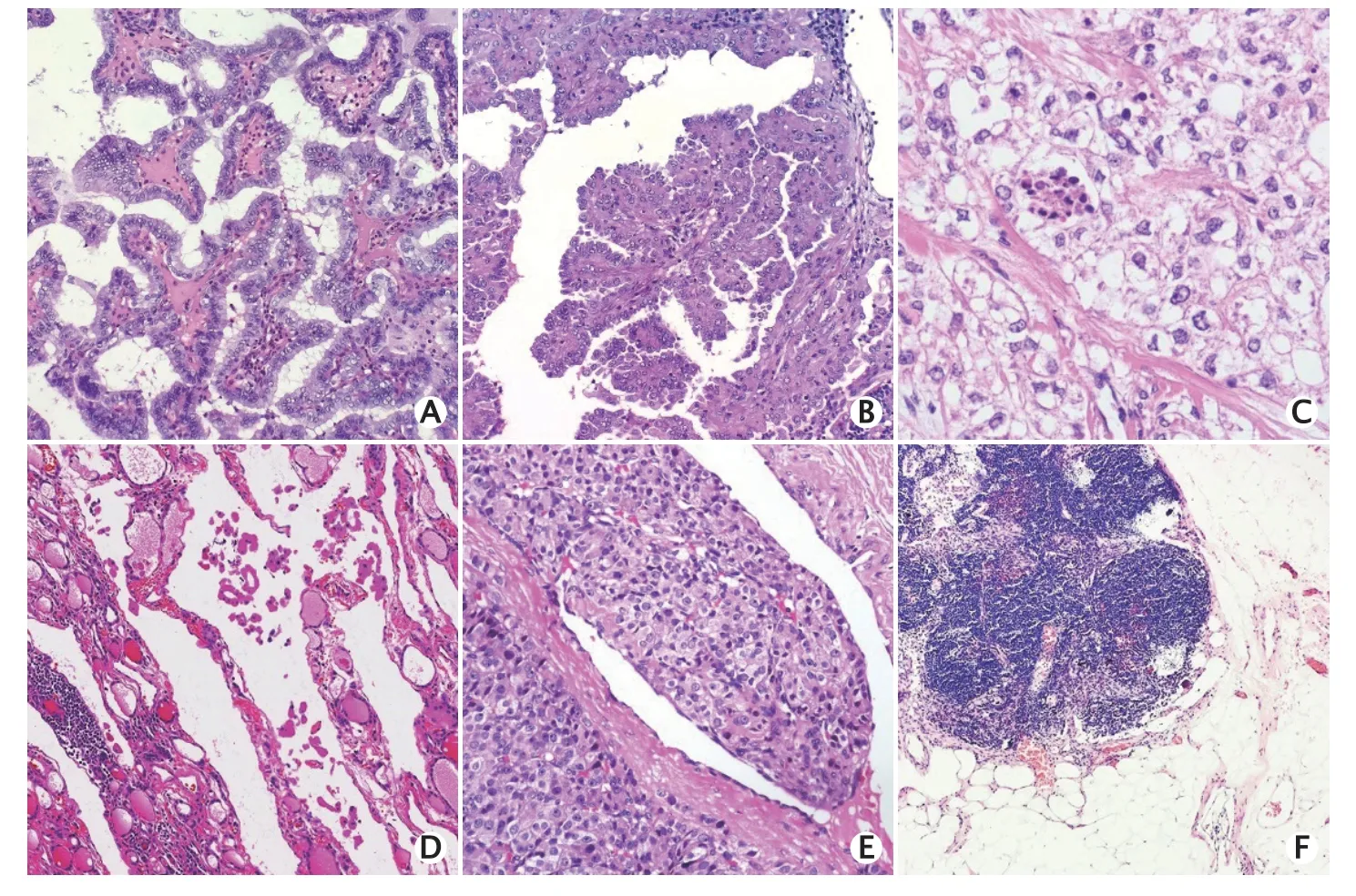
Fig.1 Pathological characteristics of different thyroid cancers.A: Papillary thyroid cancer,tall cell variant (hematoxylin eosin staining,×100);B: Papillary thyroid cancer,hobnail variant (hematoxylin eosin staining,×100);C: Papillary thyroid cancer,solid and clear cell variant,focus of necrosis could be observed(hematoxylin eosin staining,×200);D: Lymph vessel involvement of Hürthle cell cancer (hematoxylin eosin staining,×100);E: Encapsulated angioinvasive (oncocytic) cell cancer with blood vessel invasion(hematoxylin eosin staining,×100);F: The presence of psammoma bodies alone (without associated viable tumor cells) in a node is micrometastases (hematoxylin eosin staining,×100).图1 不同甲状腺癌的病理特征
2.3.1.3 筛状桑葚型、弥漫硬化型和鞋钉型
筛状桑葚型具有特异性的生物学特征,多伴有APC或β-catenin突变,并且与家族性腺瘤性息肉病相关,在某些情况下比结肠息肉或其他结肠外表现出现得更早,因此识别该亚型对于提示结直肠癌具有重要意义[21]。
弥散硬化型具有较高的侵袭性以及淋巴结转移率和局部复发率,该型发生腺外侵犯、颈部淋巴结转移和远处转移的概率高。对于弥散硬化型,需要开展更为积极的外科治疗,包括更广泛的淋巴结清扫[22];但是,其致死率与经典型PTC相似,10年疾病相关生存率高达93%。
鞋钉型较为罕见(仅占所有PTC的不足2%)(图1B),为侵袭型,其特征是在肿瘤中至少出现30%的鞋钉样细胞,易见坏死、核分裂象、血管淋巴管浸润和ETE,常见复发以及淋巴结或远处器官的转移。RAI摄取较少,病死率较高。
其他可能具有预后和治疗价值的亚型很少见,并且未经充分验证,包括嗜酸细胞型和实性型。
2.3.2 滤泡性甲状腺癌(follicular thyroid carcinoma,FTC)和Hürthle(嗜酸)细胞癌(Hürthle cell cancer,HCC)
FTC与滤泡腺瘤的主要区别在于是否具有包膜和(或)血管浸润。2017年WHO分类根据包膜和(或)血管浸润分成3型。(1)微小浸润型:仅包膜浸润;(2)包裹性血管浸润型:所有具有血管浸润者;(3)弥漫浸润型:甲状腺和(或)甲状腺外组织的广泛浸润,伴有明显的血管浸润。仅有包膜浸润而无血管浸润的FTC患者的预后较好。即便仅有1~2条BVI的FTC,亦可发生远处转移;血管受累越多,预后越差。最常见的远处转移部位为骨、肺、脑和肝脏。TERT启动子突变是肿瘤复发和死亡的独立危险因素。大多数的FTC为分化型甲状腺癌,RAI治疗效果好,生存期较长。
根据最新的WHO分类标准,HCC定义为嗜酸细胞占75%以上、缺乏PTC核特征且存在包膜和(或)血管浸润的肿瘤。HCC的生物学行为更具侵略性、具有不同的分子特征以及更低的RAI摄取率。HCC的治疗方案较PTC和FTC的局限。微小浸润性HCC患者的总生存率约为85%,弥漫浸润型约为10%,伴有低分化组织学特征的患者的预后更差。
2.3.3 低分化甲状腺癌(poor differentiated thyroid cancer,PDTC)
PDTC的预后介于分化型和间变性甲状腺癌(anaplastic thyroid cancer,ATC)之间,为实性、梁性和岛屿状生长模式的肿瘤;缺乏PTC细胞核特征;并且符合以下3条中的至少1条(10个高倍镜视野≥3个核分裂象、肿瘤性坏死、扭曲核)。识别这一侵袭性亚型对于治疗和随访均十分重要[3]。PDTC患者的5年生存率为60%~70%,复发多发生于发病前3年,平均疾病特异性生存时间为诊断后5年,对RAI治疗的反应差。
2.3.4 ATC
ATC由高度恶性形态组成,通常为致死性肿瘤。应在报告中注明有无分化好的成分,如PTC或HCC。肿瘤间变性成分的比例和大小对预后有所影响,但并非独立的预后因素[23]。残留病灶仍是预测总生存率的唯一的独立预后因素[23]。ATC患者的预后差,死亡率>90%。原发肿瘤伴广泛浸润是预后差的预测因素。老年患者、急性症状和白细胞增多均与生存率低相关。
2.4 核分裂象和坏死
ICCR专家组认为甲状腺癌病理报告中应包括核分裂象和坏死[24]。绝大多数甲状腺癌的核分裂象非常低。在核分裂象升高(≥3个核分裂象/2 mm2)的情况下需要进行计数;反之,可仅表示为<3个核分裂象/2 mm2。应于连续高倍视野下的热点区域进行核分裂象计数。
应在每一份甲状腺癌规范化报告中指出有无肿瘤坏死(图1C)。必须与梗死样坏死、细针穿刺活检相关的反应性改变或肿瘤内的缺血性改变进行区分。
2.5 肿瘤包膜或界限以及包膜浸润
在甲状腺癌中,纤维包膜或界限清晰至关重要。即使在高级别肿瘤如低分化癌中,包膜的存在仍提示预后较好[10,25]。
目前对于包膜浸润的病理定义仍存在争论,病理报告中无需报告包膜浸润的病灶数量。ICCR专家组认可CHAN提出的包膜和血管浸润诊断标准[13]。包膜浸润要求包膜全层穿透[26],但其判读一致性欠佳[27]。
2.6 淋巴和血管浸润
应区分淋巴管和血管浸润。FTC和HCC多侵袭薄壁小血管,而PTC(浸润性包裹性FVPTC除外)通常侵袭淋巴管。弥漫性硬化型PTC较易发现淋巴管浸润。HCC相较于FTC,除了可以发生BVI外,还多见淋巴管内癌栓(图1D)。BVI也可发生于PTC中,所侵犯脉管因其管径较大且管壁存在平滑肌而易被识别为血管。然而,在某些情况下,无法明确所浸润薄壁脉管类型时,可使用“无法分类的小脉管”予以描述。
BVI是重要的诊断和预后元素,必须明确诊断(图1E)。BVI在包裹性肿瘤中侵及的血管应包含包膜或包膜外的血管;而在仅有部分包膜或无包膜的浸润性肿瘤中,BVI可存在于肿瘤结节内。ICCR专家组认可CHAN提出的诊断BVI的标准[13],BVI需被覆血管内皮或伴有纤维素性坏死;如肿瘤具有包膜,则瘤内血管不应被诊断为BVI。
包裹型FTC或HCC中BVI病灶数量与预后相关[28]。ICCR指出,对于有包膜的病变,必须区分血管浸润是局灶性(1~3个病灶)还是广泛性(≥4个病灶)。尚无证据表明,BVI病灶数量与非包裹型PTC的预后相关,因此无需计数非包裹型PTC的BVI病灶数量。
完全包裹型PTC中的BVI病灶数量是核心元素。
2.7 ETE
ETE被定义为肿瘤浸润范围超出甲状腺包膜至甲状腺周围组织,在甲状腺癌中较为常见,在PTC中高达23.5%。ETE是与复发和死亡风险相关的不良预后因素。显微镜下可见ETE的相关复发风险为3%~9%[29];肉眼可见ETE的复发风险为23%~40%[30-31]。显微镜下可见ETE对于病变持续存在、无病生存和疾病特异性生存期来说,并非独立的预后因素,观察者之间的一致性较差[31-33]。ICCR强调病理报告应当做到如下2点:(1)评价ETE状态;(2)与外科医师沟通肿瘤分期,明确术中是否存在肉眼可见的ETE。
2.8 手术切缘状态
甲状腺癌手术切缘状态是必不可少的元素,可以分为3类:R0切除(镜下切缘阴性);R1切除(肉眼切除完整、镜下切缘阳性);R2切除(切缘阳性或切除不完全)[6]。术中肉眼可见切缘状态应由手术医师告知病理科医师。镜下切缘阳性的定义是染色组织边界和(或)甲状腺外表面可见肿瘤细胞[34-36]。甲状腺癌镜检切缘阳性并非复发和无疾病生存的独立预测因素,尤其是在对肿瘤分期和ETE进行调整之后[34-36]。美国甲状腺协会指南仅将不完全切除(R2)作为高风险病变的指标之一[3]。虽切缘状态被视为核心元素,但现有数据提示阳性切缘所在位置(尤其是在后表面)可能并不影响预后,因此被视为非核心元素[34,37]。
2.9 淋巴结状态
病理报告及分期中应包括淋巴结转移的详细特征(如数量、大小和淋巴结外浸润),应测量淋巴结最大转移灶的最大尺寸[33]。2019年,美国国家综合癌症网指南不再主张对于较小的N1a期(受累淋巴结数目<5个,最大转移灶直径<2 mm)行完全甲状腺切除术和术后RAI治疗。同样,低风险类别包括体积较小的转移性淋巴结,其定义为临床N0期或≤5个病理性N1微转移(最大转移灶直径<0.2 cm)[3]。对于高危人群,美国甲状腺协会认为受累淋巴结数目≥5个为中风险,而受累淋巴结直径≥3 cm为高风险。ICCR和美国病理学会以及最新的美国癌症联合委员会分期将淋巴结中仅存在砂粒体定义为微转移(图1F)[6]。
淋巴结外浸润并不罕见,在PTC中高达12%,在淋巴结转移性PTC中高达33%[33]。与ETE相似,甲状腺癌的淋巴结外浸润缺乏组织学标准共识,观察者之间的一致性较差[38]。然而,多数研究的结果表明,淋巴结外浸润与疾病持续和(或)复发相关[33,39]。因此,在分化型甲状腺癌病理报告中记录淋巴结外浸润十分重要。
2.10 伴随疾病和病理分期
伴随疾病包括伴有慢性淋巴细胞性甲状腺炎、滤泡性腺瘤、HCC、NIFTP和结节性增生等,有助于解释临床、影像学和细胞学检查结果,应予以报告。
病理分期适用于所有的肿瘤类型,包括ATC,迄今为止已被自动分成4期[6,8]。
3 结论
ICCR甲状腺规范化报告为甲状腺癌患者提供了翔实的病理学检查,为全球病理科医师建立起更为合理的指导患者预后的病理报告模板,从而有助于防止致死性恶性肿瘤患者的治疗不足,为惰性肿瘤患者免去不必要的治疗。

