香茅精油微胶囊的制备及表征分析
臧芳波,李冲,韩雪,冯随,时若栋,高晓光*
(1.河北科技大学 食品与生物学院,石家庄 050018;2.河北双鸽食品股份有限公司,石家庄 050021;3.河北省生猪加工技术创新中心,石家庄 050021)
香茅,又称柠檬草,味辛,性温,常生长于我国热带地区,如广东、海南、台湾,在东非和西印度群岛也有栽培[1]。香茅精油是从晒干的香茅茎叶中提取得到的油状物质。大多数香茅精油能检测出20~40种活性成分,其中香茅醛、香茅醇、香叶醇和橙花醇最为常见[2]。香茅精油具有抗菌、抗氧化、驱虫、抗惊厥等作用[3],常被用于驱蚊剂、肥皂、香水或食品添加剂[4]。但由于其稳定性较差,易氧化分解,有明显的独特气味,导致其在食品行业中的应用受到限制。将精油包埋在由多糖、蛋白质和脂质等壁材构成的微胶囊中,能提高精油的稳定性,掩盖其特殊气味,是扩大精油应用范围的一个重要手段[5]。
单个颗粒或液滴的固体或液体材料(芯材)被聚合物材料(壁材)的连续薄膜包裹或覆盖,产生几微米到几毫米大小的微粒胶囊的过程,称为微胶囊化[6]。微胶囊能有效提高被包埋物质(芯材)的稳定性,且可控制芯材释放,使其缓慢释放或在机械作用、pH 变化、酶催化、超声作用和盐类等刺激下快速释放[7-8]。目前,微胶囊技术已被应用在纺织业[9]、医疗药物[10]、食品[11]、农药用品[12]等多个领域。壳聚糖是一种具有良好生物相容性和可降解性的天然碱性多糖,由甲壳素脱乙酰化而来[13]。研究表明,壳聚糖还具有一定的抑菌作用,可以通过抑制三羧酸循环中关键酶的活性,导致菌体死亡[14]。酸性条件下,壳聚糖中的游离氨基被阳离子化,并与带负电物质发生交联作用形成微胶囊。
本研究以香茅精油为芯材,壳聚糖和三聚磷酸钠为壁材,采用离子交联法制备香茅精油微胶囊,通过粒度分布仪、扫描电镜、傅里叶红外光谱、热重分析仪对其粒径、形貌、热稳定性等表征进行分析,并研究了其包埋率、抑菌和抗氧化活性以及缓释性能,为香茅精油微胶囊在食品中的应用提供了理论基础。
1 材料与方法
1.1 材料与试剂
香茅精油:水蒸气蒸馏法提取,自制;壳聚糖:阿拉丁试剂有限公司;三聚磷酸钠:上海易恩化学技术有限公司;冰醋酸、氢氧化钠、吐温80、氯化钠:天津市永大化学试剂有限公司;胰蛋白胨、酵母浸粉:北京奥博星生物技术有限责任公司;无水乙醇:国药集团化学试剂有限公司。
1.2 仪器与设备
ME 104/02电子分析天平 梅特勒-托利多仪器有限公司;78-1磁力加热搅拌器 常州荣华仪器制造有限公司;ST2200ZH pH 计 奥豪斯仪器有限公司;LGJ-10D冷冻干燥机 北京四环科学仪器厂有限公司;SPECTRO star Nano 酶标仪 香港伯齐生物科技有限公司;UV-5800紫外可见分光光度计 上海元析仪器有限公司;STD-2960差热-热重联用热分析仪 美国TA 仪器公司;S-4800-Ⅰ场发射扫描电子显微镜 日立科学仪器(北京)有限公司;BT-9300S激光粒度分布仪 丹东百特仪器有限公司;TG16台式高速离心机 上海卢湘仪离心机仪器有限公司。
1.3 试验方法
1.3.1 香茅精油微胶囊的制备
参考姚洁玉等[15]的方法,并稍作修改。将壳聚糖溶于1%的醋酸溶液,搅拌后过夜。用2 mol/L 的NaOH 溶液调pH 值至4,制成2 mg/mL的壳聚糖溶液。加入体积1%的吐温80,搅拌1 h后冷却至常温,得壳聚糖-吐温80混合溶液,备用。将香茅精油溶于无水乙醇制成的精油醇溶液中,并滴入壳聚糖-吐温80混合溶液中,搅拌1 h后再滴入1.5 mg/mL的三聚磷酸钠溶液,继续搅拌1 h,使其充分交联。于10 000 r/min 离心15 min,弃去上清液,取下层于-80 ℃真空冻干。
1.3.2 标准曲线测定
将香茅精油稀释至合适浓度进行全波长扫描,测定最大吸收波长为260 nm。
将香茅精油用无水乙醇配制成1 mg/mL的母液,然后分别吸取1,3,5,7,9 mL母液,定容至10 mL后,使待测液浓度分别为0.1,0.3,0.5,0.7,0.9 mg/mL。以无水乙醇为空白对照,在260 nm(最大吸收波长)处测定吸光值。重复3次取平均值,绘制标准曲线,见图1。R2=0.999 4,表示线性关系良好。

图1 香茅精油标准曲线Fig.1 Standard curve of citronella essential oil
1.3.3 包埋率测定
准确称取0.10 g冻干后的香茅精油微胶囊粉末,溶于无水乙醇,并定容至100 mL,超声30 min后静置,于260 nm处测定吸光值,代入标准曲线计算浓度,通过下式计算包埋率:
包埋率=包埋的香茅精油质量/加入的总香茅精油质量×100%。
1.3.4 粒径分布
通过BT-9300S激光粒度分布仪测定,分散介质为超纯水[16]。开启循环泵,待提示后将样品缓慢加入到样品池中。仪器显示“浓度正常,可以使用”时停止加样,待遮光率稳定在10左右时,点击“连续”进行样品的测定,仪器自动测试3次并取平均值。遮光度为5%~15%,样品折射率为1.52,吸收率为0.1,介质折射率为1.333,采用体积分布进行数据统计。Span值表示微胶囊颗粒的均一性,Span值越小,表明均一性越好。
Span=(D90-D10)/D50。
式中:D10为累积分布10%的颗粒直径,μm;D50为累积分布50%的颗粒直径,μm;D90为累积分布90%的颗粒直径,μm。
1.3.5 扫描电镜分析
用毛细管蘸取微胶囊粉末,用导电胶将其固定在载物台上,通过离子喷涂机进行喷金。调整不同倍数观察样品形态[17]。
1.3.6 傅里叶红外光谱分析
扫描波长为500~4 000 cm-1,对香茅精油、香茅精油微胶囊、壳聚糖进行光谱分析。
1.3.7 热稳定性分析
准确称取10 mg样品,并将其放入坩埚内,用氦气作为保护气,流速为20 mL/min,加热速率为10 ℃/min[18]。
1.3.8 抑菌率测定
采用混菌法测定。称取0.10 g香茅精油微胶囊冻干粉末,紫外灭菌30 min备用。取1 mL菌悬液与9 mL 无菌生理盐水在试管中混匀,加入紫外灭菌后的香茅精油微胶囊冻干粉末反应10 min。空白组不加香茅精油微胶囊冻干粉末。吸取100 μL处理液用涂布器将菌液均匀分布在已凝固的LB固体培养基表面,37 ℃恒温培养24 h。
抑菌率(%)=(A-B)/A×100。
式中:A为空白组的菌落数;B为处理组的菌落数。
1.3.9 DPPH 自由基清除率
将2 mL样品和2 mL 0.1 mmol/L的DPPH-乙醇溶液振荡混匀,避光反应30 min,于517 nm 处测定吸光值,BHT为阳性对照[19]。
DPPH清除率(%)=(A1-A+A2)/A1。
式中:A为2 mL样品+2 mL DPPH 的吸光值;A1为2 mL DPPH+2 mL乙醇的吸光值;A2为2 mL 样品+2 mL乙醇的吸光值。
1.3.10 香茅精油微胶囊释放性能研究
参考GB 31604.1—2015《食品安全国家标准 食品接触材料及制品迁移试验通则》中的食品模拟体系,选取以下食品模拟体系:水包油食品:50%乙醇;脂类食品:95%乙醇。25 ℃恒温水浴轻微振荡,在第0,3,6,12,24,36,48,60,72 h时取样,并补充释放介质,离心后取上清液测定吸光值。
1.4 数据处理
每组试验均重复3次,结果用Origin 2021处理。
2 结果与分析
2.1 香茅精油微胶囊包埋率
香茅精油微胶囊包埋率是指被包埋的香茅精油质量与添加的总香茅精油质量的比值。被包埋的香茅精油越多,包埋率越高。本次试验条件下的包埋率为(92.24±0.52)%,说明绝大部分的香茅精油能够被有效包埋。
2.2 香茅精油微胶囊粒径及粒径分布
微胶囊的流动性、溶解性和分散性都直接受到颗粒大小及均匀性的影响,香茅精油微胶囊粒径分布图见图2。香茅精油微胶囊粒径大小在微米范围内,呈正态分布,主要分布在10~30 μm 之间,平均粒径为16.76 μm。D10为5.37 μm,中位径D50为15.47 μm,D90为30.71 μm,计算得到的Span值为1.64,样品均一性较好。

图2 香茅精油微胶囊粒径分布图Fig.2 Particle size distribution of citronella essential oil microcapsules
2.3 香茅精油微胶囊的形貌特征

图3 香茅精油微胶囊扫描电镜图Fig.3 SEM image of citronella essential oil microcapsules
由图3可知,香茅精油微胶囊呈小球状,大小分布较均匀。有的颗粒粘连在一起,可能是因为壳聚糖具有一定的黏性,从而使得微胶囊团聚在一起。扫描电镜图显示,香茅精油微胶囊的粒径大约在50~150 nm 之间,比粒径分布仪得到的结果要小,可能是由于用粒径分布仪测定时,样品分散在水中,发生了溶胀现象,而扫描电镜观察的样品是冻干以后的粉末。Hasheminejad 等[20]比较了丁香精油微胶囊在扫描电镜下和分散在水中时的粒径大小,与本研究结果一致。
2.4 香茅精油微胶囊的红外表征

图4 香茅精油、壳聚糖和香茅精油微胶囊红外光谱图Fig.4 Infrared spectra of citronella essential oil, chitosan and citronella essential oil microcapsules

2.5 香茅精油微胶囊热稳定性分析
温度在50~600 ℃范围内,壳聚糖和香茅精油微胶囊的热重分析曲线见图5。

图5 壳聚糖、香茅精油、香茅精油微胶囊热重分析图Fig.5 Thermogravimetric analysis of chitosan, citronella essential oil and citronella essential oil microcapsules
由图5可知,香茅精油分解速度极快,在60 ℃左右就开始分解,117 ℃时分解最快,180 ℃时质量损失为98.71%,因此需要采取一定措施来保护挥发性的香茅精油。壳聚糖的失重分为两个阶段:50~110 ℃时主要为壳聚糖中结合水的挥发,失重为1.12%,随着温度的升高,壳聚糖发生热分解,298 ℃达到最大分解速度。香茅精油微胶囊的失重主要有3个阶段:50~109 ℃时质量损失为3.94%,此时主要是微胶囊中结合水以及表面残留的部分精油挥发;206~263 ℃时,壁材的化学键发生断裂,香茅精油得以逸出并挥发,此阶段的质量损失为22.5%,与香茅精油相比,微胶囊内的精油失重温度右移,且挥发速率减慢,表明香茅精油被包埋进壁材内,成功得到了保护;温度高于263 ℃时剩下的香茅精油继续挥发,同时壁材也开始分解碳化。香茅精油微胶囊在253 ℃时达到最大分解速度,可以满足大多数加工运输和储藏环境要求,保持性质稳定。
2.6 香茅精油微胶囊抑菌性分析
香茅精油微胶囊对供试菌金黄色葡萄球菌和大肠杆菌的抑制效果见表1。

表1 香茅精油微胶囊对金黄色葡萄球菌和大肠杆菌的抑制率Table 1 Inhibitory rate of citronella essential oil microcapsules against Staphylococcus aureus and Escherichia coli
由表1可知,香茅精油微胶囊对大肠杆菌和金黄色葡萄球菌有非常显著的抑制效果,特别是对大肠杆菌。当香茅精油微胶囊浓度为4 mg/mL时,对金黄色葡萄球菌和大肠杆菌的抑制率分别为94.64%和97.44%,浓度为6 mg/mL时能完全抑制供试菌株生长。香茅精油微胶囊有如此好的抑菌效果主要是因为其芯材中含有醛类、醇类等有抑菌效果的活性成分,同时所用的壁材壳聚糖也被证实具有一定的抑菌性。
2.7 香茅精油微胶囊抗氧化性分析
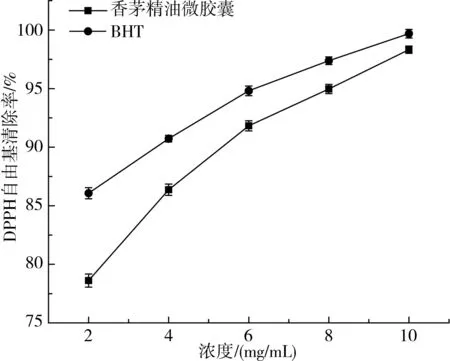
图6 香茅精油微胶囊DPPH 清除率Fig.6 DPPH scavenging rate of citronella essential oil microcapsules
由图6可知,随着香茅精油微胶囊和BHT 浓度的增加,DPPH 自由基清除率均逐渐增大。香茅精油微胶囊浓度为2 mg/mL时,DPPH 清除率为78.61%。当浓度增加到10 mg/mL 时,DPPH 清除率可达到98.32%,表现出优良的抗氧化能力。整个实验过程中,香茅精油微胶囊的自由基清除能力虽始终弱于商业抗氧化剂BHT,但随着浓度的增加,两者清除自由基能力的差距逐渐缩小。
2.8 香茅精油微胶囊释放性能分析
不同食品模拟体系中,香茅精油微胶囊的释放曲线见图7。

图7 香茅精油微胶囊释放曲线Fig.7 Release curve of citronella essential oil microcapsules
由图7可知,室温第3天时,香茅精油微胶囊在水包油食品和脂类食品中尚未完全释放,累积释放率分别为86.74%和89.31%,且释放速率曲线逐渐变缓。表明微胶囊处理后香茅精油挥发性一定程度上得以改善,有利于其持续使用。
3 结论
通过离子交联法制得的香茅精油微胶囊包埋率为92.24%,结合红外光谱分析结果可知,绝大部分香茅精油能得到有效包埋。制得的香茅精油微胶囊呈小球状,表面光滑,有团聚现象。粒径大小在50~150 nm之间,呈正态分布,均一性较好。具有较强的抑菌和抗氧化作用,且作用效果具有一定的剂量依赖性。香茅精油经微胶囊技术处理后,热稳定性和挥发性得到改善,可以满足大多数加工运输和储藏环境要求。

