放射性造影剂相关超敏反应的诊断
许凤,肖浩,张虹婷,石楚琪,贾巧茹,张莉,孟娟
临床中增强CT检查、尿路造影、血管造影使用的造影剂为碘造影剂(iodinated contrast media,ICM),通过造影可显示病变组织与正常组织之间造影剂摄取的差异,从而判断病灶的性质。据统计,目前全球每年ICM用量超7 500万支[1]。增强核磁共振检查(MRI)使用的造影剂为钆造影剂(gadolinium-based contrast agent,GBCA),GBCA在神经系统疾病中的应用不仅可以提高诊断的准确性,还可以提供功能相关的信息,全球每年GBCA用量约5千万支[2]。造影剂具有化学惰性,大多数情况下使用是安全的,但由于其临床应用广泛,所以仍存在引发不良反应的风险。造影剂相关不良反应可发生在口服、灌注给药、血管内给药后,但绝大多数发生在血管内给药后。速发型不良反应通常发生在给药后数分钟至1 h内,约70%的速发型反应在给药5 min内即出现[3]。根据反应的性质可分为速发型超敏反应(immediate hypersensitivity reaction,IHR)和生理性反应(physiologic reactions)。IHR也称过敏样反应(allergic-like reactions),生理性反应也称毒性反应、化学毒性反应,生理性反应较IHR常见。迟发型超敏反应(non-immediate hypersensitivity reactions,NIHR)通常发生在给药1 h以后。
1 造影剂超敏反应流行病学
不同研究中造影剂诱发超敏反应的流行病学数据差异较大,考虑有以下原因:(1)对IHR及NIHR定义不完全一致;(2)区分IHR与生理性反应困难;(3)发生率低,需要极大样本才能得到准确的发病率数据。
据统计,离子型和非离子型ICM引发IHR发生率分别为3.8%~11.7%[4]和0.7%~3.1%[5- 7],其中98%以上为轻度反应,严重或危及生命的IHR发生率为0.02%~0.04%[5,8],总体死亡率小于1/17万[9]。ICM引发NIHR发生率在0.5%~23%之间[10]。
GBCA相关IHR发生率为0.004%~0.7%[11],其中96%以上为轻度且呈自限性[12- 13],严重超敏反应的发生率约为5.2‰[13]。GBCA极少出现危及生命的严重不良反应,但也有报道[14],据美国食品和药物管理局(Food and Drug Administration,FDA)估计,GBCA致死率为0.08‰[15]。
既往有使用造影剂后出现IHR的患者,在进一步诊疗过程中若确实需使用造影剂,则需主诊医师、放射科医师、变态反应科医师共同协作,为患者寻找安全性高的替代用药方案,规避潜在风险。本文总结了造影剂相关超敏反应的评估、诊断和预防等,以期提高临床医务人员对造影剂相关超敏反应的认识和诊疗水平。
2 碘造影剂特性和分类
目前临床增强CT检查所使用的静脉造影剂均为ICM,即三碘苯环的可溶性衍生物,根据ICM在溶液中是否电离出离子分为离子型和非离子型造影剂;根据分子结构不同可分为单体型和二聚体型造影剂;按照其渗透压的不同分为低渗(low-osmolality contrast media,LOCM)、等渗(iso-osmolality contrast media,IOCM)和高渗造影剂(high-osmolality contrast media,HOCM)[16]。HOCM为离子型单体,其渗透压高达血浆的5~7倍,诱发不良反应的几率较IOCM、LOCM明显增高,所以自1995年IOCM和LOCM投入临床使用以来,HOCM已不再使用。IOCM渗透压与血浆相等,LOCM渗透压约为血浆的2倍(故也称次高渗ICM)。非离子型ICM比离子型ICM副作用更小,不良反应发生率更低。美国放射学会手册(Manual of the American College of Radiology)的附录A中可以查阅到目前市面上所有的ICM目录及分子特性[17]。以下列出国内常见的ICM名称及特性(表1)。
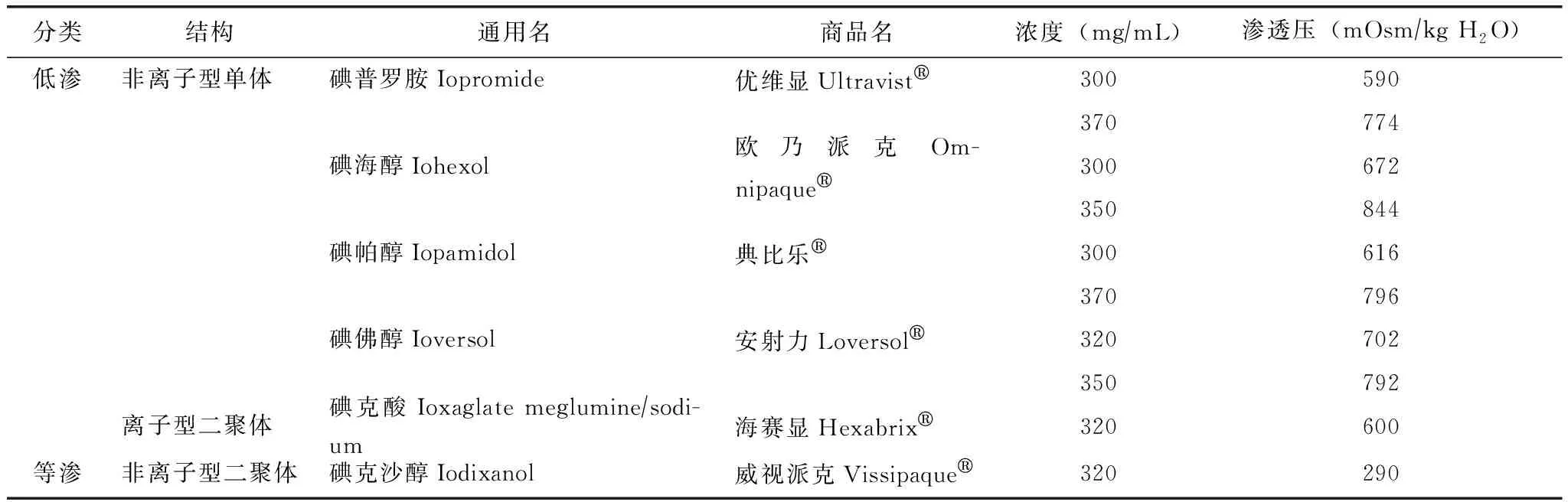
表1 我国常用碘造影剂名称及特性Table 1 Name and characteristics of iodinated contrast media commonly used in China
3 碘造影剂相关速发型不良反应
3.1 速发型超敏反应
HOCM引发速发型不良反应的概率较高,通常认为这种不良反应与HOCM的毒性反应有关,并非过敏反应。ICM相关超敏反应的发病机制尚不明确,既往认为是非免疫机制介导,可能与ICM浓度或分子结构等引起的直接膜效应,导致肥大细胞、嗜碱性粒细胞脱颗粒释放组胺和炎症介质、补体系统激活、缓激肽形成有关[3,18]。但随着IOCM与LOCM临床使用增多,研究发现其引发的IHR部分可能为IgE介导的过敏反应[19],此外,Mita等[20]发现碘克沙酸血清特异性IgE的存在进一步支持上述观点。一项meta分析总结了21项研究数据,发现既往发生ICM诱发严重不良反应的患者中,52%皮试阳性[5]。Kim等[21]对51例既往出现过ICM诱发严重IHR的患者进行规范皮试,其中65%皮试阳性,而这一比例在严重IHR且伴低血压的患者中上升至81.8%。上述研究提示严重IHR为IgE介导过敏反应的可能性更高。欧洲一项多中心研究发现,既往发生碘造影剂IHR且皮试为阳性的患者中,30%患者为首次使用ICM[22],这表明许多患者在首次接触ICM之前就已致敏,该情况类似于肌松剂的致敏过程,目前认为可能的机制为患者前期接触的某些分子结构类似的物质导致了致敏,具体的致敏途径尚不清楚。
3.1.1 速发型超敏反应的临床表现:速发型超敏反应通常在暴露于造影剂后数分钟至1 h内出现症状,可出现全身多系统表现。70%的IHR表现为给药5 min内皮肤风团、瘙痒、血管性水肿,除此之外,也可表现为喷嚏、流涕、眼红、眼痒等,中重度反应可出现声嘶、喘息、呼吸困难、咳嗽、胸闷,甚至出现血压降低、血氧饱和度下降、过敏性休克等,大约96%的严重IHR发生在给药20 min内[23]。
Brown等[24]将严重过敏反应的程度分为三种程度,轻度:仅出现皮肤和皮下组织症状,中度:呼吸系统、心血管系统、胃肠道症状;重度:缺氧、休克以及中枢神经系统受损症状。
3.1.2 皮试在速发型超敏反应的诊断价值:皮试的有效性既往存在争议,2010年美国放射学会(American College of Radiology)及美国药物过敏实践指南(American Drug Allergy Practice Parameter)不推荐皮试用于造影剂过敏的评估[25],但2018年欧洲药物过敏意见书(European Position Paper on Drug Allergy)及美国过敏与临床免疫学会(American Academy of Allergy and Clinical Immunology,AAACI)推荐皮肤试验用于造影剂超敏反应诊断[4,26- 27],国际药物过敏专家小组讨论后认为,皮试可区分过敏及非过敏机制超敏反应,并且皮试为阴性结果的候选造影剂可作为安全替代用药[4,23]。
当患者需再次使用ICM时,如既往出现的症状为较单一的轻度症状(如注射部位灼热感、红斑、恶心、肌痛/关节痛、感觉异常、头痛、头晕等),建议使用ICM前给予预防用药(糖皮质激素及抗组胺药物)或者直接更换另一种IOCM或LOCM,可不进行诊断试验。更换ICM后再发IHR的几率下降67.1%[28]。而既往反应严重者(如风团、血管性水肿、支气管痉挛、严重过敏反应等),由于再次发生严重不良反应的风险增高,预防给药不能完全规避上述风险,且重症超敏反应患者为IgE介导过敏反应的可能性相对较高,可疑ICM皮试阳性率增高,而皮试阴性的候选ICM可作为安全替代[4,23]。因此造影剂皮试的适应征为:(1)近期使用造影剂后发生严重速发型反应,且今后有再次应用造影剂需求的患者;(2)经预防用药后仍然发生突破性反应的患者。对于未使用过造影剂的人群,皮试不能作为造影剂过敏的常规筛查方法[27,29]。
3.1.3 碘造影剂皮肤试验:欧洲过敏及临床免疫学会药物过敏工作组(European Academy of Allergy and Clinical Immunology,European Network on Drug Allergy,EAACI,ENDA)的一项多中心研究显示,在不良反应发生后2~6月期间进行规范皮试,IHR和NIHR的皮试阳性率分别为50%和47%,超过这个时间窗口,皮试阳性率分别下降至18%和22%[4,22]。皮试的试剂种类应同时包括病史中诱发不良反应的可疑造影剂和其他可替代的候选造影剂,由于每个影像中心可供选择的造影剂种类有限,所以需与影像科医生沟通后以确认可供使用的替代造影剂。试验前应充分采集病史,签署知情同意书。
皮试分为两步:皮肤点刺试验(skin prick test,SPT)和皮内试验(intradermal test,IDT)。IDT灵敏度较SPT高[19,22],但对于既往发生严重过敏反应的高风险患者,首先进行SPT有助于提高诊断流程的安全性,可检测出罕见的高度敏感的患者。ENDA/EAACI推荐使用ICM原液进行SPT[7],其碘浓度为300~320 mg/mL。SPT在前臂曲侧正常的皮肤进行,需设立阴性(变应原溶媒或生理盐水)、阳性对照(10 mg/mL组胺),20 min后判读结果:若风团直径较阴性对照≥3 mm判定为阳性[30]。
若SPT阴性,需进一步行IDT。IDT浓度尚未完全统一,目前大多数研究使用1∶10稀释的浓度进行,这也是ENDA/EAACI推荐的浓度[26],该浓度碘含量为30~32 mg/mL。IDT操作方法:将 0.02~0.03 mL造影剂稀释液注入前臂曲侧皮内,形成直径不大于3 mm的皮丘,20 min 后判读结果。若皮丘直径较之前扩大3 mm及以上为阳性反应,伴有红斑和痒感更支持阳性反应[30]。
ICM规范皮试的特异度大于95%[22,31],阴性预测值(negative predictive value,NPV)在不同研究中报道为91%~100%[18,19,32- 34],尚无阳性预测值的准确数据。Schrijvers等[33]总结了423例既往使用ICM后发生IHR患者临床数据,其中172例使用皮试阴性的ICM后,94.2%患者可耐受,而再次出现不良反应的患者大多数临床症状较前减轻。值得注意的是,由于ICM引发的超敏反应并非均为IgE介导,皮试阴性者并不能完全除外超敏反应的可能性,所以,对于既往出现ICM严重过敏反应的患者,更换另一种皮试阴性的ICM,必要时造影前给与预防用药是更安全的选择。
3.1.4 碘造影剂激发试验:造影剂激发试验(drug provocation test,DPT)临床中很少使用,由于ICM皮试的NPV较高,且静脉注射ICM有引起急性肾损伤的风险,故对于皮试阴性者,有研究认为进一步行DPT对大多数患者获益不大。仅在权衡利弊后的少数情况下,如患者既往使用ICM后发生严重过敏反应,需确认皮试阴性的拟替代ICM的安全性,需在经验丰富的变态反应科医生严密观察且具备充分的抢救条件下进行。但国外也有学者认为,应常规对皮试阴性的ICM进行DPT以确诊或排除过敏[35]。
进行DPT前,需综合评估患者全身状况,检测患者的肾功能指标,包括肌酐、肾小球滤过率(eGFR),因静脉注射ICM可能影响肾功能,引起二甲双胍蓄积和乳酸中毒风险增高,故试验前24 h需停用二甲双胍类药物。以下情况不宜进行DPT:(1)肾功能不全;(2)正在使用肾毒性药物;(3)7天内进行过增强CT检查或计划7天内有使用ICM需求者;(4)放射性碘治疗或甲亢患者;(5)孕妇、哺乳期患者。
DPT总剂量标准未完全统一,目前EAACI推荐2种经验性静脉注射给药方案[6]:(1)先后给与5、15、30、50 mL,总剂量100 mL,间隔时间45 min。(2)先后给与0.05、0.5、1.0、5.0、7.5、10、25 mL,总剂量49.05 mL,间隔时间30 min。若患者前期的不良反应仅为主观症状,需在激发时设置安慰剂(生理盐水)对照,试验过程中诱发出与先前不良反应相同的临床症状或客观体征判定为阳性。
3.1.5 体外试验:体外试验(vitro test)包括组胺释放试验、类胰蛋白酶测定(tryptase determination)和嗜碱性粒细胞活化试验(basophil activation test,BAT)。IgE介导的速发型过敏反应发生时肥大细胞和嗜碱性粒细胞活化,释放组胺进入血清,数分钟后即可在血清中测量出,但组胺在体内降解快,半衰期仅15~20 min,且对实验设备及实验室条件具有较高要求,所以临床应用受到限制。
类胰蛋白酶由肥大细胞及嗜碱性粒细胞释放入血清,通过检测IHR发生后的血清类胰蛋白酶水平(4 h以内)及基线值(症状完全缓解后至少24 h),可有助于判断是否为严重过敏反应,正常血清总类胰蛋白酶水平为1~11.4 ng/mL,当IHR发生后4 h内血清类胰蛋白酶水平达到1.2倍基线值+2 ng/mL时,判定为阳性[36]。血清类胰蛋白酶升高通常为一过性,在不良反应达峰值后15 min至3 h之间采集的血液样本检测数据灵敏度最高。需要注意的是,并非所有过敏反应都会导致类胰蛋白酶升高,故类胰蛋白酶水平正常并不能排除全身性过敏反应。
BAT是药物过敏反应的辅助诊断方法,国外有三项样本量较小的研究中提出ICM过敏反应BAT检测灵敏度为46%~63%,特异度为88%~100%[19,32,37]。对于重度反应的患者,BAT可作为其他诊断方法的补充,其结果与皮肤试验及DPT具有一定相关性[6]。
3.2 生理性反应
ICM的速发型不良反应中,生理性反应较超敏反应更为常见,生理性反应呈剂量和浓度依赖性,与造影剂的直接化学毒性、渗透毒性等有关。生理性反应的症状包括一过性发热、皮肤潮红、寒战、恶心、呕吐、胸痛、心律失常、癫痫发作、血管迷走神经反应等。与过敏反应不同,通过减少ICM使用剂量、降低注射速度、预防性给予糖皮质激素及抗组胺药物,可减少甚至完全避免生理性反应发生[38]。
4 碘造影剂相关迟发型超敏反应
ICM诱发的NIHR为T细胞介导的Ⅳ型超敏反应,患者病变皮肤活检通常显示血管周围有单核细胞、CD4+和CD8+T细胞浸润。NIHR最常见症状为使用ICM后1小时至数天后出现注射部位的红斑、肿胀、疼痛、瘙痒、斑丘疹,也有严重者出现伴嗜酸粒细胞增多和系统症状的药疹(drug rash with eosinophilia and systemic symp toms,DRESS)、史蒂文斯-约翰逊综合征(Stevens-Johnson syndrome,SJS),甚至中毒性表皮坏死松解症(toxic epidermal necrolysis,TEN)[39]。非离子二聚体ICM较非离子单体ICM更易诱发NIHR,约50%以上的斑丘疹型药疹(maculopapular exanthema,MPE)是由非离子二聚体ICM碘克沙醇诱发[40]。对于怀疑ICM诱发的NIHR,建议行皮肤试验以明确诊断,同时寻找安全可替代ICM。
4.1 碘造影剂NIHR的诊断
4.1.1 皮肤试验:皮肤试验包括斑贴试验(patch test,PT)及延迟判读IDT(delayed reading intradermal test)。PT在上背部正常的皮肤上进行,推荐浓度为原液,分别在48 h后及72~120 h后判读结果。阳性结果可表现为接触部位皮肤出现丘疹、红斑、水泡、大疱等。延迟结果判读IDT在上背部或上臂正常皮肤上进行,推荐使用1∶10稀释的浓度进行皮内注射,该浓度下皮肤非特异性刺激小,分别在20 min、48 h及72 h后对皮肤红斑、硬结、水疱和瘙痒等表现进行评估。有学者建议,若结果为阴性,可进一步使用ICM原液进行延迟判读IDT以增加检测灵敏度[41]。延迟判读IDT灵敏度高于PT[42]。值得注意的是,对于使用ICM后出现严重NIHR,如SJS/TEN,可直接禁用ICM,皮试意义不大[43]。
欧洲一项多中心研究对98例怀疑ICM诱发的NIHR患者进行了皮肤试验,发现在NIHR发生后1~6月期间进行皮肤试验阳性率为48%,超过6个月以后皮肤试验阳性率降低[22]。Torres等[41]对161例既往ICM引发NIHR的受试者分别进行PT、延迟判读IDT及激发试验,78例最终经激发试验确诊ICM过敏的患者中仅34例皮试阳性,该研究认为皮试灵敏度较差。Schrijvers等[33]对118例ICM引发NIHR患者进行皮试,其NPV为86.1%,相较于IHR,其NPV更低。
4.1.2 淋巴细胞转化试验:淋巴细胞转化试验(lymphocyte transformation test,LTT)是诊断T细胞介导的迟发型药物过敏反应的辅助检测方法,可检测循环中的抗原特异性记忆T细胞,既往研究认为ICM诱发的NIHR患者体内T细胞可特异性识别ICM[44],但不同研究中LTT的灵敏度差异较大,NPV尚不明确,故LTT临床应用价值有待进一步研究。
5 碘造影剂的交叉反应
不同ICM之间可发生交叉反应,一项meta分析纳入726例既往发生碘造影剂IHR患者[5],39% IHR受试者对两种或多种ICM皮试阳性,这一比例在NIHR患者中为68%,交叉反应在NIHR中的发生率较IHR中更高。Doa等[35]对321例既往使用ICM后发生IHR或NIHR的受试者进行皮试及激发试验,发现所有确诊ICM过敏患者中,35.6%患者对2种及以上ICM过敏。交叉反应的机制尚不明确,目前认为可能与ICM分子结构相关。Lerondeau等[45]对97例ICM诱发过敏反应患者进行研究后提出ICM可分为3个亚类,亚类内部交叉反应风险更高,但后续研究结果与该研究结果不完全吻合。所以,目前选择可替代的造影剂时,可根据医疗单位可提供的造影剂种类范围进行选择。
值得注意的是,虽然ICM是碘与苯环结合的衍生物,但是碘分子并不具有免疫原性。碘可存在于天然含碘食物(如鱼贝类、海产品、饮用水、牛奶)或加碘食物(如碘盐)中,人体从食物中获取碘,以碘离子形式被小肠吸收,循环中的碘被甲状腺摄取,用于合成甲状腺素及合成途径中的中间代谢产物,并储存于甲状腺中。同时,碘也存在于许多药用化合物中,例如消毒剂聚维碘、碘酊、胺碘酮等,对这些药品过敏的患者是对聚合化合物分子的反应,而不是对分子中碘元素过敏[46]。此外,进食海产品过敏的患者也与ICM过敏无相关性,海产品中真正的变应原致敏蛋白组分为其中的蛋白质,而非其含有的碘元素。既往海产品过敏史的患者与其他类型过敏症患者相比,患者使用ICM发生不良反应的几率并未增加[47],并非使用ICM的禁忌证。
6 钆造影剂
钆(Gd)是一种顺磁性很强的金属离子,MRI检查中使用的GBCA是一种顺磁性大环或线性含钆螯合物[8],根据化学结构的不同,GBCA可分为线状离子型、线状非离子型、大环状离子型、大环状非离子型四个大类。美国放射学会手册附录A中可以查阅目前市面上的GBCA及其分子特性,目前英国批准了8 种含钆造影剂可用于临床(表2)。国内最常用的包括钆喷酸葡胺(Gd-DTPA),钆特酸葡胺(Gd-DOTA),钆双胺(Gd-DTPA-BMA)等。

表2 常用钆造影剂名称及特性Table 2 Name and characteristics of GBCA commonly used
GBCA诱发过敏反应的报道并不少见[13,48- 49],但与ICM相比,其发生率更低,且严重过敏反应极为罕见。与ICM相同,GBCA诱发的严重过敏反应也可发生在首次用药时[49]。GBCA诱发的IHR与前述ICM诱发IHR症状相似,此处不做赘述。2017年一项meta分析[13]统计了716 978次GBCA应用,其中80%以上的IHR为轻度反应且呈自限性,13%为中度、6%为重度反应。该研究中,线性非离子型GBCA钆双胺诱发不良反应几率最低,但离子型GBCA与非离子型GBCA诱发不良反应的几率无明显差异。
GBCA诱发严重过敏反应患者血清中类胰蛋白酶升高[50]及BAT阳性[51]证明GBCA诱发IHR的过程涉及肥大细胞激活,少数IHR患者对GBCA皮试呈阳性[52],由此可见IgE介导的免疫反应是患者发生IHR的可能机制之一,但皮试阳性更常见于严重过敏反应患者。大部分GBCA诱发IHR并非IgE介导的过敏反应,所以,皮试在GBCA过敏反应中的诊断价值尚有争议,目前认为皮试有助于确认机制是否为过敏反应及寻找替代GBCA。
GBCA皮试的临床研究比ICM少,皮试标准尚未完全统一,已发表的研究中SPT均使用未稀释原液进行,若皮试阴性,大部分学者使用1∶1 000、1∶100、1∶10三个浓度梯度依次进行IDT[49,52- 54]。使用原液进行IDT可引发皮肤非特异性刺激反应。
目前尚无可靠的GBCA皮试灵敏度、特异度和NPV的大样本数据。法国一项为期5年的多中心研究对36例GBCA诱发IHR患者进行皮试,其中27.8%患者呈阳性反应[42]。Chiriac等[52]对27例既往使用GBCA后诱发IHR患者进行皮试,其中11例可疑GBCA皮试阳性,这些患者再次使用皮试阴性的替代GBCA,均可耐受。Kolenda等[53]对33例既往使用GBCA后诱发IHR患者进行规范皮试,19例GBCA皮试阳性的受试者中,11例使用皮试阴性的可替代GBCA后证实可耐受,作者认为GBCA皮试阴性预测值较高。同时,该研究中19例皮试阳性的患者有13例BAT阳性,14例皮试阴性的患者中有13例BAT阴性,BAT特异度为93%,灵敏度为69%。由此可见,BAT对GBCA过敏诊断具有一定诊断价值及应用前景,但仍需更大样本研究验证。GBCA极少诱发NIHR,仅见数例报道,包括MPE[55]、发疹性脓疱病(exanthematous pustulosis,AGPE)等[56]。目前尚无关于GBCA激发试验的数据。
GBCA交叉反应的机制尚未完全明确,目前研究认为,大环和线性GBCA之间无交叉反应[49],怀疑GBCA诱发IHR时,可选择分子结构不同的其它GBCA作为替代。但此观点缺乏足够的证据支持。
7 预防给药原则
对于既往使用造影剂有不良反应病史且再次发生IHR风险较高时,可在再次检查前预防性用药,可减少再次暴露后发生IHR的概率、减轻症状严重程度[57]。但欧洲放射科医师认为这种方式的有效性仍存在争议,给药后仍可能发生“突破性反应”[4]。
预防给药包括糖皮质激素以及H1抗组胺药物,具体给药方案尚无统一标准。据文献推荐有以下几种方案:(1)检查前13、7、1 h分别口服泼尼松50 mg或静脉注射甲泼尼龙琥珀酸钠40 mg,且检查前1 h静注、肌注或口服抗组胺药物(如苯海拉明50 mg);(2)造影剂注射前12、2 h分别口服甲泼尼龙32 mg,检查前1 h使用一种抗组胺药;(3)若是紧急情况下使用造影剂,可在检查前1 h静脉应用苯海拉明及200 mg氢化可的松[16,54]。
造影剂引发的不良反应包括超敏反应备受关注,虽然严重过敏反应罕见,然而一旦发生,可对患者造成重大伤害,临床医师需对此类不良反应有充分的认识,熟悉诊断及处理流程(图1),以期更合理、规范处理造影剂相关不良反应特别是超敏反应。

图1 造影剂相关不良反应处理流程图Fig 1 processing flow chart of adverse reactions to radiographic contrast mediaIHR:速发型超敏反应;NIHR:迟发型超敏反应;SPT:皮肤点刺试验;IDT:皮内试验

