不同机械伤处理对香蕉果皮活性氧代谢的影响
王 敏,殷菲胧,梁园丽,刘云芬,廖玲燕,潘中田,帅 良
·农产品加工工程·
不同机械伤处理对香蕉果皮活性氧代谢的影响
王 敏1,2,殷菲胧1,梁园丽1,刘云芬1,廖玲燕1,潘中田1,帅 良1※
(1. 贺州学院食品与生物工程学院/广西康养食品科学与技术重点实验室,贺州 542899;2. 大连工业大学食品学院,大连 116034)
为探究不同机械伤处理对香蕉果皮活性氧代谢的影响,该研究以“桂蕉6号”为材料,采用划伤、穿刺、坠落3种不同机械伤处理,以未处理组为对照,测定贮藏过程中香蕉果皮活性氧代谢的变化,并进行相关性分析和主成分分析。结果表明,3种不同机械损伤处理均加速了香蕉果实硬度和叶绿素含量的下降;引起O2-产生速率和H2O2含量的积累,其中划伤处理组的O2-产生速率在贮藏第8 天为对照组的2.0倍,H2O2含量为对照组的2.5倍,这可能与机械伤处理抑制了果皮组织中过氧化物酶、超氧化物歧化酶、过氧化氢酶及抗坏血酸过氧化物酶活性有关;同时,3种不同机械损伤处理加速细胞膜脂过氧化的进程,造成香蕉细胞膜透性及丙二醛含量的升高,其中对照、划伤、穿刺和坠落处理组的丙二醛含量在贮藏第8 天分别是贮藏初期的3.3、3.4、5.4和7.5倍;此外,划伤和穿刺处理均可显著提高香蕉果皮中多酚氧化酶(Polyphenol Oxidase,PPO)活性(<0.01)。相关性聚类热图分析表明,H2O2含量与香蕉果实硬度、叶绿素含量和抗坏血酸过氧化物酶活性呈极显著负相关(<0.01),与超氧化物歧化酶活性呈显著负相关(<0.05);同时,多酚氧化酶活性与H2O2含量、丙二醛含量和细胞膜透性呈现极显著正相关(<0.05)。结合主成分分析可知,不同机械伤处理均可加速香蕉果皮活性氧的积累进而导致香蕉果实的衰老腐败,其中划伤处理对香蕉果皮活性氧代谢影响最大,其次是穿刺处理,坠落处理对香蕉果皮活性氧代谢影响最小。该研究阐明了香蕉果实机械伤、活性氧和贮藏品质三者的关系,并为香蕉采后不同机械伤控制提供理论依据。
储藏;主成分分析;香蕉;机械损伤;活性氧代谢;相关性分析
0 引 言
香蕉(.)是芭蕉科()的热带水果,与荔枝、木瓜和菠萝并称“岭南四大名果”[1]。香蕉果实具有丰富的营养物质,含有多种活性化合物,如酚类、胺类和植物甾醇,在人体中具有潜在的免疫调节功能[2]。中国是香蕉生产消费大国,2020年香蕉种植面积及产量位居世界第二,香蕉产业已成为支撑广西、海南和云南等地区乡村振兴的重要产业[3]。然而,香蕉是典型的呼吸跃变型水果,采后作业包括田间采摘、田间运输、卸货、包装和销售,在此过程中香蕉极易受到机械损伤,导致采后果实品质劣变而失去商品价值[4]。
果蔬机械损伤是指果蔬在采收、包装、运输和销售环节中因受到跌落、划伤、振动、挤压、刺伤等作用而引起的果蔬破损等伤害,也包括果蔬在加工过程中受到的鲜切等损伤[5]。研究表明,划伤处理可以增强香蕉果实呼吸强度并促进乙烯的生物合成,刺激-淀粉酶、-淀粉酶和葡萄糖苷酶活性,加快香蕉果实淀粉等营养物质的流失,缩短了果实的储藏期[6]。Fernando等[7]通过长途运输香蕉果实试验,分析了运输振动与香蕉机械损伤的关系,发现香蕉果实的损伤水平与列车振动刺激的均方根(Root-Mean- Square,RMS)加速度密切相关;运输过程中振动频率越高,水果质量越差。Costa等[8]研究表明,坠落产生的冲击损伤可以导致香蕉果实组织软化,加速果实腐败变质。Li等[9]研究发现,穿刺损伤可以诱导香蕉磷脂酶D(Phospholipase D,PLD)活性上升,以应对果实的伤害胁迫。
已有研究表明,机械损伤会破坏紫甘蓝[10]、马铃薯[11]、青椒[12]和梨[13]等果蔬组织细胞氧化还原动态平衡,缩短其储藏期。而目前,国内外学者对香蕉果实的研究主要集中在其品质上,关于机械伤对香蕉果皮活性氧代谢的研究未见报道,不同机械伤对香蕉果皮活性氧代谢的差异性也不确定。因此,本试验人工模拟划伤、穿刺、坠落3种不同机械伤处理采后香蕉果实,研究机械伤处理对香蕉果皮活性氧代谢的影响,以期为香蕉采后不同机械伤控制提供依据。
1 材料与方法
1.1 材料与试剂
主要材料:本项目试验材料香蕉品种选取广西主栽的“桂蕉6号”,采摘自广西贺州农科院,采收成熟度为7~8成熟,无机械伤、无病害的香蕉果实,当天运回实验室进行处理。
主要试剂:咪鲜胺,江苏辉丰生物农业股份有限公司;乙烯利,上海华谊集团华原化工有限公司;其余试验所用化学试剂均为国产分析纯。
1.2 仪器与设备
Centrifuge 5804R高速冷冻离心机长沙湘锐离心机有限公司;TA-300W质构仪杭州陆恒生物科技有限公司;DDS-11A电导仪上海一恒科学仪器有限公司;UV-1780紫外-可见分光光度计岛津仪器有限公司。
1.3 试验方法
1.3.1 样品处理
样品处理:选取成熟度一致、大小均一、无机械损伤、冻伤的香蕉果实,用0.1%咪鲜胺浸泡3 min进行杀菌处理,捞出后自然晾干。再用0.1 g/L的乙烯利溶液浸泡3 min,捞出后自然晾干。
对照处理:不做任何机械伤害。
穿刺处理参考Li等[9]的方法:用直径3 mm的灭菌竹签对香蕉进行穿刺伤处理,将每个香蕉从头至尾穿两排孔,每排孔位5个,深度5 mm作为穿刺伤。
坠落处理参考洪伟荣等[14]的方法,略作修改:将香蕉从80 cm的高处跌落作为坠落伤;
划伤处理参考邓红军等[15]的方法,略作修改:用小刀对香蕉皮进行划伤处理,香蕉每面划3刀,伤口长控制在3.5~4 cm,深约5 mm作为划伤。
样品晾干后装进聚乙烯袋(厚度为0.06 mm)密封,每个处理7根香蕉,设置3个对照,置于温度为(25 ± 1) ℃、相对湿度为(80 ± 5)%条件下贮藏8 d。
取样:划伤处理是以划伤线为中心,左右各1 cm长方形区域进行取样;穿刺处理是以穿刺点为中心,2 cm×2 cm正方形区域进行取样;坠落处理是以坠落面2 cm×10 cm长方形区域进行取样;对照组是以2 cm×10 cm长方形区域进行取样。每隔2 d取样一次,样品经液氮打磨成粉,存于-80 ℃低温冰箱。
1.3.2 硬度
硬度参考Chen等[4]的方法,采用质构仪测定。质构仪模式为TPA,探针为直径2 mm的圆柱形探头P2。测试参数:测前速率1 mm/s,测试速率1 mm/s,测后速率1 mm/s,压缩深度为10 mm。每次随机取3根香蕉,每根香蕉在机械伤处理面选取3个点,结果取平均值,单位为N/cm2。
1.3.3 细胞膜透过性的测定
参考Zhang等[16]的方法,略作改动。用打孔器(直径8 mm)随机取香蕉果皮圆片10片,用去离子水清洗后置于50 mL离心管中,加入30 mL蒸馏水,室温放置摇床上震荡1 h,用电导仪测定电导率1;然后煮沸20 min,降至室温,再用电导仪测定溶液电导率2。相对电导率计算如式(1)。

1.3.4 丙二醛(Malondialdehyde,MDA)含量的测定
参考Wang等[17]的方法,采用硫代巴比妥酸法(Thiobarbituric Acid,TBA)比色法,并略作改动。称取1.0 g香蕉果皮粉加入8 mL浓度10%三氯乙酸预冷溶液旋涡振荡30 s,冰水浴静止提取10 min,4 ℃下12 000 r/min离心20 min。取上清液2 mL,加入2 mL的TBA溶液置于沸水浴中加热20 min,取出后迅速降温。5 000 r/min离心后取上清液,测定其532、600和450 nm处吸光度,重复3次。MDA含量计算公式(2)
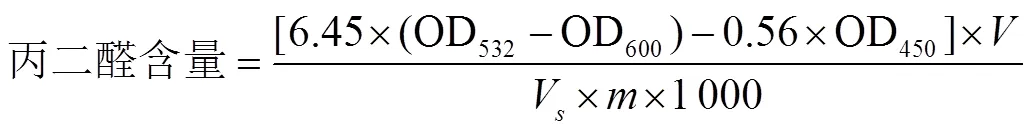
式中代表提取液总体积,mL;V代表测定时所取样品提取液体积,mL;代表样品质量,g。
1.3.5 叶绿素含量测定
参考Satekge等[18]的方法,略作修改。称取1.0 g香蕉果皮置于研钵中,加入3 mL 80%丙酮溶液研磨成匀浆,再加入8 mL 80%丙酮溶液继续研磨至组织变白后过滤。用80%丙酮溶液定容至50 mL,在645和663 nm处测定其吸光度,重复3次。叶绿素含量计算公式为
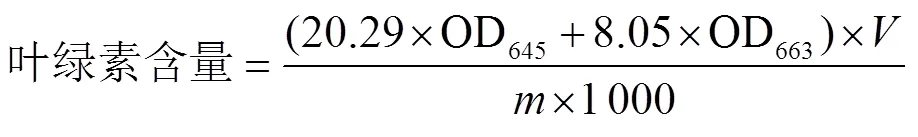
1.3.6 多酚氧化酶(Polyphenol Oxidase,PPO)和过氧化物酶(Peroxidase,POD)活性的测定
多酚氧化酶(PPO)活性测定方法参考林河通等[19]的方法,略作修改。称取1.0 g香蕉果皮粉加入8 mL 0.1 mol/L,PH性 5.5乙酸-乙酸钠缓冲液(含1%曲拉通 X-100、1 mmol/L 甲氧基聚乙二醇和4 log/L聚乙烯吡咯烷酮)旋涡振荡30 s,冰水浴静止提取10 min,4 ℃下12 000 r/min离心30 min,收集上清液。
PPO活性反应体系:0.1 mL上清液加入2.9 mL 0.1 mol/L邻苯二酚溶液,在420 nm处测定吸光度,以每分钟吸光值变化 0.001 为一个酶活力单位。
POD活性反应体系:0.2 mL上清液加入2.8 mL 25 mmol/L愈创木酚溶液和0.1 mL 0.5 mol/L H2O2溶液,在470 nm处测定吸光度,以每分钟吸光值变化0.01为一个活性单位。
1.3.7 超氧化物歧化酶(Superoxide Dismutase,SOD)、过氧化氢酶(Catalase,CAT)和抗坏血酸过氧化物酶(Ascorbate Peroxidase,APX)活性的测定
SOD活性的测定参考Chen等[20]的方法,采用氮蓝四唑光还原法。CAT活性的测定参考Lin[21]等的方法。APX活性的测定参考Nakano等[22]的方法。
1.3.8 超氧阴离子(O2-)产生速率和过氧化氢(H2O2)含量的测定
O2-产生速率和H2O2含量的测定参考Wang[23]等的方法。
1.4 数据处理与分析
用Excel 2010进行数据处理,SPSS19.0软件进行相关性分析、显著性分析和主成分分析,Origin 2021和TBtools软件绘图。试验结果取3次测定平均值。
2 结果与分析
2.1 不同机械伤处理对香蕉果实硬度、绿叶素含量和果实外观的影响
果实硬度是判断香蕉果实采后成熟和衰老的重要指标之一[7]。如图1a所示,随贮藏时间的延长,各处理组的香蕉果实硬度均呈下降趋势。在储藏第4、6 天,划伤处理组的香蕉果实硬度显著低于对照组(<0.05)。
叶绿素含量是判断果蔬成熟度的重要标志之一[24],随着香蕉果实的成熟衰老,其果皮中叶绿素含量会被降解,逐渐显现出商品黄色。如图1b所示,在整个贮藏期间,不同机械伤处理组和对照组的香蕉果皮中叶绿素含量整体呈现下降趋势,且在贮藏中后期经机械伤处理组的叶绿素含量显著低于对照组(<0.05)。由此可知,划伤处理能显著加速香蕉果皮的叶绿素降解。
图1c展示了对照和不同机械伤处理对香蕉果实外观变化的的影响,由图可知不同机械伤处理均能加速香蕉果实的成熟衰老。


a. 果实硬度a. Fruit hardnessb. 叶绿素含量b. Chlorophyll contentc. 果实外观c. Fruit appearance
注:不同小写字母表示在相同货架期处理间差异显著(< 0.05),下同。
Note: Different lowercase letters indicate significant differences between treatments with the same shelf life (< 0.05), the same below.
图1 不同机械伤处理对香蕉果实硬度、绿叶素含量和果实外观的影响
Fig.1 Effects of different mechanical injury treatments on fruit hardness, chlorophyll content and fruit appearance of banana
2.2 不同机械伤处理对香蕉细胞膜透性和丙二醛(MDA)含量的影响
细胞膜透性和MDA含量可以衡量果实细胞膜的完整性,反应机械伤处理对香蕉果皮组织膜脂过氧化的情况[25]。如图2a所示,随着贮藏时间的延长,不同机械伤处理组和对照组香蕉细胞膜透性的变化一致,整体呈现上升趋势。在整个贮藏期间,不同机械伤处理组的细胞膜透性均高于对照组,在储藏6 d后,穿刺和划伤处理组的细胞膜透性显著高于对照组(<0.05),而坠落处理组的细胞膜透性与对照组无显著性差异(>0.05)。由此可知,不同机械伤处理均可引起香蕉果皮细胞膜透性显著升高(<0.05),其中划伤处理对香蕉果皮细胞膜透性影响最大。
如图2b所示,香蕉果皮的MDA含量和细胞膜透性变化趋势基本一致。在整个贮藏期间,对照和坠落处理组香蕉果皮的MDA含量呈缓慢上升趋势,而划伤和穿刺处理组的MDA含量在贮藏第4 天急剧升高达到6.78和7.12mol/g。在贮藏第8 天,对照、坠落、穿刺和划伤处理组的MDA含量分别是贮藏初期的3.3、3.4、5.4和7.5倍。由此可知,不同机械伤均可引起香蕉果皮MDA含量的大量积累,划伤处理对香蕉果皮MDA含量影响最大。
2.3 不同机械伤处理对香蕉果皮活性氧含量的影响
超氧阴离子自由基(O2-)和H2O2含量是在遭受外界逆境胁迫下,果蔬生理代谢失衡产生的活性氧,是评价采后果蔬活性氧代谢的重要指标[26]。如图2c所示,随着贮藏时间的延长,香蕉果皮中H2O2含量呈上升趋势。在整个贮藏期间,划伤处理组的H2O2含量显著高于对照组(<0.05),而穿刺和坠落处理组的H2O2含量与对照组无显著性差异(>0.05)。在贮藏第8 天,划伤处理组的H2O2含量达到最高值,为67.9 mmol/g,分别是对照、坠落和穿刺处理组的2.0、1.8和2.5倍。由此可知,划伤处理可以显著提高香蕉果皮中H2O2含量的积累(<0.05)。
如图2d所示,各处理组的香蕉果皮中O2-产生速率随着贮藏时间的延长而升高。在整个贮藏期间,划伤和穿刺处理组的O2-产生速率显著高于对照组和坠落处理组(<0.05),且划伤和穿刺处理组的O2-产生速率也呈现显著差异性(<0.05)。由此可知,划伤和穿刺处理均可显著提高香蕉果皮中O2-产生速率,其中划伤处理对香蕉果皮中O2-产生速率影响最大,第8天为对照组的2.5倍。
2.4 不同机械伤处理对香蕉果皮PPO活性的影响
PPO是酶促褐变途径中的关键酶,能催化酚类化合物转化为邻苯二酚,在有氧的条件下又将其氧化成醌类化合物,以抵抗病原菌的侵害[27]。如图3所示,随着贮藏时间的延长,划伤和穿刺处理组的香蕉果皮中PPO活性整体呈现上升趋势,而对照和坠落处理组的PPO活性则趋于平稳。在整个贮藏期间,划伤和穿刺处理组的PPO活性显著高于对照和坠落处理组(<0.05),由此可知,与坠落处理组相比,划伤和穿刺处理均可显著影响香蕉果皮中PPO活性的变化(<0.05)。
2.5 不同机械伤处理对香蕉果皮抗氧化酶活性的影响
SOD、CAT、APX和POD均是植物组织中重要的抗氧化酶,在维持ROS动态平衡中发挥重要作用[28]。其中SOD可以催化超氧阴离子生成歧化产物H2O2,H2O2在CAT的存在迅速还原成H2O和O2;而APX参与抗坏血酸-谷胱甘肽循环,可以通过调节抗坏血酸来清除过量的H2O2;POD则可以水解H2O2,起到保护细胞的作用[29]。
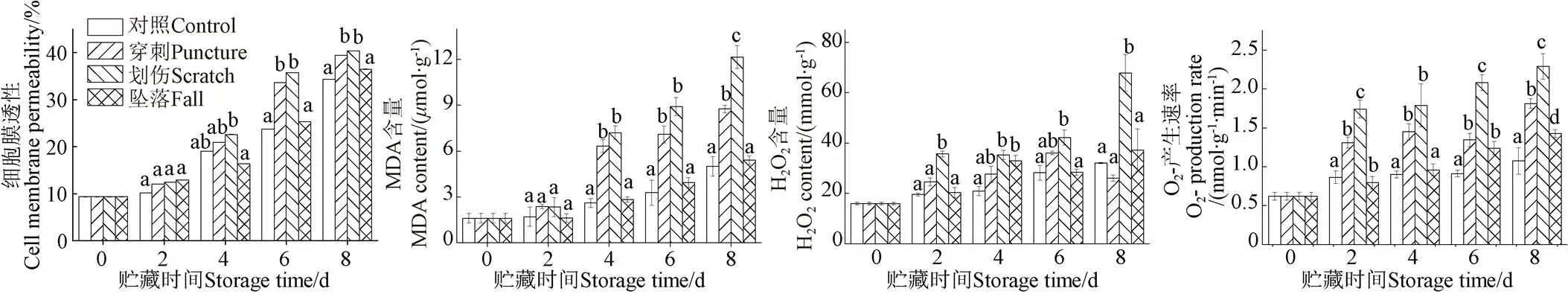
a. 细胞膜透性a. Cell membrane permeabilityb. MDA含量b. MDA contentc. H2O2含量c. H2O2 contentd. O2-产生速率d. O2- production rate

图3 不同机械伤处理香蕉Polyphenol Oxidase(PPO)活性的影响
如图4a所示,在整个贮藏期间,对照组香蕉果皮的SOD活性呈先下降后上升的趋势,而不同机械伤处理组的SOD活性整体呈下降趋势。机械伤处理显著抑制了香蕉果皮的SOD活性(<0.05),在第贮藏4 d划伤处理组的SOD活性达到最低值,仅为1.001 U/g。在贮藏第8 天,对照组的SOD活性为5.35 U/g,显著高于机械伤处理组(<0.05),机械伤处理组的SOD活性排序依次为划伤组、坠落组、穿刺组。
如图4b所示,随着贮藏时间的延长,香蕉果皮的CAT活性呈现先上升后下降再上升的趋势,对照组的CAT活性显著高于不同机械伤处理组(<0.05)。在贮藏第6 天,对照组和机械伤处理组的CAT活性达到最低值,其中,划伤处理的CAT活性最低,显著低于对照组和其他机械伤处理组(<0.05)。
如图4c所示,对照组香蕉果皮的APX活性呈先下降后上升趋势,而机械伤处理组的APX活性则呈下降趋势。在整个贮藏期间,对照组的APX活性显著高于机械伤处理组(<0.05);且在不同机械伤处理中,坠落处理组的APX活性显著高于划伤和穿刺处理组(<0.05)。机械伤处理能显著抑制香蕉果皮中APX的活性(<0.05),在贮藏第8 天,划伤处理组的APX活性达到最低值,仅为40.8 U/g。
如图4d所示,在整个贮藏期间,对照组的POD活性显著高于划伤处理组(<0.05),对照组的POD活性整体呈上升趋势,而不同机械伤处理组的POD活性则呈现先下降后上升的趋势。在贮藏第8 天,对照组的POD活性为123.84 U/g,划伤处理组的POD活性最低,为94.72 U/g,对照组的POD活性是划伤处理组的1.3倍。
综上可知,不同机械伤处理均在一定程度上抑制了香蕉果皮的抗氧化酶活性,其中,划伤处理对香蕉果皮抗氧化酶活性的影响最大。
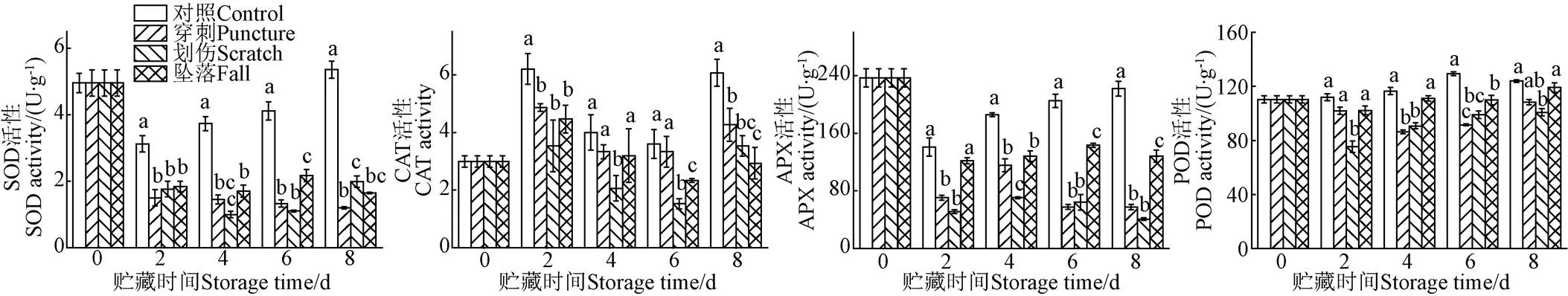
a. SOD活性a. SOD activityb. CAT活性b. CAT activityc. APX活性c. APX activityd. POD活性d. POD activity
2.6 相关性聚类热图分析
相关性聚类热图分析表明,O2-产生速率、H2O2含量、MDA含量和细胞膜透性指标与硬度、叶绿素含量、SOD活性和APX活性指标间相互呈负相关。其中,H2O2含量与香蕉果实硬度、叶绿素含量和APX活性呈极显著负相关(<0.01),相关性系数为-0.67、-0.87、-0.66,与SOD活性呈显著负相关(<0.05),相关性系数为-0.52,这与随着ROS的积累,果实硬度、叶绿素含量等贮藏品质逐渐下降一致。这也表明ROS的富集可能会影响果实软化和叶绿素降解,且在本实验中CAT、SOD、APX和POD并未响应机械伤所带来的活性氧胁迫。通过相关性聚类热图分析还可以发现,贮藏时间、O2-产生速率、H2O2含量、PPO活性、MDA含量和细胞膜透性指标间相互呈正相关,这与随着贮藏时间的延长,不同处理组O2-产生速率、H2O2含量、MDA含量和细胞膜透性逐渐上升一致。值得注意的是,PPO活性与H2O2含量、MDA含量和细胞膜透性呈现极显著正相关(<0.05),相关性系数分别为0.61、0.82、0.60,这表明PPO可能通过响应ROS胁迫,间接参与了机械伤胁迫。
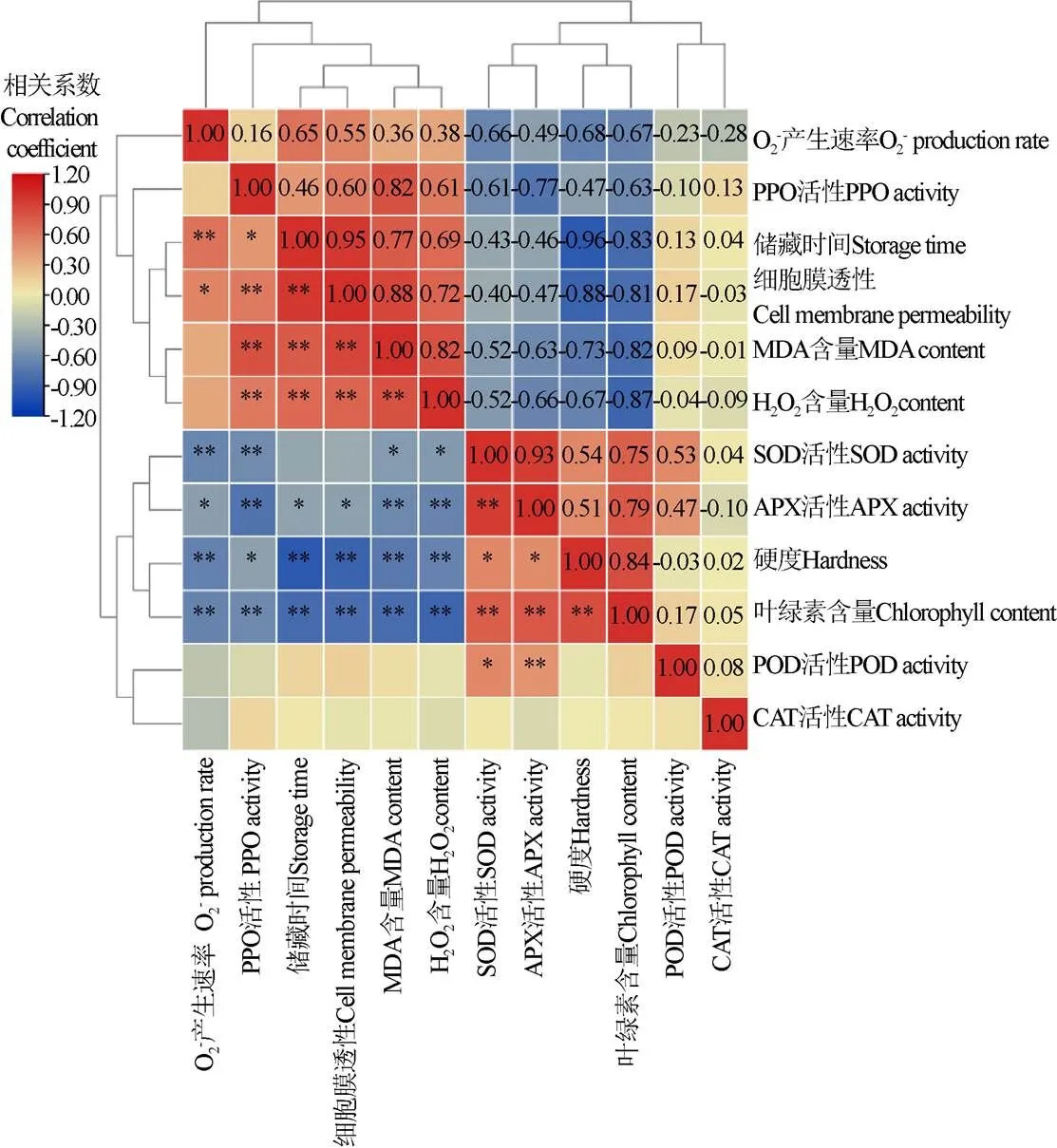
注:红色和蓝色分别表示研究参数之间的正相关和负相关;*代表在P<0.05水平上显著相关,**代表在P<0.01 水平上极显著相关。
2.7 主成分分析
对不同机械伤处理香蕉贮藏过程中果皮活性氧代谢指标标准化后进行主成分分析,第1、2、3主成分特征值分别为6.25、1.71、1.31,第1、2、3主成分贡献率分别为56.82%、15.546%、11.977%,前3个主成分特征值均大于1,且积累贡献率达到84.343%,由此可知前3个主成分可以说明不同机械伤处理的香蕉在贮藏期间果皮活性氧代谢等指标的有关数据的变化趋势,完全符合主成分分析的要求。因此取前3个主成分FAC(1~3)进行分析,得出式(4)~(6),其中FAC1、FAC2、FAC3分别代表第1、2、3主成分得分;1~11为标准化变量,且依次代表果实硬度、叶绿素含量、细胞膜透过性、MDA含量、O2-产生速率、H2O2含量、PPO、POD、SOD、CAT和APX。



由因子载荷图6可知,细胞膜透过性、MDA含量、O2-产生速率和H2O2含量聚集在 PC1(56.82%)正轴上,果实硬度、叶绿素含量、POD、SOD、CAT和APX聚集在PC1(56.82%)负轴上,表明PC1(56.82%)越大,ROS积累量和膜脂过氧化程度越高,故定义PC1为氧化损伤指标;POD、SOD、CAT和APX聚集在PC2(15.564%)正轴上,果实硬度和叶绿素含量聚集在 PC2(15.564%)负轴上,表明PC2(15.564%)越高,抗氧化能力越高,故定义PC2为抗氧化指标;同时CAT和POD聚集在PC3(11.977%)正轴上,表明 PC3(11.977%)越高,抗氧化能力越高,因此PC3(11.977%)也定义为抗氧化指标。

图6 不同机械伤处理香蕉在储藏过程中各指标主成分分析因子载荷图
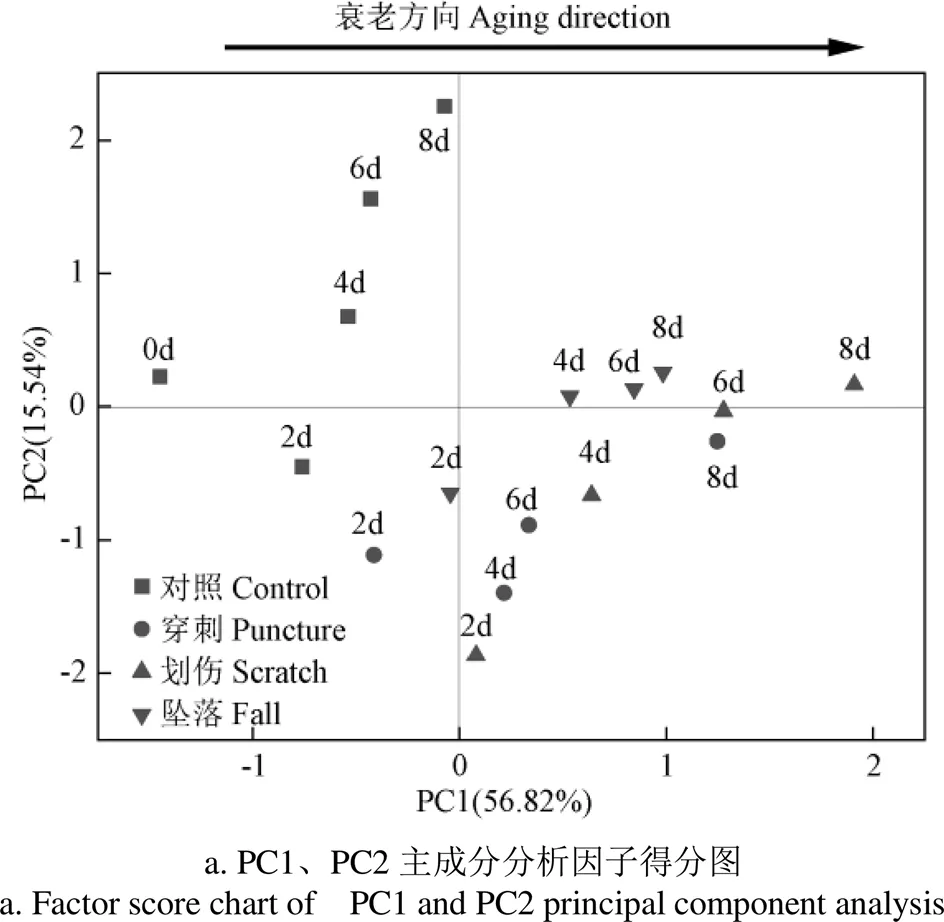
由因子得分图7可知,各处理组的得分沿PC1(56.82%)从负轴到正轴,这与PC1定义为氧化损伤指标相吻合。意味着随贮藏时间的延长,香蕉果皮组织中细胞膜透过性、MDA含量、O2-产生速率和H2O2含量上升,其果皮组织中的ROS积累和膜脂过氧化程度加剧,严重破坏了细胞氧化还原动态平衡,导致香蕉果实衰老腐败。结合图6因子载荷图和因子得分情况可知,在贮藏第8 天,对照组的氧化损伤程度较轻,ROS含量和膜脂过氧化程度较低;不同机械伤处理组的氧化损伤较严重,ROS含量和膜脂过氧化程度较高。其中,划伤处理对香蕉果皮活性氧代谢的影响最大,其次是穿刺处理,坠落处理对香蕉果皮活性氧代谢的影响最小。
3 讨 论
香蕉采摘和运输过程中,极易遭到机械损伤,不仅影响美观也会作为病原中心进一步感染正常果实,造成二次侵染,给果实的贮运带来巨大的损失[5]。为了能减少机械伤带来的损害,陆丹等人通过抹花、疏果、垫把及套袋等技术,发现可以有效减少香蕉机械伤的发生,显著提高香蕉产品质量和商品档次[30]。但目前关于香蕉机械伤的研究主要集中于控制机械伤的发生,而从机理层面却鲜有报道。因此本实验分别采用划伤、穿刺和坠落3种不同的处理方法来探究机械伤对采后香蕉贮藏品质和活性氧代谢的影响,以期来解析机械伤、活性氧和贮藏品质三者的关系及可能机理。
在本研究中,机械伤处理加速香蕉果实硬度的下降,这与机械伤处理导致番茄[31]、猕猴桃[32]软化研究结果一致。机械损伤和果实硬度之间的关系还不太清楚,但Lu等[33]认为机械损伤促进了细胞壁降解酶活性的上升,导致细胞壁降解;同时,机械伤诱导了乙烯的大量生成造成果蔬软化。叶绿素的降解标志着香蕉果实的成熟衰老。随着果实衰老进程的进展,叶绿素会降解成无色产物,从而使果皮褪绿。在贮藏第6、8 d,划伤处理组的果皮叶绿素含量显著低于对照组(<0.05),机械伤处理加速了香蕉果皮叶绿素的降解,主要是因为机械伤破坏了果皮组织细胞膜的稳定性并抑制了其抗氧化活性,这与机械伤处理的青椒[12]结果一致。
ROS的积累与果实衰老和膜脂过氧化密切相关,ROS是植物正常代谢的产物,若果蔬清除自由基的能力下降或大量积累则会对果蔬细胞膜产生伤害,加速果蔬的衰老[34]。ROS以不饱和膜脂脂肪酸侧链为靶标,启动氧化连锁反应,导致膜脂过氧化[35]。细胞膜透过性和MDA含量是细胞膜脂过氧化的重要指标,它们的变化反应细胞膜受氧化损伤的程度。在本研究中,采后香蕉果实仍作为一个活体进行活性氧代谢,机械损伤显著提高香蕉果皮超氧阴离子产生速率和H2O2含量(<0.05),严重破坏了香蕉果实的组织结构和抗逆系统,引起香蕉果实细胞膜透性增大,加剧果皮膜脂过氧化,MDA含量上升。这在鲜切紫甘蓝[10]、马铃薯[11]和机械伤猕猴桃[32]中也有类似发现。
以往大量的研究表明,抗氧化酶体系可以响应各种生物和非生物胁迫以及时清除ROS,进而维持体内ROS的动态平衡,减少ROS带来的损伤[34]。但是本试验中,POD、SOD、CAT和APX等抗氧化酶在受到机械伤胁迫后,酶活性并没有显著提升,反而低于对照组,究其原因可能是划伤、穿刺和坠落3种处理均是短期非持续作用于香蕉,其中划伤处理组的过氧化物酶、超氧化物歧化酶、过氧化氢酶和抗坏血酸过氧化物酶活性在储藏第8天仅为对照组的81.33%、37.47%、57.3%和18.09%;3种不同机械伤处理均可降低果实抗氧化能力,造成活性氧大量积累,破坏其细胞氧化还原动态平衡。因此POD、SOD、CAT和APX等抗氧化酶也可能仅仅在前期(处理后数小时内)响应了机械伤带来的胁迫,后期(2 d以后)由于机械伤造成细胞死亡、蛋白质变形等原因导致酶活性下降,这与杨曼等人在刺梨结果一致[13]。因此基于本试验和Wu等在百合花研究[36]来看,研究香蕉ROS对机械伤的胁迫反应最佳时间不晚于2 d。
通过相关性聚类热图发现,H2O2含量与PPO活性呈现极显著正相关(<0.05),而与APX和SOD活性呈显著负相关(<0.05),这表明PPO可能通过响应ROS胁迫,间接参与了机械伤胁迫,而CAT、SOD、APX和POD并未响应机械伤所带来的ROS胁迫。结合不同机械伤处理对香蕉果皮PPO活性的影响结果来看,可能是划伤和穿刺均会造成果皮出现伤口,进而利于了病原菌侵染,而PPO活性的高表达可能是香蕉对于病原菌侵染胁迫而做出了一种胁迫响应[37],这也就解释了为什么坠落并没有引起PPO活性的上升。
本试验为了进一步探究划伤、穿刺和坠落3种处理方法对香蕉贮藏品质影响的大小及差异性,对所有指标进行了主成分分析,发现划伤处理对香蕉果皮活性氧代谢影响最大,其次是穿刺处理,坠落处理对香蕉果皮活性氧代谢影响最小。这为以后香蕉机械伤探究提供了理论基础。
4 结 论
1)穿刺、划伤、坠落3种不同机械伤处理均可加速香蕉果实硬度和叶绿素含量下降,破坏细胞膜结构,造成细胞膜透性和丙二醛含量上升,加速香蕉果实品质劣变;同时,穿刺、划伤、坠落3种不同机械伤处理均可显著抑制香蕉果皮过氧化物酶、超氧化物歧化酶、过氧化氢酶和抗坏血酸过氧化物酶等抗氧化酶活性(<0.05),其中划伤处理组的过氧化物酶、超氧化物歧化酶、过氧化氢酶和抗坏血酸过氧化物酶活性在储藏第8天仅为对照组的81.33%、37.47%、57.3%和18.09%;3种不同机械伤处理均可降低果实抗氧化能力,造成活性氧大量积累,破坏其细胞氧化还原动态平衡。
2)通过相关性聚类热图分析表明,H2O2含量与香蕉果实硬度、叶绿素含量和抗坏血酸过氧化物酶活性呈极显著负相关(<0.01),与超氧化物歧化酶活性呈显著负相关(<0.05);同时,多酚氧化酶活性与H2O2含量、丙二醛含量和细胞膜透性呈现极显著正相关(<0.05)。
3)通过主成分分析发现,不同机械伤处理均可加速香蕉果皮活性氧的积累进而导致香蕉果实的衰老腐败,其中划伤处理对香蕉果皮活性氧代谢影响最大,其次是穿刺处理,坠落处理对香蕉果皮活性氧代谢影响最小。
[1] Guo J, Fu H, Zhou Y, et al. Research on the physical characteristic parameters of banana bunches for the design and development of postharvesting machinery and equipment[J]. Agriculture, 2021, 11(4): 362.
[2] Tânia M S, Nicholas C C, Franco M A, et al. Two banana cultivars differ in composition of potentially immunomodulatory mannan and arabinogalactan[J]. Carbohydrate Polymers, 2017, 164: 31-41.
[3] 王芳,谢江辉. 我国香蕉产业“十三五”回顾与“十四五”展望[J]. 中国热带农业,2022(3):15-22.
Wang Fang, Xie Jianghui. Review of Chinese banana industry during the 13th five-year plan period and outlook of this industry during the 14th five-year plan period[J]. Tropical Agriculture in China, 2022(3): 15-22. (in Chinese with English abstract)
[4] Chen J, Li F F, Li Y X, et al. Exogenous procyanidin treatment delays senescence of harvested banana fruit by enhancing antioxidant responses and in vivo procyanidin content[J]. Postharvest Biology and Technology, 2019, 158: 110999.
[5] 王敏,关博洋,殷菲胧,等. 果蔬机械损伤的生理及分子机制研究进展[J]. 食品研究与开发,2022,43(9):205-211.
Wang Min, Guan Boyang, Yin Feilong, et al. Advances in research on physiological and molecular mechanisms of mechanical damage of fruits and vegetables[J] Food Research and Development, 2022, 43(9): 205-211. (in Chinese with English abstract)
[6] Maia V M, Salomo L C C, Siqueira D L, et al. Physical and metabolic changes induced by mechanical damage in ‘dwarf-prata’ banana fruits kept under cold storage[J]. Australian Journal of Crop Science, 2014, 8(7): 1029-1037.
[7] Fernando I, Fei J, Stanley R. Measurement and analysis of vibration and mechanical damage to bananas during long-distance interstate transport by multi-trailer road trains[J]. Postharvest Biology and Technology, 2019, 158: 110977.
[8] Costa F, Puschmann R, Moreira S, et al. Survey of mechanical injury in ‘prata anã’ banana during shipping[J]. Revista Verde de Agroecologia e Desenvolvimento Sustentável, 2010, 5(1): 72-78.
[9] Li L, He X M, Sun J, et al. Responses of phospholipase D and antioxidant system to mechanical wounding in postharvest banana fruits[J]. Journal of Food Quality, 2017, (2017): 1-8.
[10] 姜爱丽,胡文忠,张维娜,等. 异硫氰酸烯丙酯处理对鲜切紫甘蓝生理代谢的影响[J]. 食品科学,2018,39(3):252-258.
Jiang Aili, Hu Wenzhong, Zhang Weina, et al. Effect of allyl isothiocyanate treatment on physiological metabolism of fresh-cut purple cabbage[J]. Food Science, 2018, 39(3): 252-258. (in Chinese with English abstract)
[11] Hu W Z, Guan Y G, Ji Y R, et al. Effect of cutting styles on quality, antioxidant activity, membrane lipid peroxidation, and browning in fresh-cut potatoes[J]. Food Bioscience, 2021, 44: 101435.
[12] 王云香,顾思彤,左进华,等. 腐胺对机械伤青椒果实生理品质和抗氧化能力的影响[J]. 食品工业科技,2019,40(5):259-263.
Wang Yunxiang, Gu Sitong, Zuo Jinhua, et al. Effects of putrescine on physiological quality and antioxidant capacity of mechanically injured green bell pepper[J]. Food Industry Technology, 2019, 40(5): 259-263. (in Chinese with English abstract)
[13] 杨曼,安华明,黄伟,等. 刺梨果实主要抗氧化组分对机械伤及UV-B胁迫的响应[J]. 园艺学报,2012,39(4):629-636.
Yang Man, An Huaming, Huang Wei, et al. Response of main antioxidant compositions to mechanical wounding and UV-B stress in rosa roxburghii Fruit[J]. Journal of Horticulture, 2012, 39(4): 629-636. (in Chinese with English abstract)
[14] 洪伟荣,王璇,刘馨岚,等. 1-MCP预处理对采后猕猴桃机械损伤导致品质变化的影响[J]. 保鲜与加工,2021,21(2):7-12.
Hong Weirong, Wang Xuan, Liu Xinlan, et al. Effect of 1-MCP pretreatment on kiwifruit quality changes caused by mechanical damage after harvest[J]. Storage and Process, 2021, 21(2): 7-12. (in Chinese with English abstract)
[15] 邓红军,陈小红,李萍,等. 1-MCP处理对采后机械损伤黄瓜生理生化特性的影响[J]. 食品工业科技,2013,34(9):332-335.
Deng Hongjun, Chen Xiaohong, Li Ping, et al. Effect of 1-methylcyclopropene treatments on physiological and chemical characteristics of cucumber fruits suffered mechanical damage during postharvest[J]. Food Industry Technology, 2013, 34(9): 332-335. (in Chinese with English abstract)
[16] Zhang Z, Zhu Q, Hu M, et al. Low-temperature conditioning induces chilling tolerance in stored mango fruit[J]. Food Chemistry, 2017, 219: 76-84.
[17] Wang Z Q, Pu H L, Shan S S, et al. Melatonin enhanced chilling tolerance and alleviated peel browning of banana fruit under low temperature storage[J]. Postharvest Biology and Technology, 2021, 179: 111571-11586.
[18] Satekge T K , Magwaza L S. The combined effect of 1-methylcyclopropene (1-MCP) and ethylene on green-life and postharvest quality of banana fruit[J]. International Journal of Fruit Science, 2020, 124(7): 1029-1037.
[19] 林河通,席玙芳,陈绍军. 龙眼果实采后失水果皮褐变与活性氧及酚类代谢的关系[J]. 植物生理与分子生物学学报,2005,31(3):287-297.
Lin Hetong, Xi Yufang, Chen Shaojun. Relationship between pericarp browning and active oxygen and phenol metabolism in longan fruit after postharvest dehydration[J]. Journal of Plant Physiology and Molecular Biology, 2005, 31(3): 287-297. (in Chinese with English abstract)
[20] Chen L L, Shan W, Cai D L, et al. Postharvest application of glycine betaine ameliorates chilling injury in cold-stored banana fruit by enhancing antioxidant system[J]. Scientia Horticulturae, 2021, 287: 110264.
[21] Lin Y F, Lin H T, Zhang S, et al. The role of active oxygen metabolism in hydrogen peroxide-induced pericarp browning of harvested longan fruit[J]. Postharvest Biology and Technology, 2014, 96: 42-48.
[22] Nakano Y, Asada K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J]. Plant and Cell Physiology, 1981, 22(5): 867-880.
[23] Wang Z Q, Pu H L, Shan S S, et al. Melatonin enhanced chilling tolerance and alleviated peel browning of banana fruit under low temperature storage[J]. Postharvest Biology and Technology, 2021, 179: 111571-111583.
[24] Tiecher A, Paula L, Chaves F C, et al. UV-C effect on ethylene, polyamines and the regulation of tomato fruit ripening[J]. Postharvest Biology & Technology, 2013, 86(4): 230-239.
[25] Jiménez M R, Rallo P, Rapoport H F, et al. Distribution and timing of cell damage associated with olive fruit bruising and its use in analyzing susceptibility[J]. Postharvest Biology and Technology, 2016, 111: 117-125.
[26] Jiang L, Yang H. Prometryne-induced oxidative stress and impact on antioxidant enzymes in wheat[J]. Ecotoxicol Environ Saf, 2009, 72(6): 1687-1693.
[27] Win Y L, Chen W W. Inhibitory effect of chemical and natural anti-browning agents on polyphenol oxidase from ginger [J]. Journal of Food Science and Technology, 2018, 55(8): 3001-3007.
[28] Vinayak D, Homa F, Tokala V Y, et al. Regulation of pericarp browning in cold-stored litchi fruit using methyl jasmonate[J]. Journal of King Saud University - Science, 2021, 33(5): 101445-101458.
[29] Gu S T, Xu D Y, Zhou F H, et al. Repairing ability and mechanism of methyl jasmonate and salicylic acid on mechanically damaged sweet cherries[J]. Scientia Horticulturae, 2022, 292: 11052-11064.
[30] 陆丹,刘厚铭,欧桂兰,等. 香蕉抹花、疏果、垫把及套袋技术在南宁市的应用研究[J]. 南方农业学报,2012,43(12):2020-2024.
Lu Dan, Liu Houming, Ou Giulan, et al. Applied research on flower-wiping, fruit-thinning, fruit-padding, and fruit-bagging techniques of banana[J]. Journal of Southern Agriculture, 2012, 43(12): 2020-2024. (in Chinese with English abstract)
[31] 刘瑶,左进华,郑秋丽,等. 氯化钙对机械伤番茄果实生理特性的影响[J]. 食品工业科技,2020,41(3):264-269.
Liu Yao, Zuo Jinhua, Deng Qiuli, et al. Effect of CaCl2treatment on physiology characteristics of tomatoes with mechanical damage[J]. Food Industry Technology, 2020, 41(3): 264-269. (in Chinese with English abstract)
[32] Wei X P, Xie D D, Mao L M, et al. Excess water loss induced by simulated transport vibration in postharvest kiwifruit[J]. Scientia Horticulturae, 2019, 250: 113-120.
[33] Lu F, Xu F X, Li Z, et al. Effect of vibration on storage quality and ethylene biosynthesis-related enzyme genes expression in harvested apple fruit[J]. Scientia Horticulturae, 2019, 249: 1-6.
[34] 余经,林育钊,范中奇,等. 果蔬采后病害的发生与活性氧和膜脂代谢的关系研究进展[J]. 亚热带农业研究,2020,16(2):132-137.
Yu Jing, Lin Yuzaho, Fan Zhongqi, et al. Research progress on the relationship between disease occurrence and the metabolism of reactive oxygen species and membrane lipids in postharvest fruits and vegetables[J]. Subtropical Agriculture Research, 2020, 16(2): 132-137. (in Chinese with English abstract)
[35] Chen Y H, Hung Y C, Chen M Y, et al. Enhanced storability of blueberries by acidic electrolyzed oxidizing water application may be mediated by regulating ROS metabolism[J]. Food Chemistry, 2019, 270: 229-235.
[36] Wu Z C, Huang X M, He S G, et al. Transcriptomics profile reveals the temporal molecular events triggered by cut-wounding in stem-ends of cut ‘Tiber’ lily flowers[J]. Postharvest Biology and Technology, 2019, 156: 110950-110962.
[37] 秦国政,田世平,刘海波,等. 拮抗菌与病原菌处理对采后桃果实多酚氧化酶、过氧化物酶及苯丙氨酸解氨酶的诱导[J]. 中国农业科学,2003,36(1):89-93.
Qin Guozheng, Tian Shiping, Liu Haibo, et al. polyphenol oxidase, peroxidase and phenylalanine ammonia lyase in postharvest peach fruits Induced by inoculati on withor[J] Chinese Agricultural Science, 2003, 36(1): 89-93. (in Chinese with English abstract)
Effects of different mechanical injury treatments on the metabolism of reactive oxygen species in banana peel
Wang Min1,2, Yin Feilong1,Liang Yuanli1, Liu Yunfen1, Liao Lingyan1, Pan Zhongtian1, Shuai Liang1※
(1.,,,542899,; 2.,,116034,)
During harvesting and transportation, bananas are highly susceptible to mechanical damage, which will not only affect the aesthetics, but also act as a pathogen center to further infect normal fruits, leading to secondary infection and causing great losses to the storage and transportation of fruits. At present, the research on mechanical damage of banana mainly focuses on controlling the occurrence of mechanical damage, but there are fewer reports from the mechanism level. Therefore, in this experiment, three different mechanical damage treatments, including scratch, puncture and fall, were used, with untreated as the control group, and stored at (25 ± 1)°C and (80 ± 5)% RH for 8 d, with samples taken at 2 d intervals. Fruit hardness, chlorophyll content, cell membrane permeability, malondialdehyde content, reactive oxygen species content and antioxidant enzyme activities were measured to analyze the relationship between mechanical damage, reactive oxygen species and storage quality and their possible mechanisms. The results showed that the three different mechanical damage treatments accelerated the decrease of banana fruit hardness and chlorophyll content compared with the control; it inhibited the activities of Peroxidase (POD), Superoxide Dismutase (SOD), Catalase (CAT) and Ascorbate Peroxidase (APX) in banana peel, led to the accumulation of reactive oxygen species O2-and H2O2, accelerated the process of cell membrane lipid peroxidation, increased the permeability of banana cell membrane and Malondialdehyde (MDA) content, and then accelerated the deterioration of banana storage quality. The correlation clustering heat map analysis showed that O2-production rate, H2O2content, MDA content and cell membrane permeability indexes were negatively correlated with each other and hardness, chlorophyll content, SOD activity and APX activity indexes. Among them, H2O2content was negatively correlated with hardness, chlorophyll content and APX activity (< 0.01) and with SOD activity (< 0.05), which was consistent with the gradual decrease of storage quality such as hardness and chlorophyll content with the accumulation of ROS. It was speculated that ROS enrichment might affect fruit softening and chlorophyll degradation, and that CAT, SOD, APX, and POD did not respond to reactive oxygen stress caused by mechanical injury in this experiment. The correlation cluster heat map analysis also revealed that storage time, O2-production rate, H2O2content, polyphenol oxidase activity, MDA content and cell membrane permeability were positively correlated with each other, which was consistent with the gradual increase of O2-production rate, H2O2content, MDA content and cell membrane permeability in different treatment groups with the increase of storage time. Notably, polyphenol oxidase activity showed a highly significant positive correlation (< 0.05) with H2O2content, MDA content and cell membrane permeability, indicating that polyphenol oxidase may be indirectly involved in mechanical injury stress by responding to reactive oxygen stress. Combined with the principal component analysis, different mechanical injury treatments could accelerate the accumulation of reactive oxygen species in banana peel, which in turn led to the decay and spoilage of banana fruit. Among them, scratch treatment had the greatest effect on banana peel reactive oxygen metabolism, followed by puncture treatment, and falling treatment had the least effect on banana peel reactive oxygen metabolism.
storage; principal component analysis; banana; mechanical damage; active oxygen metabolism; correlation analysis
10.11975/j.issn.1002-6819.2022.16.031
S635.3
A
1002-6819(2022)-16-0284-09
王敏,殷菲胧,梁园丽,等. 不同机械伤处理对香蕉果皮活性氧代谢的影响[J]. 农业工程学报,2022,38(16):284-292.doi:10.11975/j.issn.1002-6819.2022.16.031 http://www.tcsae.org
Wang Min, Yin Feilong, Liang Yuanli, et al. Effects of different mechanical injury treatments on the metabolism of reactive oxygen species in banana peel[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2022, 38(16): 284-292. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2022.16.031 http://www.tcsae.org
2022-07-09
2022-08-10
国家自然科学基金项目(31860457);广西自然科学基金项目(2020GXNSFAA297153);广西高校中青年教师科研基础能力提升项目(2021KY0705)
王敏,研究方向为农产品贮藏与加工。Email:1031080926@qq.com
帅良,教授,研究方向为农产品贮藏与加工。Email:shuailiang1212@163.com

