定量CT联合超声心动图评价不同程度肺动脉高压慢阻肺患者小气道病变
戴钢 邓克学 胡瑞雪
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是常见的慢性气道炎症性疾病,其发生率日益增高,患者可反复急性加重,严重者需入院治疗[1]。合并肺动脉高压(Pulmonary hypertension, PH)的COPD患者往往预后相对不佳。虽然临床诊断肺动脉高压的金标准是右心导管术,但是它是一种侵入性检查方法并有一定的禁忌证和并发症。现在临床通常使用超声心动图检查替代,研究表明超声心动图可用于肺动脉压测量,并与右心导管术得出结果有高度一致性[2-3]。 近年来,一些研究采用肺部CT的气道测量分析技术,了解气道壁重塑情况,CT图像数据分析可量化与该疾病直接相关的两个主要因素,包括肺气肿程度以及小气道壁增厚、阻塞程度,即炎性粘液渗出物在气道腔内积聚导致气道壁增厚,气道管腔狭窄[4]。慢阻肺患者肺动脉压力的变化和肺气肿影像学变化的关系,尚缺乏研究。本研究探讨不同程度肺动脉收缩压慢阻肺患者肺部影像学参数改变情况及其评估患者病情严重程度的能力。
资料与方法
一、临床资料
收集中国科学技术大学附属第一医院2019年3月—2021年12月因COPD急性加重住院患者的临床资料,经过筛选纳入共计84例患者,其中男性71例(84.5%),女性13例(15.5%),年龄49~89岁,平均年龄(74.94±8.87)岁。纳入标准:(1)确诊慢阻肺的住院患者。呼吸科医生根据特异临床表现及症状诊断及辅助检查确诊为慢阻肺急性发作入院患者(使用支气管扩张剂后FEV1/FVC比值小于70%的患者);(2)有完整临床资料、影像学资料(完整胸部CT扫描数据并有0.625mm薄层处理图像);(3) 有完整心超检查结果。
排除标准:(1)CT图像伪影较重或者质量差影响测量的;(2)排除患有严重感染、胸腔积液、结核、肿瘤、肺栓塞、肺间质性疾病支气管哮喘等影响肺功能疾病的;(3)有肺部及纵隔肿瘤手术病史的。(4)超声心动图显示有二尖瓣瓣膜疾病及左心房室疾病的。
本研究经过我院伦理委员会批准(编号:2022-RE-076)
二、影像学资料
1 超声心动图数据收集及分组 肺动脉压力数据为患者病历资料中有关超声心动图检查数据报告。检查使用的心超机器型号是Philips EPIQ 7C、Philips iE33,测量收缩期三尖瓣肺动脉的收缩压(图1A)并根据压力值进行分组[5]:正常(<30 mmHg)、轻度sPAP(30~50 mmHg)、中度sPAP(51~70 mmHg)、重度sPAP(>70 mmHg),由于COPD患者大部分年纪较大,正常组患者sPAP压力值都将达到诊断轻度患者的临界值,因此将所收集患者资料根据心超测量数据分为两组,其中A组为正常及轻度sPAP组,B组为中重度sPAP组。
2 胸部CT扫描方法及数据分析 扫描使用机器为美国GE公司Discovery CT,所有患者经过吸气屏气进行扫描,扫描范围包含整个肺野,并重建薄层0.625mm数据,传输至AW4.7工作站进行分析及医院PACS系统保存。
数据处理分析使用的软件为GE工作站中的 Thoracic VCAR分析软件(图1B、1C),软件进入后会自动生成肺部CT衰减阈值范围(由-1024HU至 -300HU),我们设定肺部CT值低于(-950HU)的范围为肺气肿区域,其体积用LAA%表示,分别记录左、右肺及全肺LAA%值。然后选取肺部四个支气管,分别为左肺上叶尖后段(LB1)、右肺上叶尖端(RB1)、左肺下叶后基底段(LB10)、右肺下叶后基底段(RB10) 。Diaz A A等人也采用了这个测量方案[6],其主要原因是因为这几个段支气管它与CT扫描平面大体垂直,相对方便测量及计算[7]。分别取各段支气管中间位置选取感兴趣区(ROI),由于百分比计数可以让每个患者标准化统一,分别由一位放射科医生及一位呼吸科医生采用双盲法测量支气管管壁面积百分比(WA%)及气管壁的厚度与管腔直径的百分比(WT/D)并记录各组数据,在遇见意见不一时请示第3位医生进行讨论决定最终结果,最后计算两组数据平均值作为最终结果。
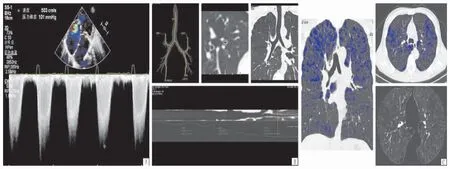
图1 A:超声心动图测量收缩期三尖瓣肺动脉的收缩压; B,C:GE工作站中的 Thoracic VCAR分析软件分析结果,B:COPD患者支气管壁厚度及管腔直径的百分比测量,C:蓝色区域代表CT值低于-950 HU肺气肿范围。
三、统计学方法
结 果
一、临床资料结果(表1)
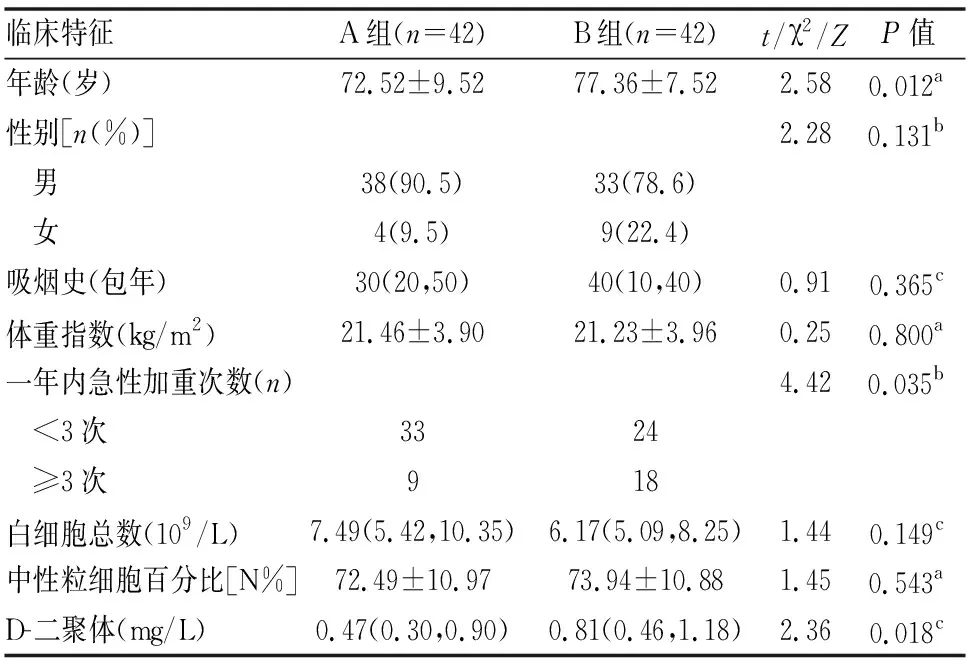
表1 A组与B组患者一般临床资料结果
A组年龄较B组低[(72.52±9.52)岁vs(77.36±7.52)岁,P=0.012],在一年内急性加重次数两者有明显差异,B组大于3次的人数较多(18vs9,P=0.035),B组D-二聚体水平高于正常及轻度组(P=0.018)。两组患者在性别、BMI、白细胞计数、中性粒细胞百分比差异无统计学意义。
二、两组患者影像学参数分析
1 超声心动图检查 两组患者超声心动图检查结果显示,肺动脉压力数据两组之间有明显差异,B组sPAP 水平明显高于A组,两组之间差异有统计学意义(P<0.001)。
2 CT测量参数 两组CT测量参数分析显示,两组患者的多项CT参数之间有明显差异。B组的RB1 WA%、RB1 WT/D、 LB1 WA%、LB1 WT/D值均较对侧增加(P<0.001),B组RB10 WA%、RB10 WT/D、LB10 WA%、LB10 WT/D值也较另一组增大(P<0.05)。B组的R-LAA%、L-LAA%、全肺LAA%较另一组升高(P<0.001)。总吸气量两组差异无统计学意义(P=0.684)(见表2)。
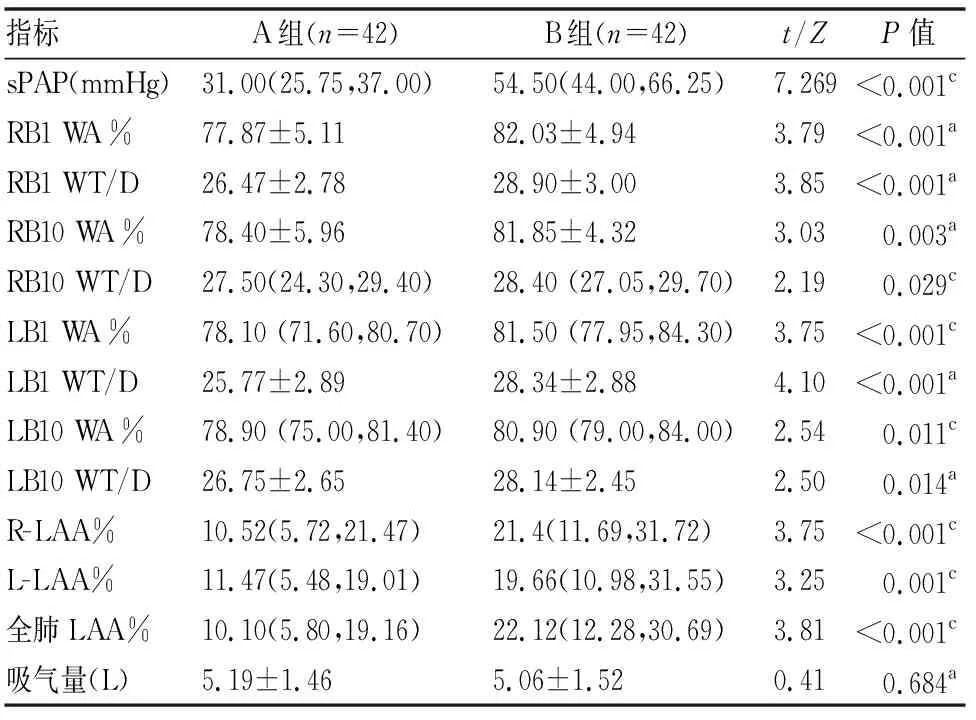
表2 A组与B组患定量CT资料分析结果
讨 论
小气道病变是慢阻肺的重要病理变化之一,对小气道病变的认识和量化至关重要[8]。 长期吸烟会导致气管壁炎症、损伤、组织重塑,并最终导致小气道病变,呼吸道功能减退,导致气道气流受限和肺泡通气量不足。定量CT分析不仅可以客观分析COPD患者小气道管壁及管腔的结构改变情况,也可见评估肺气肿程度[9-10]。肺气肿在组织学上是由肺泡壁遭破坏而形成的,可以通过CT检查发现,肺气肿的严重程度也可以通过肺泡破坏后造成的低密度区域的定量CT指数来衡量,支气管壁面积(WA) 和LAA%的定量分析分别被证明与气道重构和肺气肿相关[2]。
COPD的患者在其疾病过程中常发生多种并发症,PH是最常见的并发症之一,随着疾病严重程度的增加而加重[11]。超声心动图作为右心导管的一种替代方法,可评估肺动脉收缩压(sPAP),是诊断PH及评估血流动力学变化的常用方法[12-13]。CT影像学数据分析和超声心动图检查,这两种无创手段对慢阻肺患者病情评估均有重要价值,但两者之间的关系尚没有明确的研究结果,值得进一步研究。
本研究主要分析了慢阻肺合并不同程度sPAP患者小气道的胸部CT数据及一些临床资料。有研究[14]报道随着年龄的增长,小气道长期受疾病损伤,患者呼吸道功能会加速下降。有研究发现因慢阻肺加重而住院的患者中,入院的次数越多患者其肺动脉高压程度相对越高[15],本研究中B组患者一年内急性加重次数≥3次的人数比A组多出一倍,与既往研究结论一致。既往研究[10]提出肺气肿与气道白细胞、中性粒细胞无关,本研究未发现白细胞、中性粒细胞与肺气肿或小气道疾病之间的联系。
本研究比较了不同PH严重程度的患者的CT影像变化,发现合并中重度PH的慢阻肺患者气管WA%、WT/D相对于另一组增高,LAA%也相对于另一组增高。慢阻肺病理机制为功能性不可逆气流受限,随着病情进展,肺内各个结构出现特征性的形态改变[16]。慢阻肺患者气管壁重塑主要由炎性细胞浸润及支气管管壁纤维化形成并导致气流受限,随着气管壁增厚会造成肺通气/灌注不匹配,气体交换效果差会导致缺氧性血管收缩和血液动力学异常[17]。 由于支气管壁的不断增厚,氧气在通过气管及弥散的难度不断增加,从而导致低氧血症,低氧血症会导致肺小动脉收缩,这也是慢阻肺患者形成肺动脉高压的主要原因[18]。Dournes[19]等人也发现患有慢阻肺的患者气道厚度增加是平均肺动脉压升高的预测因素。 有研究显示肺动脉压力和支气管壁增厚之间有密切的关系,支气管壁厚度与肺动脉压力呈正相关[20]。
本研究的局限性主要为:收集患者样本量相对较少,其中男性病人相对较多,性别差异较大,需要更大的样本量进行研究从而得出更可靠的结果。其次,本研究根据sPAP分成两组来分析,并没有分成多组进行更精细化的对比分析。此外,没有分析这些指标与慢阻肺肺功能以及临床症状的关系,这些有待进一步进行探索研究解决。
总之,慢阻肺患者的肺部影像学数据基本能够反映患者的肺部病理解剖学变化严重程度,与慢阻肺患者肺动脉高压的程度有一定的相关性。两种检查方法均能反映患者的病理生理变化,可以联合用于慢阻肺患者的病情变化评估。

