肿瘤突变负荷与免疫细胞浸润联合分析在胃癌预后评估中的临床意义
段福慧,王光明
大理大学第一附属医院基因检测中心,云南 大理 671000
胃癌(gastric cancer,GC)作为消化系统发病率最高的恶性肿瘤,是全球第五大最常见的肿瘤和第四大最常见的癌症死亡原因。截至2020年全球有超过100万新发GC病例和近80万GC患者死亡[1]。中国癌症报告显示,GC的发病率位居全国第二且呈现年轻化的特点,新发病例约为40.3万例[2]。由于缺乏早期诊断标志物,大部分胃癌患者被确诊时已处在晚期阶段,其预后较差[3]。因此研究GC预后的机制,挖掘关键基因,寻求对GC更敏感的生物标志物,对改善GC患者的总体生存期至关重要。
肿瘤突变负荷(tumor mutation burden,TMB)是指一份肿瘤样本中,所评估基因的外显子编码区每兆碱基中发生置换和插入/缺失突变的总数[4]。有研究表明,具有较高突变负荷的肿瘤能够在肿瘤细胞表面募集到更多的新抗原,增加肿瘤的免疫原性,提高免疫治疗的疗效[5]。肿瘤基因突变具有高度特异性,不同患者之间存在不同的基因突变图谱,而TMB可能是多种实体肿瘤免疫治疗结局的潜在生物标志物。近年来,越来越多的研究数据表明TMB是免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)的新型生物标志物,能够预测免疫治疗的疗效[6]。2020年6月17日,FDA批准TMB-H(TMB≥10 Muts/Mb)作为筛选癌症患者的分子生物标志物。因此,本研究旨在评估TMB在GC患者中的预后价值及其与免疫细胞浸润的关联性。
1 资料与方法
1.1 资料获取 利用TCGA官网推荐的下载软件GDC-client从基因组数据共享(Genomic Data Commons,GDC)平台下载GC患者转录组数据,其中胃癌样本375例,正常样本32例、运用Strawberry Perl 5.32.1软件将转录组数据整理成基因表达矩阵文件。收集相应的临床信息包括年龄、性别、AJCC-TNM分期、病理分期、肿瘤分级和生存状况等将其整理成R软件可以识别的数据格式(XML格式)。突变数据经过VarScan软件处理,并使用“maftools”包进行可视化突变基因和突变分型。
1.2 TMB的计算 通过JAVA8平台的Perl脚本计算每个样本的TMB值,表达为体细胞突变总数/测序区域大小,单位为mutations/Mb。
1.3 TMB突变情况及高TMB组和低TMB组生存分析 所有肿瘤样本的高TMB组和低TMB组由中位TMB分数定义,利用R软件“survival”包分析两组之间生存率的差异。并使用Wilcoxon秩和检验来评估TMB水平与临床特征之间的相关性。
1.4 筛选差异表达基因 根据前文所述,GC患者分为了高TMB组和低TMB组。差异表达基因(DEGs)由“limma”包识别,采用热图展示分析结果。DEGs的热图是通过“pheatmap”包得出,“org.Hs.eg.db”包用于注释DEGs。
1.5 基因通路富集分析 利用R语言对获得的差异基因进行KEGG(kyoto encyclopedia of genes and genomes)和GO(gene oncology)富集分析。当P<0.05,错误发现率(FDR)<0.05,则认为富集的基因集有临床意义,结果以柱状图的形式输出。
1.6 筛选差异免疫基因及构建预后模型 从ImmPort数据库(https://www.immport.org/)下载免疫相关基因的列表,再利用“Limma”包找出分组后差异表达基因,取两者交集后将得到的差异免疫基因通过“VennDiagram”包进行可视化。采用“Survival”包对差异免疫基因进行单变量Cox回归分析找出与预后相关的基因。多变量Cox回归分析构建基因预后模型,并将得到Cox模型进行Kaplan-Meier生存分析,生成ROC(receiver operating characteristic)曲线以评估TMB预后风险评分的预测值。
1.7 免疫细胞浸润及免疫相关生存分析 基于TIMER数 据 库(https://cistrome.shinyapps.io/timer/)的“SCNA”模块,用箱形图比较不同免疫细胞浸润和参与模型构建的4个基因拷贝数的变化。最后,使用“survival”模块,分别绘制6种免疫细胞在高、低浸润组中的Kaplan-Meier图。并对每个图中的两组生存曲线通过Log Rank检验获得P值,以探究免疫细胞浸润水平与其生存的关系。
1.8 统计学方法 数据可视化和差异分析由“limma”R包执行。Cox回归分析和Kaplan-Meier分析由“Survival”R包进行。Wilcoxon秩和检验是一种非参数检验,用于检测两组之间的差异。单、多因素COX回归分析差异表达的基因进行预后分析。通过Log Rank检验获得P值,分析免疫细胞浸润水平与其生存的关系。所有统计学分析均在R软件(版本3.6.3)上进行。以P<0.05代表差异具有统计学意义。
2 结果
2.1 胃癌患者基因突变情况 本研究总共收集433例GC患者体细胞突变数据,其中387例样本存在变异,如图1A所示的错义突变是最常见的突变类别,单核苷酸多态性变异所占的比例最多。将单核苷酸变异分为6类,结果显示C>T突变在GC中的发生率最高(91 939)。每个样本的变异数从0到5 612不等,中位数为89。瀑布图显示了前30个突变基因及其在突变类别方面的状态(图1B)。前20个突变基因如下:TTN、TP53、MUC16、ARID1A、LRP1B、SYNE1、FLG、FAT4、CSMD3、PCLO、DNAH5、KMT2D、FAT3、OBSCN、HMCN1、RYR2、ZEFX4、SPTA1、CSKMD1和PIK3CA。笔者使用交互图来显示前20个突变基因之间的共性和互斥性(图1C)。绿色代表突变基因之间的共突变关系,而棕色代表基因之间的互斥关系。基因云图(图1D)可以突出显示突变较多的基因。
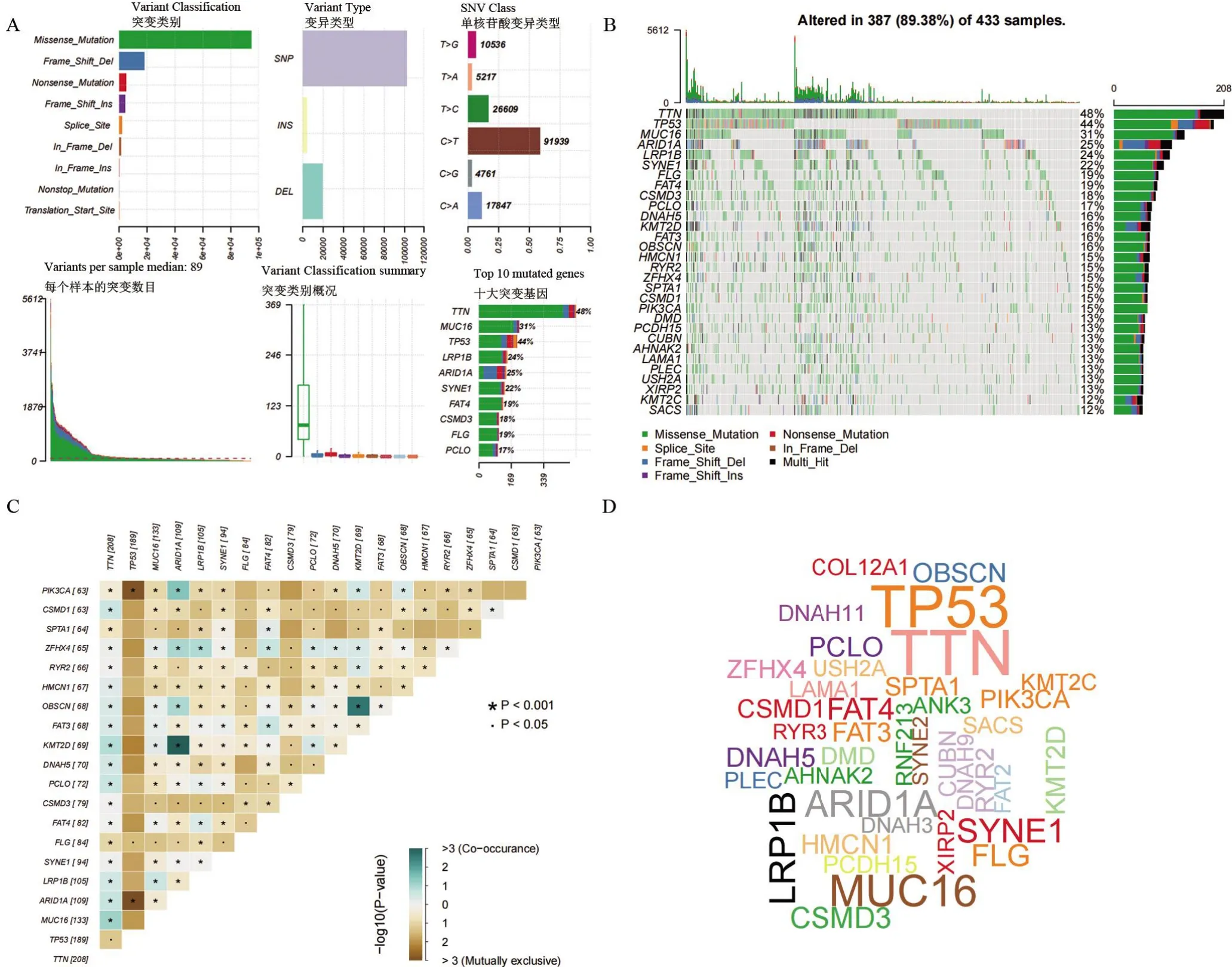
图1 胃癌基因突变全景图
2.2 TMB在GC中的预后价值 通过Perl脚本计算每个GC样本的TMB分数,根据中位TMB值将胃癌样本分为TMB高组(n=183)和TMB低组(n=184),进行Kaplan-Meier分析,结果表明TMB高组与更好的生存结果相关(P=0.017,图2A)。另外,笔者进一步比较了不同临床特征之间TMB的差异。在具有以下特征的GC患者中观察到高水平的TMB(图2):65岁以上(P<0.001,图2B),女性(P=0.033,图2C),StageⅠ~Ⅱ(P=0.044,图2E),T1~2分期(P=0.039,图2F),N0(P=0.018,图2G)。但是,TMB值与M分期(P=0.104,图2H)或G1~G2分级(P=0.051,图2D)的相关性未观察到显著差异。
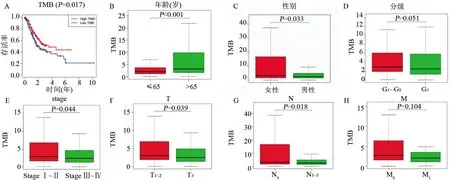
图2 TMB与临床特征相关性
2.3 高TMB组和低TMB组间的DEGs比较和基因富集分析 本研究总共收获了816个DEGs,将两组之间的DEGs通过热图进行可视化(图3A)。还进行了GO和KEGG富集分析,用柱状图(图3B、3C)表示。柱状图的横坐标表示富集在GO/KEGG上的基因数目,纵坐标表示GO/KEGG的名称,其中GO富集可分为BP、CC和MF。图3B结果显示GO富集中以肌肉系统的形成与含胶原蛋白的细胞外基质的通路富集较显著,图3C结果显示在KEGG富集中以神经活性配体-受体相互作用通路富集最为显著。
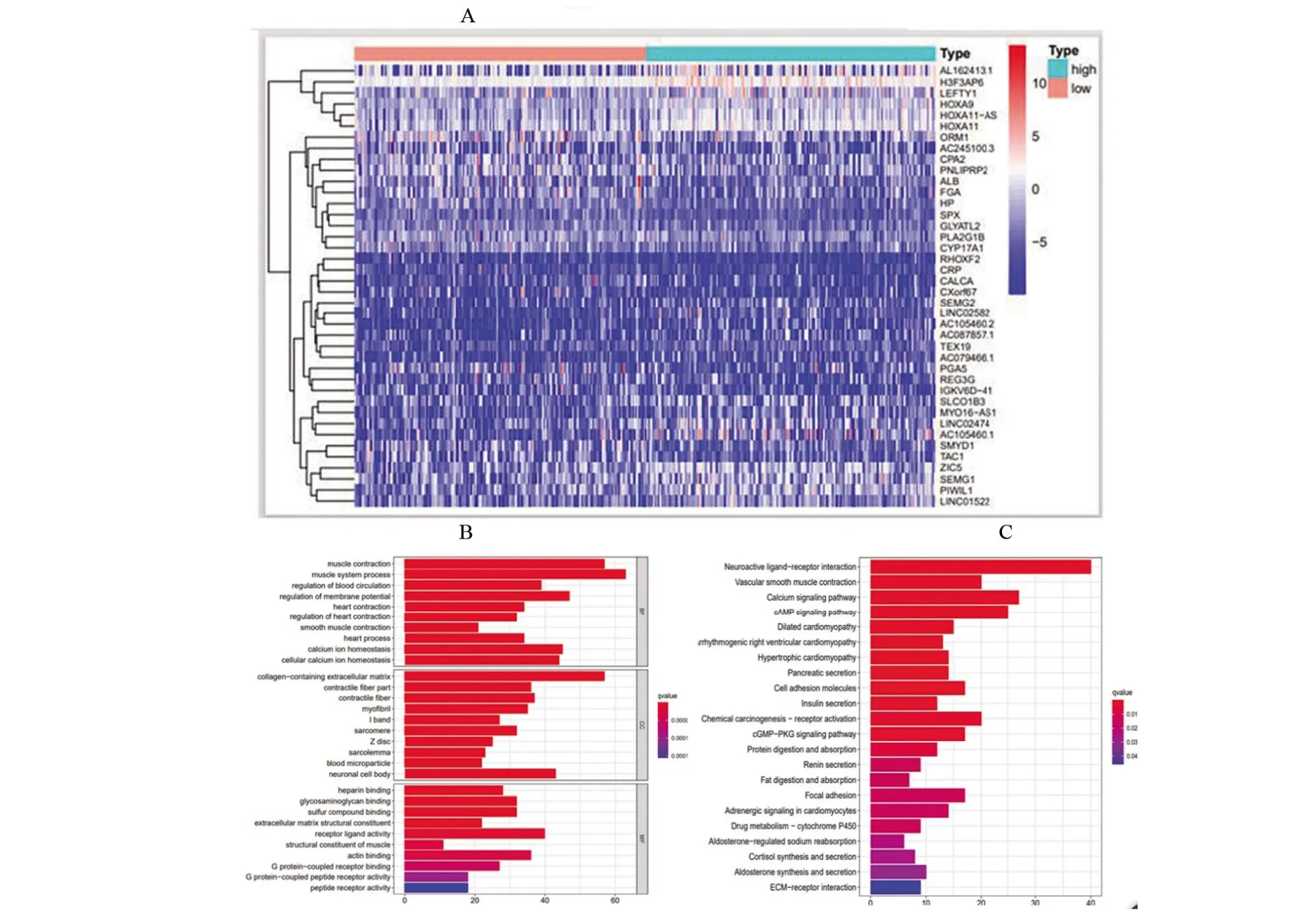
图3 高TMB组和低TMB组间的DEGs比较和TMB相关的富集基因集
2.4 高TMB组和低TMB组GC患者的免疫细胞浸润比较 根据TMB水平将GC患者分为两组,通过“CIBERSORT”R包比较高TMB和低TMB组中的22个免疫细胞。每个GC患者中22个免疫细胞的比例如图4A所示,不同的颜色代表不同的免疫细胞类型。此外,小提琴图(图4B)用于可视化免疫细胞比例。Wilcoxon's rank-sum检验显示,活化CD4+记忆T细胞、滤泡辅助T细胞、静息NK细胞、M0和M1巨噬细胞和中性粒细胞等免疫细胞的高TMB组浸润高于低TMB组。数据库中免疫相关基因与差异基因相结合并利用“VennDiagram”包筛选出97个差异免疫基因(图4C)。进行单因素Cox回归分析并进一步鉴定了12个与预后相关的基因(表1)。进行多因素Cox回归分析后筛选出APOD、FGF7、AMHR2、NPR3 4个基因来构建预后模型。将得到的预后模型行Kaplan-Meier生存分析,其结果显示:APOD、FGF7、AMHR2和NPR3基因的生存曲线中高、低表达组患者的预后存在显著差异,其中APOD、FGF7、AMHR2基因高表达组的生存时间更长(图5A~5C),NPR3基因低表达组的生存时间更长(图5D)。最后,根据Cox回归分析构建预后算法,结果显示低风险组患者与更好的生存预后相关(图5E)。绘制ROC曲线,以曲线下面积(AUC)=0.642来验证预后模型的准确性(图5F)。
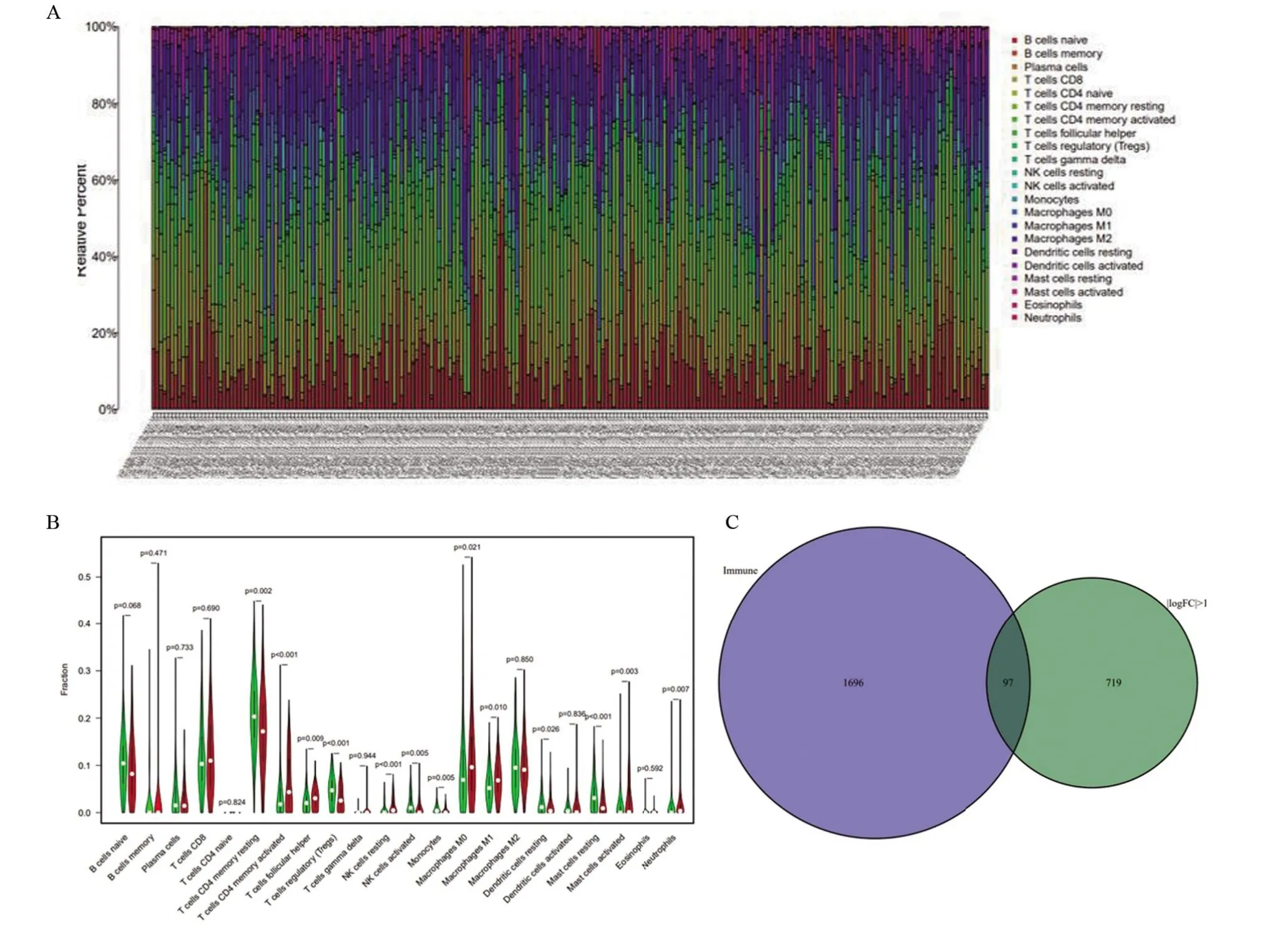
图4 高、低TMB组与浸润免疫细胞的相关性
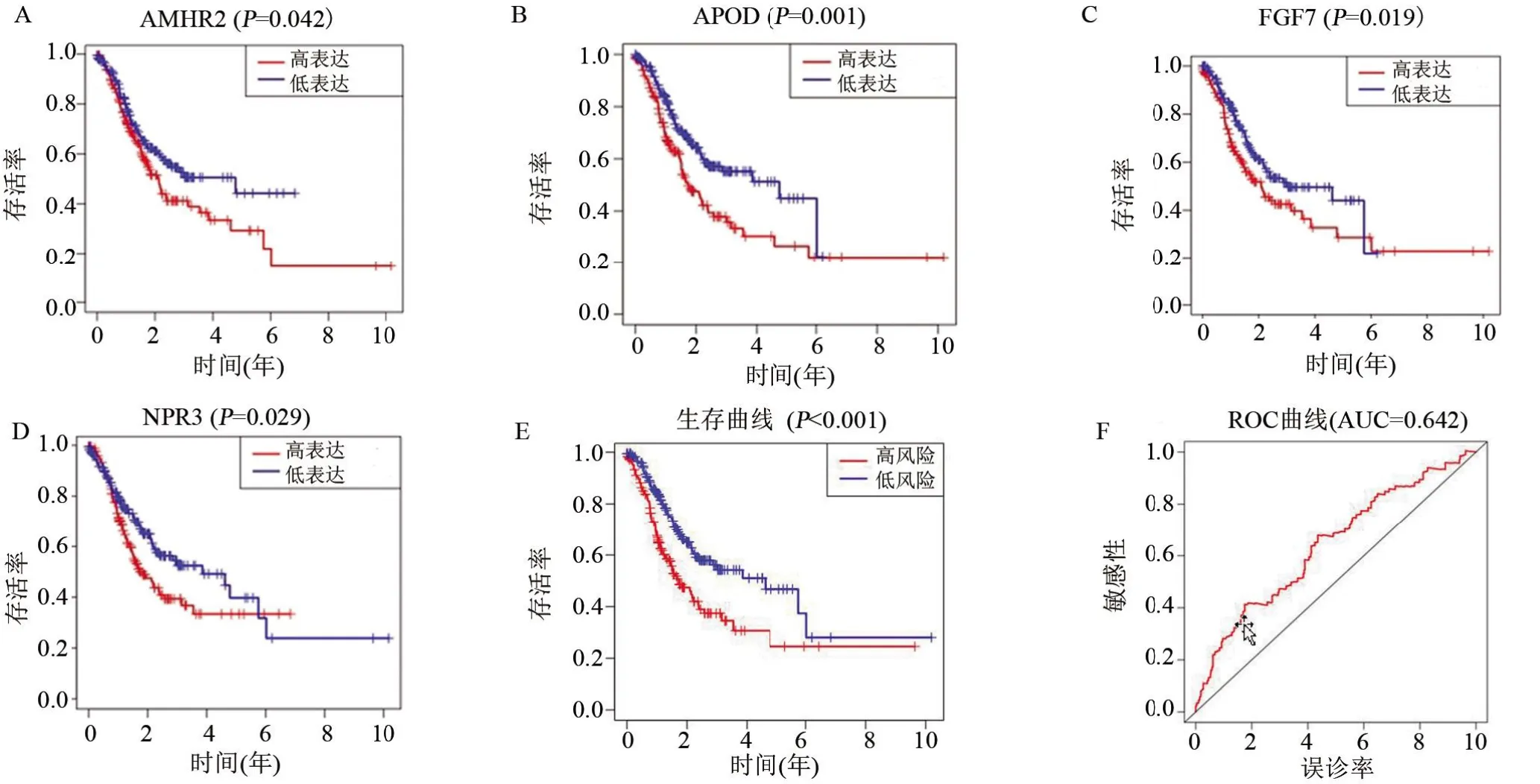
图5 胃癌预后相关基因的生存分析
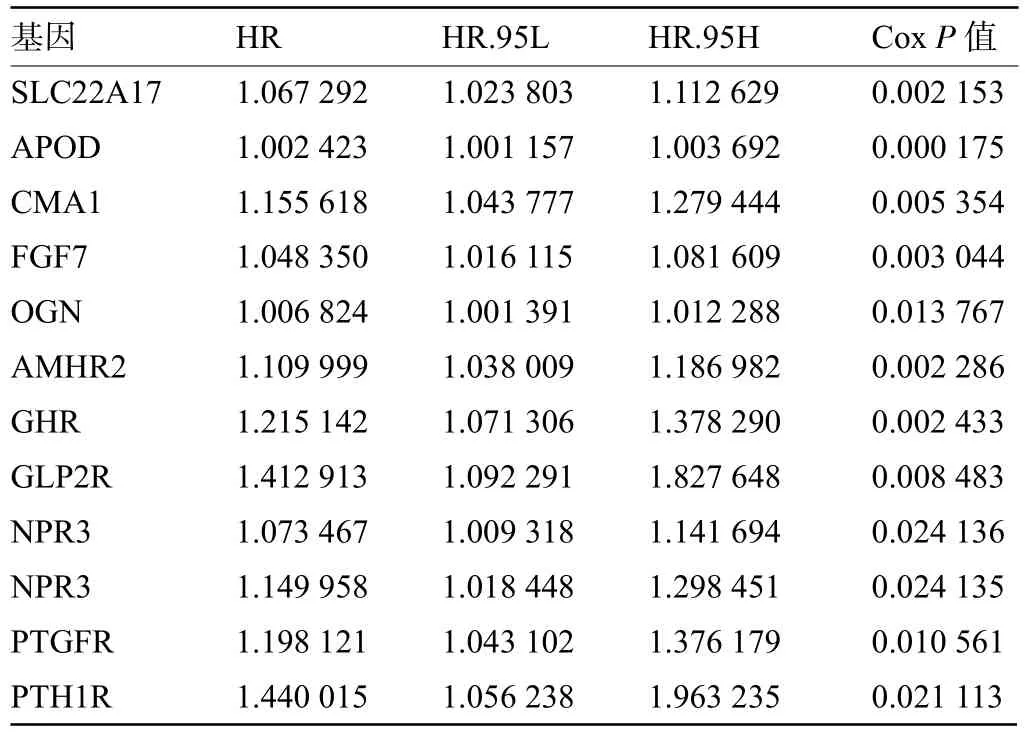
表1 免疫相关的DGEs单因素Cox回归分析
2.5 预后相关基因CNV与免疫细胞浸润的关系 基于TIMER数据库的“SCNA”模块,用箱形图(图6A~6D)描述了GC患者中AMHR2、APOD、FGF7、NPR3这4个预后相关基因的拷贝数变异与免疫细胞浸润之间的相关性。该模块将样本以基因拷贝数变化来分组,把6种免疫细胞浸润情况展现出来,图例中的拷贝数由5种颜色来区分。图6A表明AMHR2基因的拷贝数缺失与B细胞、CD8+T细胞、CD4+T细胞、巨噬细胞、中性粒细胞和树突细胞的浸润水平相关。图6B表明APOD基因获得拷贝数与B细胞、CD8+T细胞、CD4+T细胞、巨噬细胞、中性粒细胞和树突细胞的浸润水平相关。图6C表明FGF7基因的拷贝数缺失与B细胞、CD8+T细胞、CD4+T细胞、巨噬细胞、中性粒细胞和树突细胞浸润水平相关。图6D表明NPR3基因获得拷贝数与B细胞、CD8+T细胞、CD4+T细胞、巨噬细胞、中性粒细胞和树突细胞的浸润水平相关。
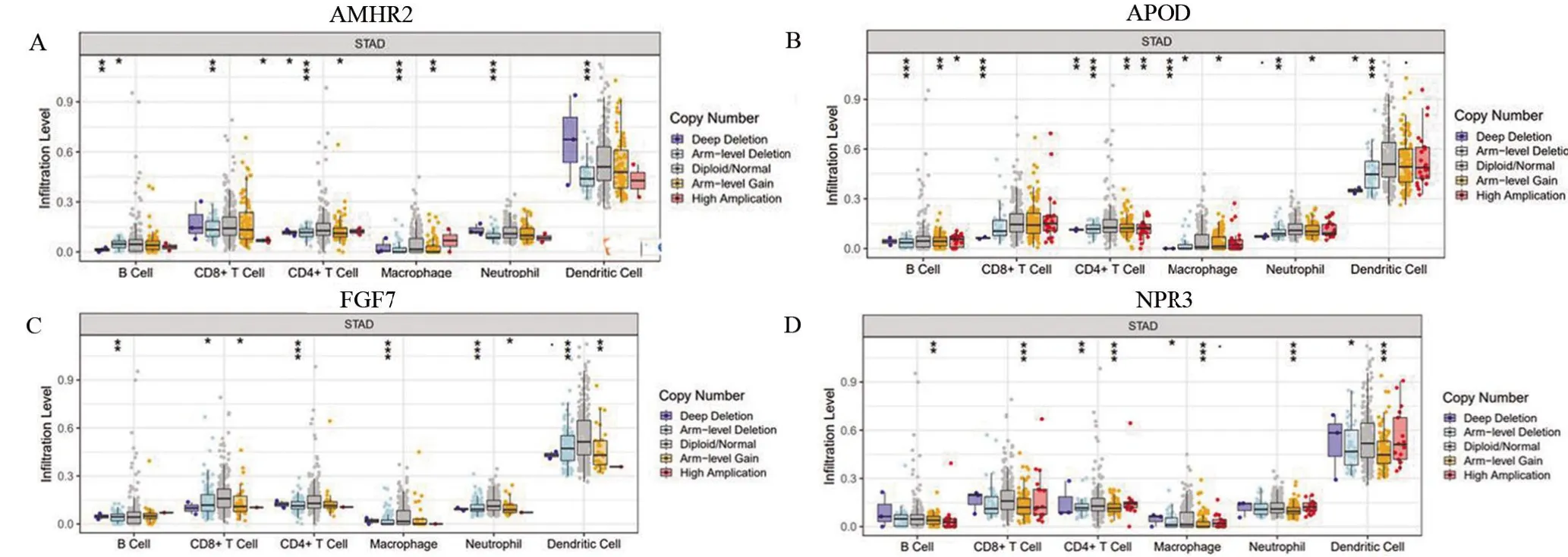
图6 AMHR2、APOD、FGF7、NPR3基因拷贝数变异与免疫细胞浸润的相关性
2.6 不同免疫细胞浸润情况下生存分析 通过Cox回归分析影响GC患者生存结果的免疫细胞类型。图7展示的是6种免疫细胞在高、低浸润组的生存分析,结果显示GC患者较差的生存结果与高巨噬细胞浸润相关。

图7 6种免疫细胞高、低浸润组与生存的关系
3 讨论
近年来免疫治疗成为治疗肿瘤疾病的一种创新方法,为肿瘤患者带来了希望。其中ICIs发挥着举足轻重的作用,但只有15%~20%的患者对免疫疗法有反应[7]。若有更好的新型生物标志物来筛选适合免疫治疗的肿瘤患者,并对这部分患者进行针对性的免疫治疗,其治疗效果可能会更佳。目前,在胃癌ICIs治疗中用于疗效预测的指标有PD-L1、EBV阳性、高度微卫星不稳定、肿瘤突变、肿瘤浸润性淋巴细胞及基因表达谱等。其中针对程序性细胞死亡蛋白1(PD-1)及其配体(PD-L1)的ICIs已进入临床试验,如派姆单抗、纳武单抗能够使胃癌患者获得有效且持久的临床反应。但临床研究发现,仍有部分胃癌患者存在ICIs治疗不敏感或治疗抵抗现象[8-9]。所以,寻找更好地预测ICIs疗效的生物标志物,对提高GC患者免疫治疗效果至关重要。
TMB是一种很有前景的ICIs治疗标志物,已被发现在预测免疫疗法的反应方面有着重要作用。YARCHOAN等[10]研究发现,在接受PD-1/PD-L1免疫检查点抑制剂治疗的肿瘤患者,TMB与ICIs治疗客观反应率呈正相关,高TMB患者客观反应率明显升高。RIZVI等[11]研究发现,TMB>50%的患者比TMB≤50%的患者临床受益率更好。一项前瞻性临床试验对54例接受特瑞普利单抗治疗的化疗抵抗性胃癌患者进行TMB分析,结果发现高TMB患者的客观反应率和总体生存期均高于低TMB患者[12]。上述研究表明,TMB可作为ICIs疗效的预测指标,在预测胃癌ICIs疗效上扮演着重要的角色。
本研究基于TCGA数据库总结了GC患者的突变基因组景观,其中前3个突变基因是TTN、TP53和MUC16。TP53是研究最广泛的抑癌基因之一,其突变不仅消除了p53的肿瘤抑制功能,还产生某些促癌蛋白[13]。TTN是已知最长的基因,会影响心脏和骨骼肌的发育与调节,已被证实与TMB水平和实体瘤中对ICIs的反应高度相关[14]。MUC16是各种癌症中最常见的突变基因之一,与癌细胞的生长和转移增强有关[15]。近期,有学者提出MUC16与高TMB和GC的良好预后相关[16]。本研究还分析了GC患者TMB值与生存率之间的关系,结果表明高TMB组的GC患者具有更好的生存结果,这一发现与其他癌症研究一致。并观察到高TMB 组与 GC 病例中的年龄、女性、Stage Ⅰ~Ⅱ、T1~2分期以及N0相关。本研究通过“limma”包确定了816 个 DEGs,将得到的 DEGs 进行 GO 和 KEGG 富集分析,结果显示这些DEGs主要参与神经活性配体-受体相互作用、肌肉系统形成和含胶原蛋白的细胞外基质通路。通过进一步的单变量和多变量Cox 分析筛选出与GC 患者预后相关的基因AMHR2、APOD、FGF7 和NPR3 来构建预后模型。研究结果显示,这4个基因的高表达与不良预后相关,同时还发现这部分基因的突变与免疫细胞浸润有关。
免疫细胞是肿瘤微环境中很大一部分的浸润细胞,通过释放炎症细胞因子和趋化因子与肿瘤细胞相互作用,从而驱动癌症的生物学行为并影响其对免疫疗法的治疗作用。在本研究中,笔者探讨了TMB值与GC患者免疫浸润之间的潜在关系。通过比较发现高TMB 和低TMB 组之间的22 个免疫细胞中CD4+记忆T 细胞、滤泡辅助 T 细胞、静息 NK 细胞、M0 和 M1 巨噬细胞和中性粒细胞在两组中的浸润情况存在差异。高TMB 组中3 种免疫细胞(CD8+T 细胞、CD4+T细胞和Tfh 细胞)的丰度明显高于低TMB 组。为了进一步研究两组的差异是否会影响GC患者的生存结果,还进行了Cox 回归分析研究,结果表明,高巨噬细胞浸润与GC患者较差的生存结果相关。YU等[17]也得出了类似的结论,高密度的巨噬细胞浸润与GC患者生存结果不佳显著相关。多项研究探讨了巨噬细胞和GC细胞的相互作用,发现巨噬细胞可能在促进GC细胞增殖、转移、血管生成和免疫侵袭中发挥作用[18-21]。
本研究还存在一些局限性:首先,研究中所有样本和临床数据都是基于TCGA数据库收集的,没有采用外部数据库如GEO 数据库(Gene Expression Omnibus database) 或其他大样本的队列进行验证研究结果;其次,分析了TMB与浸润性免疫细胞的关系,但缺乏免疫组织化学等基础实验来确定四个预后相关基因与免疫细胞浸润之间的相关性;最后,研究中绘制的 ROC 曲线,其曲线下面积AUC=0.642,AUC<0.7。因此,需要更多的临床数据来提高预测效果。
总之,本研究基于TCGA 数据库发现高巨噬细胞浸润预示胃癌患者预后较差,高TMB与胃癌患者更好的生存预后相关。因此,高TMB患者接受免疫治疗效果更好,能延长患者的生存期。

