基于氧化锌纳米花的心肌肌钙蛋白I夹心式电化学免疫传感器构建研究*
朱 彤,王 琴,苏会岚
成都医学院 公共卫生学院( 成都 610050)
急性心肌梗死(acute myocardial infarction,AMI)是因持续性缺血缺氧而引起的心肌坏死,临床常采用心电图、血常规检查等方法进行诊断[1]。研究[2-3]表明,心肌肌钙蛋白(cardiac troponin,cTn)含量在AMI发生3~6 h后迅速增高,增高倍数通常超过总肌酸激酶(creatine kinase,CK)和肌酸激酶同工酶(creatine kinase isoenzymes,CK-MB)含量的增高倍数,比CK-MB更具时效性。其中,高灵敏度的cTnI在临床检测中备受关注,对AMI的早期诊断及疗效判断具有重要的临床意义[4-5]。目前,临床检测cTnI的方法主要包括免疫层析法、化学发光法以及免疫比浊法等[6-7]。李志梁等[8]结合免疫层析技术与纳米技术成功构建胶体金免疫层析法,在血清中实现对cTnI的快速定量测定。
相较于传统的检测方法,电化学免疫传感器具有高灵敏度、高特异度、操作简单、成本低等特点,在临床诊断、环境监测、食品工业等领域受到广泛关注[9-10]。Jia等[11]用固载有两种酶(辣根过氧化物酶、葡萄糖氧化酶)和两种电活性物质(硫堇、二茂铁)的氧化石墨烯标记第二抗体,制得检测探针,实现对肿瘤标志物癌胚抗原(carcinoembryonic antigen,CEA)和甲胎蛋白(alpha fetoprotein,AFP)的同时检测,该传感器检测CEA和AFP具有较宽的线性范围(0.01~100.00 μg/L),较低的检出限(CEA为1.64×10-3μg/L,AFP为1.33×10-3μg/L)。为提高检测灵敏度,有研究[12]发现,利用金属合金纳米材料设计一种无标记型cTnI电化学免疫传感器,检测限低至0.003 μg/L,线性范围为0.01~100.00 μg/L。另外,研究[13]表明,夹心式的免疫传感可有效提高检测灵敏度。氧化锌纳米花具备优异的导电性及催化性,在电化学传感器构建中常被用作电极修饰材料或载体等,但关于氧化锌纳米材料结合其他物质作为第二抗体的标记材料的研究较少。本研究采用氧化锌纳米花结合电活性物质硫堇及cTnI抗体构成检测抗体,构建一种双抗体夹心式电化学免疫传感器,以期实现对cTnI的高灵敏快速检测。
1 材料与方法
1.1 试剂与仪器
1.1.1 主要试剂 聚乙二醇400(macrogol 400,PEG-400)、七水硫酸锌(ZnSO4·7H2O)及50%戊二醛购自成都市科龙化工试剂厂;氢氧化钠(NaOH)购自成都金山化学试剂有限公司;3-氨基丙基三乙氧基硅烷(3-aminopropyltriethoxysilane,APTE)购自上海默克sigmaaldrich公司;cTnI试剂盒购自郑州博赛生物技术股份有限公司;氧化铝抛光粉购自天津艾达恒晟科技发展有限公司;氯金酸购自天津凯玛特化工科技有限公司;牛血清白蛋白(bovine albumin,BSA)、硫堇购自上海将来实业股份有限公司;无水乙醇购自成都市科隆化学品有限公司。
1.1.2 主要仪器 电化学工作站(上海辰华仪器有限公司),KH-50B型超声波清洗器(昆山禾创超声仪器有限公司),78HW-1型恒温磁力搅拌器(金坛市医疗仪器厂),BSA124S电子天平(赛多利斯科学仪器北京有限公司),PHS-320酸度计(成都世纪方舟科技有限公司),超纯水仪(四川优普超纯科技有限公司),BPH-9082精密恒温培养箱(上海一恒科学仪器有限公司),KDC-12低速离心机(合肥科大创新股份有限公司中佳分公司)。
1.2 方法
1.2.1 氧化锌纳米花的制备 采用直接沉淀法制备氧化锌纳米花。称量1.076 g ZnSO4·7H2O溶于6.25 mL超纯水搅拌至完全溶解;然后将1 mL PEG-400加入ZnSO4·7H2O水溶液中搅拌混匀;再将50 mL 1.2 mol/L的NaOH溶液快速注入上述混合溶液中,缓慢搅拌5 min,超声条件下震荡2 h,然后静置24 h;最后用无水乙醇与超纯水交替洗涤4 次后离心(离心速度10 000 r/min,离心半径5 cm,离心10 min),60 ℃干燥获得氧化锌纳米花。
1.2.2 氧化锌纳米花标记抗体 2 mL 5%的APTE与1 mL氧化锌纳米花(1 g/L)混合搅拌15 min,使氧化锌纳米花氨基化,离心洗涤除去多余的APTE;再向其中加入2 mL 2%的戊二醛交联剂溶液,搅拌20 min后注入0.3 mL cTnI抗体原液,继续搅拌1 h;最后加入600 μL 3 mmol/L电活性物质硫堇,缓慢搅拌1 h使其与氧化锌纳米花充分结合后得到氧化锌纳米花、抗体及硫堇免疫复合物,保存于4 ℃冰箱以备后用。
1.2.3 电化学免疫传感器的构建 电化学免疫传感器构建过程:1)先依次用 1.00、0.30、0.05 μm的氧化铝抛光粉将电极表面打磨抛光,分别用无水乙醇和超纯水超声交替清洗4次。2)利用三电极系统,以1%氯金酸为底液,采用恒电位溶出法在电极表面修饰纳米金,室温晾干后在电极表面滴涂7 μL 25% 的cTnI抗体溶液。3)将修饰电极置于4 ℃环境中孵育30 min后取出,用超纯水洗去多余抗体,再置于 BSA溶液中浸泡20 min以封闭非特异性吸附位点。4)将制备好的免疫传感器与不同浓度的cTnI抗原于35 ℃ 恒温箱中孵育25 min;取出清洗后在电极表面滴涂10 μL检测抗体继续孵育35 min;最后在磷酸缓冲溶液中用示差脉冲伏安法(differential pulse voltammetry,DPV)检测电信号变化(图 1)。
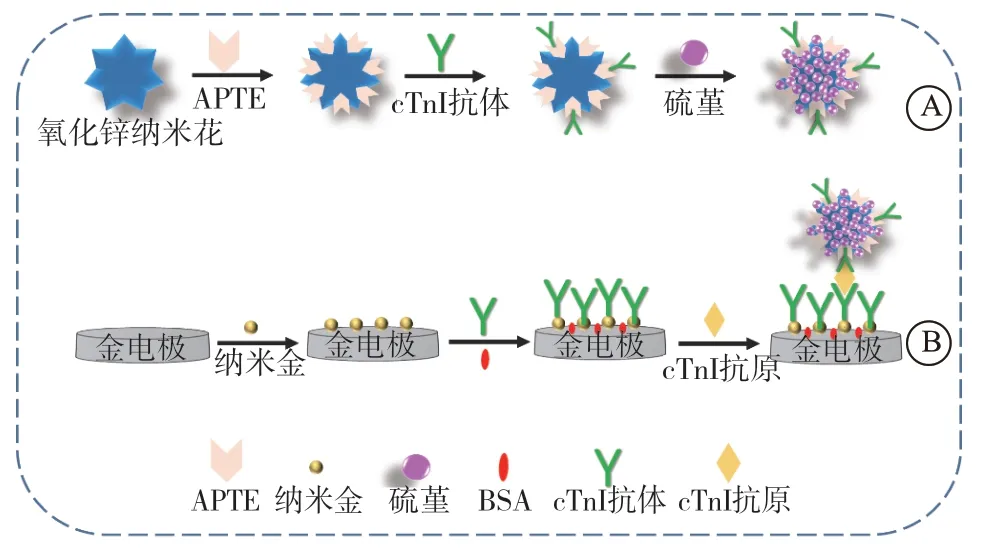
图1 cTnI电化学免疫传感器制备过程示意图
1.2.4 检测方法 本研究采用DPV方法对检测电信号进行测定;采用循环伏安法在0.5 mmol/L的铁氰化钾溶液内对传感界面构建过程进行研究,扫描电位区间为 -0.2~0.8 V,扫描速度为50 mV/s。
1.2.5 材料表征方法 本研究通过扫描电子显微镜(scanning electron microscope,SEM)对制备的氧化锌纳米花进行表征。
1.2.6 实验条件优化方法 1) pH优化:因抗原抗体分子均为蛋白质分子,pH高低均会影响蛋白质活性。实验制备梯度pH(3.5、4.5、5.0、5.5、6.0)的测试底液,探究pH对该传感器响应信号的影响。将制备好的免疫传感器置于不同pH的测试底液中,在其他条件相同的情况下,采用DPV法测得各pH下响应电流的大小。2) 孵育温度优化:在一定范围内,温度升高可加速分子运动,抗原与抗体碰撞机会增多,使反应更完全,但温度过高会导致抗原抗体解离变性,因此温度也是影响检测性能的关键因素。其他条件保持一致,将备好的传感器分别置于15 ℃、25 ℃、30 ℃、35 ℃、40 ℃温度下孵育。3) 孵育时间优化:孵育时间也会影响抗原抗体的结合效果,保证其他条件一致,探究传感器与待测物孵育不同时间后的电流响应。
2 结果
2.1 金电极传感界面及氧化锌纳米花表征
循环伏安法测定结果显示,修饰有纳米金粒子的电极峰电流高于裸电极。当cTnI抗体固载到电极表面后,阻碍电子传递,峰电流降低。BSA与cTnI抗原的结合进一步阻碍电子传递,峰电流再次降低,电极修饰成功(图2)。材料表征结果显示,氧化锌纳米花尺寸为1~5 μm,形态呈花状,具有多个片层结构,可为抗体的固载提供较大的比表面积和活性位点;材料分散较均匀,有助于提高抗体结合后的稳定性(图3)。

图2 电极修饰过程中的循环伏安表征

图3 氧化锌纳米花的SEM表征图
2.2 电化学免疫传感器的电流信号分析
在免疫传感器识别检测抗体后,其电信号经DPV检测显示,当溶液内加入H2O2后,峰电流明显增强,电流变化约为4 μA(图4)。
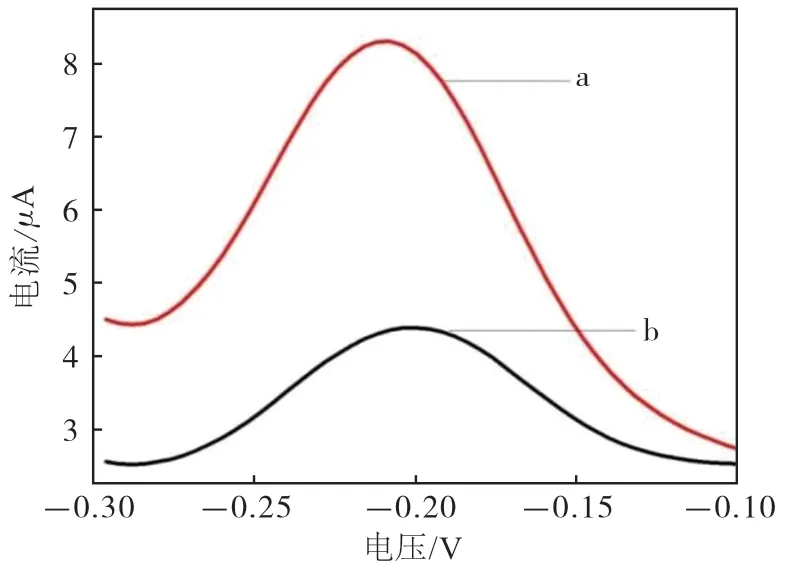
图4 加入H2O2前后DPV响应电流对比图
2.3 实验条件优化分析
当测试底液的pH为5.5时,该免疫传感器的电流响应最佳;当温度为35 ℃时,电流变化最大;孵育时间为20 min时,响应电流趋于稳定,故最优孵育时间为20 min(图 5)。
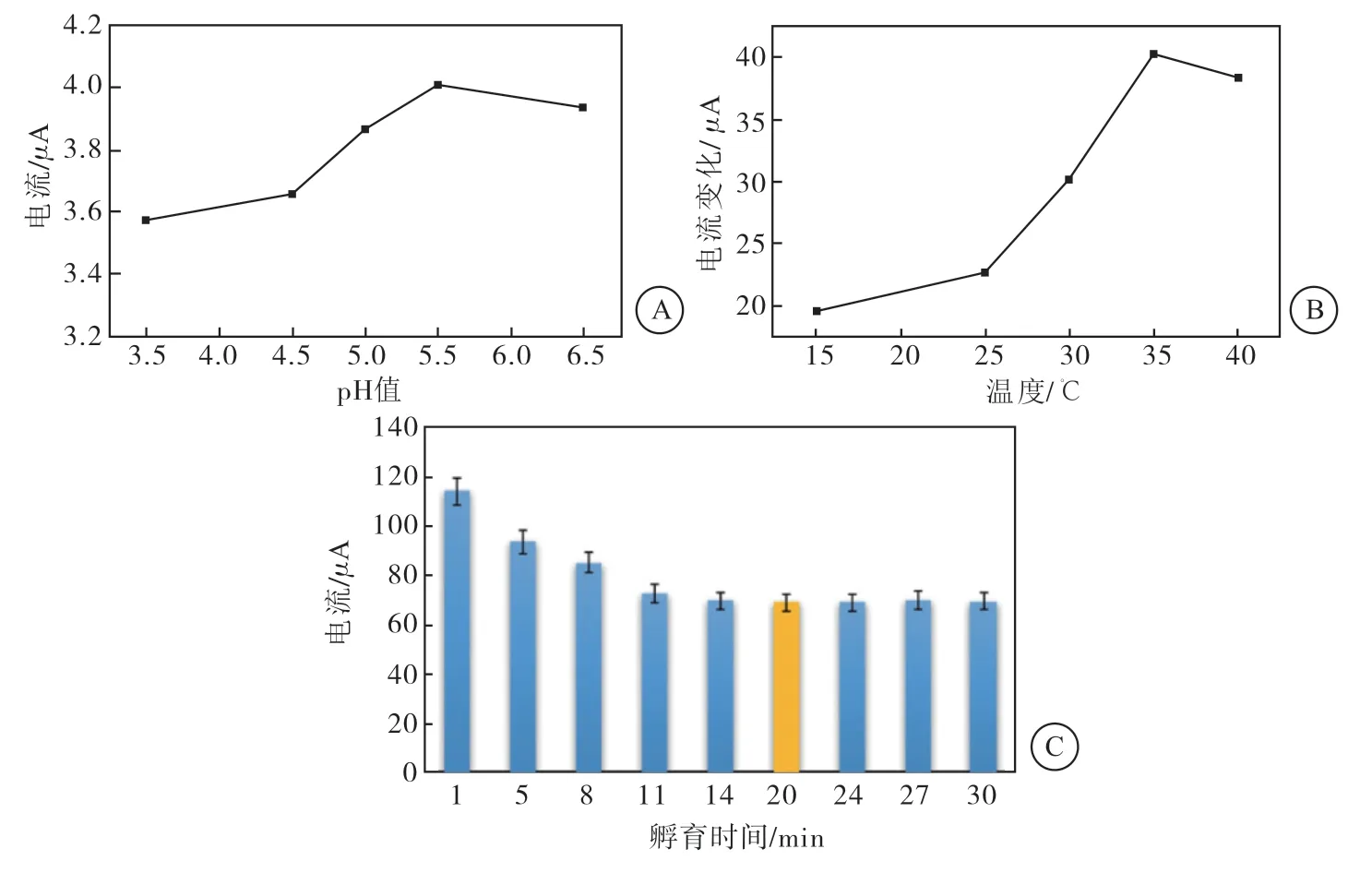
图5 实验条件优化分析
2.4 电化学免疫传感器性能分析
2.4.1 电化学免疫传感器对不同浓度cTnI的响应cTnI抗原浓度越大,与抗体结合形成的复合物越多,在电极表面固载的电活性物质越多,电流变化越大。cTnI抗原浓度与电流变化之间的线性关系显示,cTnI抗原浓度分别在0.05~0.25 μg/L和0.50~8.00 μg/L范围内与ΔI呈现良好的线性关系,检测限为0.014 3 μg/L(S/N=3)。线性回归方程分别为电流变化= 134.42CcTnI+19.68,相关系数(R2)=0.917 5;电流变化 = 1.88CcTnI+ 53.39,R2=0.942 5(图6)。
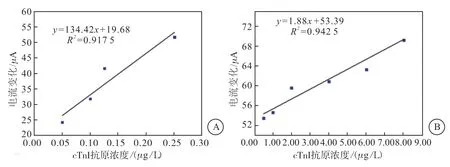
图6 cTnI抗原浓度与响应电流峰差值之间的标准曲线
2.4.2 电化学免疫传感器的重现性分析 最优实验条件下,用5个相同的电化学免疫传感器检测cTnI抗原溶液,经计算得出5次电流变化平均值为34.43 μA,相对标准差(relative standard deviation,RSD)为 1.86%(表 1)。

表1 电化学免疫传感器的重现性分析(μA)
2.4.3 电化学免疫传感器的选择性分析 在最优条件下,用制备好的电化学免疫传感器分别检测2 μg/L的cTnI抗原、20 μg/L的黄曲霉毒素B1(aflatoxin B1,AFB1)与cTnI抗原的混合物、20 μg/L的热休克蛋白90α(heat shock proteins 90α,HSP-90α)与cTnI抗原的混合物。cTnI+AFB1与cTnI+HSP-90α所测得的电流变化与cTnI抗原的电流变化相近(表2)。
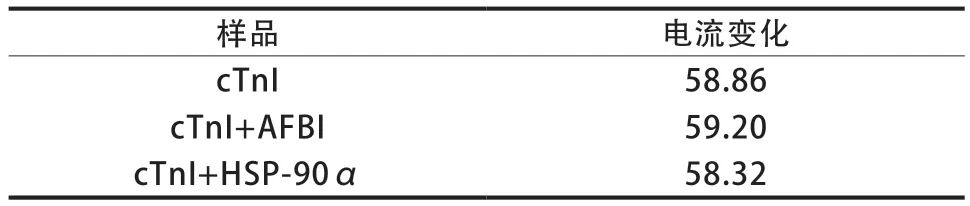
表2 电化学免疫传感器的选择性分析(μA)
2.4.4 回收率测定结果 采用加标回收法计算电化学免疫传感器的准确度,用血液环境模拟液将cTnI抗原溶液稀释至4.00、5.00、6.00 μg/L,用本研究的电化学免疫传感器进行测定,回收率为96.00%~104.00%(表3)。

表3 电化学免疫传感器测定cTnI加标回收率
3 讨论
AMI是冠状动脉闭塞、血流中断、心肌持久性缺血发生局部坏死而引起的疾病,严重危害人类健康,近年来我国AMI的发病率呈上升趋势[14]。AMI起病急、变化快且不易控制,早期诊断对患者临床治疗和愈后极为重要。cTn是心肌收缩的特异性调节蛋白,由cTnI、cTnT和TnC3种不同亚基组成。目前,将cTnI和cTnT作为AMI实验室诊断的生化指标,其中cTnI对心肌梗塞检测的灵敏度和准确度均高于cTnT。研究[15-16]表明,cTnI可作为AMI的临床诊断的生化指标,能提高AMI临床诊断的特异度和准确度。电化学免疫传感器通过对免疫反应前后待测物浓度变化所产生的化学信号进行检测、转换,从而对抗原抗体实现定量定性检测的一类方法。该方法具备高灵敏度、低成本、耗时短等优势,已被广泛用来检测cTnI[17]。
为提高cTnI检测的灵敏度,本研究通过合成氧化锌纳米花来固载cTnI抗体及硫堇作为检测抗体,构建夹心式的cTnI免疫传感器,结果发现氧化锌纳米花独特的片层结构为固载大量抗体及硫堇提供了丰富的位点;氧化锌纳米花具备优异的类过氧化物酶活性,能通过催化底物实现电信号放大。纳米金修饰电极可加快电子传输,明显增强电极导电性。在最优实验条件下,该cTnI免疫传感器具备较宽的线性范围(0.05~0.25 μg/L,0.50~8.00 μg/L)与较低的检测限(0.014 3 μg/L,S/N=3)。另外,在其他干扰物质存在时,该电化学免疫传感器检测性能并未受到影响,表明电化学免疫传感器具备良好的选择性;5个相同电化学免疫传感器检测cTnI,RSD为1.86%,电化学免疫传感器重现性良好;在血液模拟环境中加标回收率为96.00%~104.00%,表明电化学免疫传感器具备较好的准确度,具备用于临床检测的潜在价值。Wang等[18]基于MXene设计了一种纸基cTnI电化学免疫传感器,该方法检测限为0.58 μg/L;沈广宇等[19]基于双醛基功能化离子液体构建的cTnI电化学免疫传感器检测限为0.06 μg/L;因此本次构建的检测方法具有更高的灵敏度。
综上所述,本研究基于氧化锌纳米花优异的物理及化学特性,成功构建一种双抗夹心式cTnI电化学免疫传感器,可实现对AMI标志物cTnI的定量检测,提高了cTnI检测灵敏度与特异度。本研究提出的检测方法为AMI早期检测提供了新思路,但该cTnI电化学免疫传感器在实现临床自动化、智能化、批量检测方面仍面临着巨大挑战,在技术的完善、成熟、运用等方面依然需要不断探索。

