喷施亚精胺对淹水胁迫下福建山樱花幼苗生理特性的影响
陆日惠, 周晓星, 唐 丽, 许 琪, 周桂圆, 陈 钏, 盛世红
(1.中南林业科技大学林学院, 湖南 长沙 410004; 2.岳阳市林业科学研究所,湖南 岳阳 414000; 3.农业农村部规划设计研究院,北京 100125; 4.岳阳市林业局,湖南 岳阳 414000)
福建山樱花(Cerasuscampanulata)又名钟花樱桃或山樱花等,为蔷薇科(Rosaceae)樱属(Cerasus)落叶乔木,先花后叶,其花期早,花朵色彩艳丽呈钟状下垂,因其花多色艳而具有重要的观赏价值,是早春时节重要的观赏树种[1]。近年来,作者种植于岳阳市林业科学研究所科研基地的福建山樱花在雨季都出现了水淹现象,导致其生长不良甚至死亡。因此,缓解淹水对福建山樱花的伤害成为一个值得研究的问题。由于全球气候持续变暖,极端天气增多,降水分布不均,常出现短时间内的强降水,导致排水不良,易形成涝害环境,对植物的生长十分不利。改善淹水对植物生长的影响一般采用两种方式,一是改变环境,解除逆境对植物的胁迫,此种方式费时、费工;二是提高植物对逆境的适应性和抵抗能力,如用药剂改变植物的生长方式、生理状态,增强植物对逆境的抵抗能力。亚精胺(Spermidine,简称Spd)是一种能够提高植物对逆境胁迫抵抗能力的生物活性物质[2]。关于喷施Spd调控作物淹水胁迫的研究较多,如调控玉米(Zeamays)[3-5]、小麦(Triticumaestivum)[6]、水稻(Oryzasativa)[7]、大豆(Phaseolusvulgaris)[8]和黄瓜(Cucumissativus)[9]等作物淹水胁迫的研究。另外,喷施亚精胺对淹水胁迫下紫丁香(Syringaoblata)和小叶丁香(Syringamicrophylla)[10]、油茶(Camelliaoleifera)[11]、桃树(Amygdaluspersica)[12]和东北樱桃(Cerasussachalinensis)等产生的伤害[13]具有一定的缓解作用。对淹水敏感的植物在遭遇淹水时,其生长、光合特性及细胞膜系统会受到负面影响,当喷施亚精胺时,植物应对淹水的耐受性会提高[2]。本试验对福建山樱花叶片喷施亚精胺,研究亚精胺是否能缓解淹水胁迫对福建山樱花造成的伤害,为确定福建山樱花生长的适宜环境,促进福建山樱花的推广提供参考。
1 试验区概况
试验地位于湖南省岳阳市林业科学研究所苗圃,地处29°18′E,113°10′N。该区属亚热带湿润季风气候区,年平均气温18.12 ℃,全年无霜期258~275 d;年均降雨量1 200~1 800 mm,降雨量主要集中在4—7月,4—7月的降雨量占全年降雨量的51.27%。
2 材料与方法
2.1 试验材料
福建山樱花种子由浙江省林业科学院提供。2020年10月下旬精选经沙藏破壳一致的福建山樱花种子,播种于底部带孔的32孔穴盘中,每孔1粒种子,播种后置于岳阳市林业科学研究所苗圃养护。
2.2 研究方法
2.2.1 试验设计 2021年8月中旬,选择长势一致、健康的福建山樱花幼苗,采用套盆法开展试验。共设置3种处理,分别为:对照(CK, 正常管理,不进行淹水胁迫)、淹水胁迫(WT, 水位高于基质2 cm)、淹水胁迫+喷施亚精胺(WT+Spd)。详见表1。每种处理15株,共计45株。胁迫时间共12 d,分别于第3、第6、第9、第12天早上8: 00—9: 00取幼苗中上部着生位置大体相同的成熟叶片用于生理指标测定。试验期间,每天17: 00—18: 00喷施亚精胺或清水于植株叶面,以叶片正反面滴水为度。

表1 试验设计
2.2.2 生理指标测定
(1) 叶绿素和类胡萝卜素含量。用打孔器(φ 4 mm)在完全展开的成熟叶片主叶脉两侧区域取样,称取叶片0.1 g,然后将称取的叶片浸没于10 ml 85%的丙酮溶液中,暗中提取,不定时摇晃,直到叶片全部变成白色;以85%的丙酮为对照,用紫外可见光分光光度计(型号:SPECORD 210PLUS)测定叶绿素和类胡萝卜素浓度。设置3个波长(440 nm、645 nm、662 nm)测吸光度,按照以下公式计算叶绿素a(Chla)、叶绿素b(Chlb)和类胡萝卜素(Car)的浓度(mg·L-1)[14]。
Ca=9.78×E662-0.99×E645
(1)
Cb=21.4×E645-4.65×E662
(2)
Cc=4.69×E440-0.268×C(a+b)
(3)
式中:Ca为叶绿素a浓度;Cb为叶绿素b浓度;Cc为类胡萝卜素浓度;E440、E645和E662分别代表提取液在440 nm、645 nm和662 nm处的吸光度。求得各种色素浓度后再计算其含量(mg·g-1)。色素含量(mg·g-1)=(色素浓度×提取液总体积×稀释倍数)/鲜质量。
(2) 其他生理指标测定。可溶性糖(SS)含量测定采用蒽酮比色法;可溶性蛋白(SP)含量测定采用考马斯亮蓝G-250染色法;丙二醛(MDA)含量测定采用硫代巴比妥酸法;过氧化物酶(POD)活性测定采用愈创木酚染色法。这4个指标的测定方法参考《植物生理生化实验原理和技术》[15]。
2.2.3 数据处理 用Excel 2010软件进行数据录入及绘图;用SPSS 22.0软件进行单因素方差分析;用Duncan检验法进行多重比较。
3 结果与分析
3.1 喷施亚精胺对淹水胁迫下福建山樱花叶绿素含量的影响
3.1.1 叶绿素a和叶绿素b含量 如图1 A所示:淹水胁迫处理的Chla含量相对CK处理的均呈先下降后上升再下降的趋势(P<0.05),但WT处理的较WT+Spd处理的下降幅度更大。胁迫至第3天时,WT+Spd和WT处理的分别较CK处理的下降了7.71%、15.53%(P<0.05);胁迫至第6天时,2种胁迫处理的均显著上升,WT+Spd和WT处理的分别较其胁迫至第3天时的上升了30.13%、18.92%;胁迫至第12天时,WT+Spd和WT处理的分别较CK处理的下降了18.69%、26.24%。WT+Spd处理的下降缓慢可能是因为Spd有一定的调节作用,能够缓解淹水胁迫导致的Chla降解。
如图1 B所示:Chlb含量的变化趋势与Chla的基本一致。胁迫至第3天时,WT+Spd和WT处理的Chlb含量相对CK处理的显著(P<0.05)下降,较CK处理的分别下降了10.63%、22.29%;胁迫至第6天时,WT+Spd处理的上升至最大值,较CK处理的上升了27.07%;胁迫至第9天、第12天时,WT+Spd和WT处理的均显著(P<
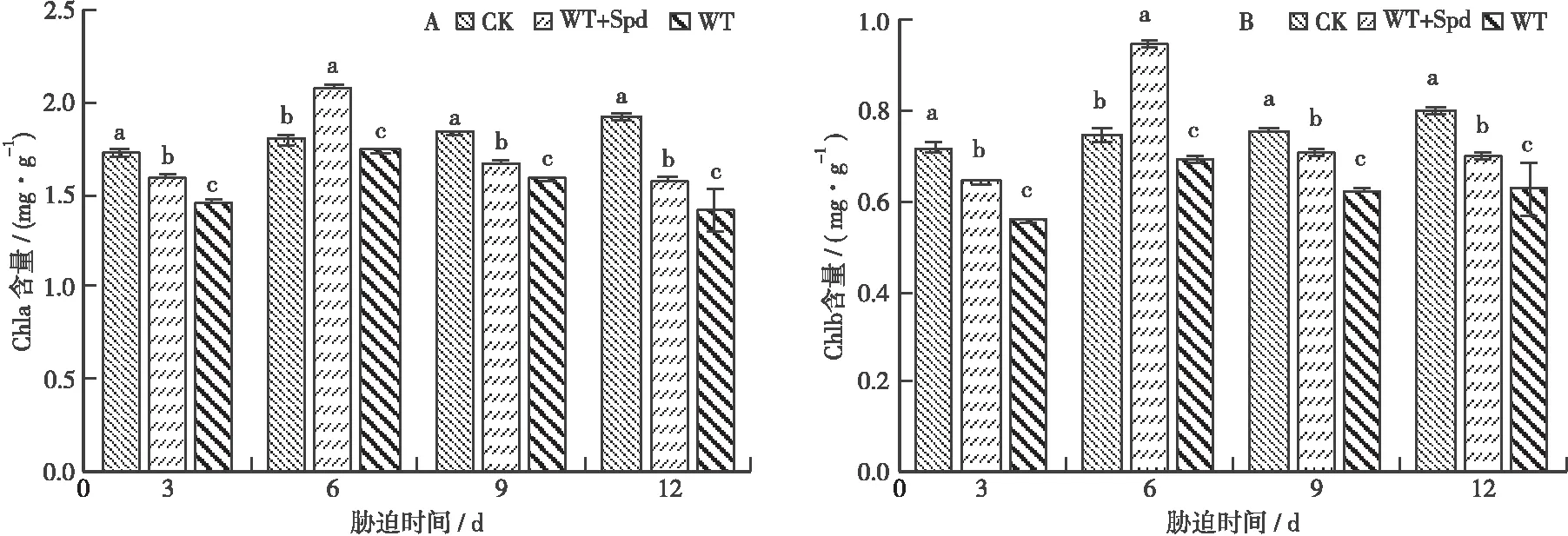
图1 喷施Spd对淹水胁迫下福建山樱花Chla含量和Chlb含量的影响Fig.1 Effect of spraying spermidine on Chla content and Chlb content of C.campanulata under flooding stress注:不同小写字母表示处理间差异显著(P<0.05)。下同。
0.05)低于CK处理的,WT+Spd处理的较CK处理的分别下降了5.96%、12.81%,WT处理的较CK处理的分别下降了17.27%、21.69%。
3.1.2 胡萝卜素含量 Car具有保护叶绿素免受光氧化的功能。如图2所示:WT+Spd和WT处理的Car含量相对CK处理的总体均呈先上升后下降的趋势。胁迫至第6天时,WT+Spd和WT处理的均显著(P<0.05)高于CK处理的,分别较CK处理的上升了2.69%、9.40%。胁迫至第9天时,WT+Spd和WT处理的较CK处理的分别下降了0.70%、1.98%。胁迫至第12天时,WT+Spd和WT处理的均下降至最低水平,分别较CK处理的下降了13.21%、20.14%。
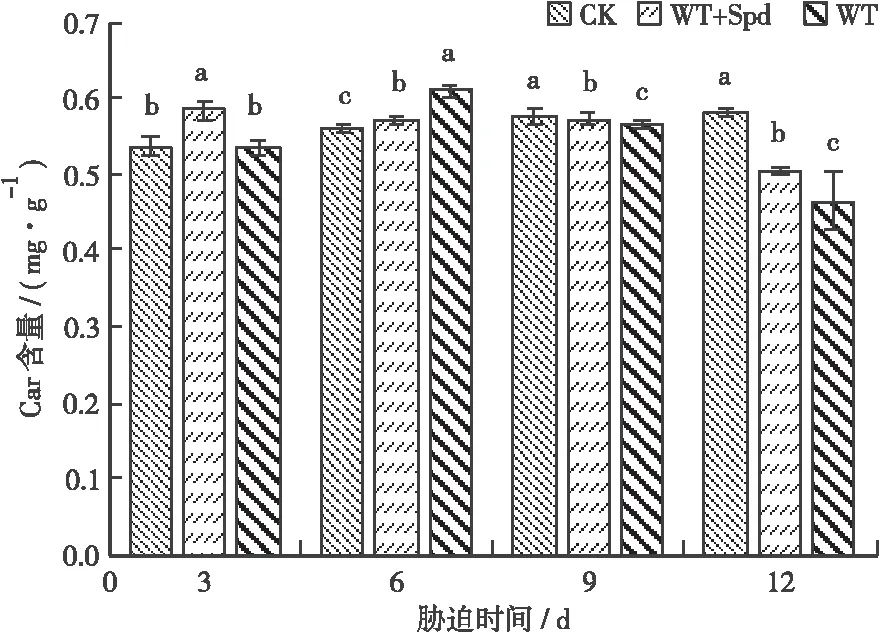
图2 喷施Spd对淹水胁迫下福建山樱花Car含量的影响Fig.2 Effect of spraying spermidine on Car content of C.campanulata under flooding stress
3.1.3 叶绿素(a+b)含量和叶绿素a/b比值 如图3 A所示:Chl(a+b)含量相对CK处理的总体呈下降趋势,变化趋势与Chla和Chlb基本一致。胁迫至第3天时,WT+Spd和WT处理的Chl(a+b)含量分别较CK处理的下降了8.56%、17.51%;胁迫至第6天时,WT+Spd和WT处理的分别较其胁迫至第3天时的上升了35.20%、20.34%;此后,Chl(a+b)含量一直下降。Chl(a+b)含量的变化规律由Chla和Chlb含量共同变化引起,Chla和Chlb含量与Chl(a+b)含量的变化具有同步性。
Chla/b比值反映植物叶片光合活性的强弱[16]。如图3 B所示:WT+Spd和WT处理的Chla/b比值相对CK处理的总体变化趋势均为先上升后下降,在不同的胁迫时间内变化有些差异。胁迫至第3天时,WT+Spd和WT处理的Chla/b比值较CK处理的分别上升了3.26%、8.68%;胁迫至第12天时,WT+Spd和WT处理的较CK处理的分别下降了6.75%、5.28%。

图3 喷施Spd对淹水胁迫下福建山樱花Chl(a+b)含量和Chla/b比值的影响Fig.3 Effect of spraying spermidine on Chl(a+b)content and Chla/b ratio of C.campanulata under flooding stress
3.1.4 类胡萝卜素/叶绿素(a+b)比值 如图4所示:WT处理的Car/Chl(a+b)比值总体呈下降趋势,WT+Spd处理的变化趋势与WT处理的大体一致。胁迫至第3天时,WT+Spd和WT处理的Car/Chl(a+b)比值分别较CK处理的上升了19.26%、21.01%。胁迫至第9、第12天时,WT+Spd和WT处理的Car/Chl(a+b)比值相对CK处理的均呈上升趋势;WT+Spd处理的分别较CK处理的上升了7.85%、4.51%,WT处理的分别较CK处理的上升了15.06%、6.24%。说明淹水胁迫降低了Car含量,且Car降解速率慢于Chl(a+b),因此提高了Car/Chl(a+b)的比值。
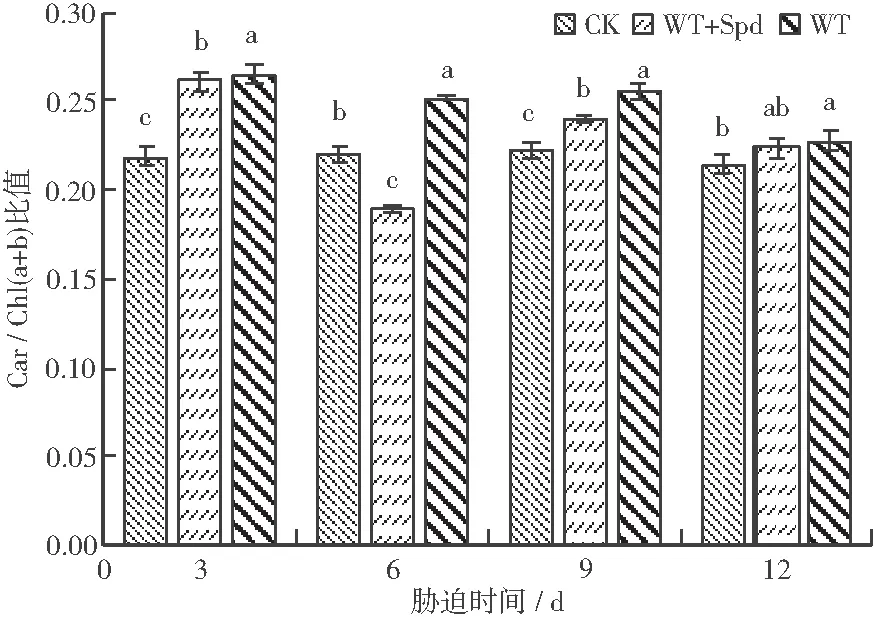
图4 喷施Spd对淹水胁迫下福建山樱花Car/Chl(a+b)比值的影响Fig.4 Effect of spraying spermidine on Car/Chl(a+b) of C.campanulata under flooding stress
3.2 喷施亚精胺对淹水胁迫下福建山樱花可溶性糖和可溶性蛋白含量的影响
3.2.1 可溶性糖含量 可溶性糖是植物组织中调节细胞渗透平衡的重要物质[17]。如图5 A所示:WT处理的SS含量相对CK处理的呈上升趋势,前期上升缓慢,后期急速上升;WT+Spd处理的与WT处理的变化趋势一致,但上升速度较慢,与CK处理的差异显著(P<0.05)。胁迫至第3天时,WT+Spd和WT处理的较CK处理的分别上升了12.88%、35.76%;胁迫至第12天时,WT+Spd和WT处理的分别较CK处理的上升了13.44%、49.27%,WT+Spd处理的较WT处理的下降了24.00%。
3.2.2 可溶性蛋白含量 如图5 B所示:WT处理的SP含量相对CK处理的不断上升,WT+Spd处理的较WT处理的上升相对较缓慢。胁迫至第3天时,WT+Spd和WT处理的较CK处理的分别上升了61.33%、193.22%;胁迫至第9、12天时,与CK处理的相比,WT处理的分别上升了230.57%和353.67%(P<0.05),WT+Spd处理的分别上升了94.51%、205.38%(P<0.05),WT+Spd处理的比WT处理的分别低41.16%、32.69%。
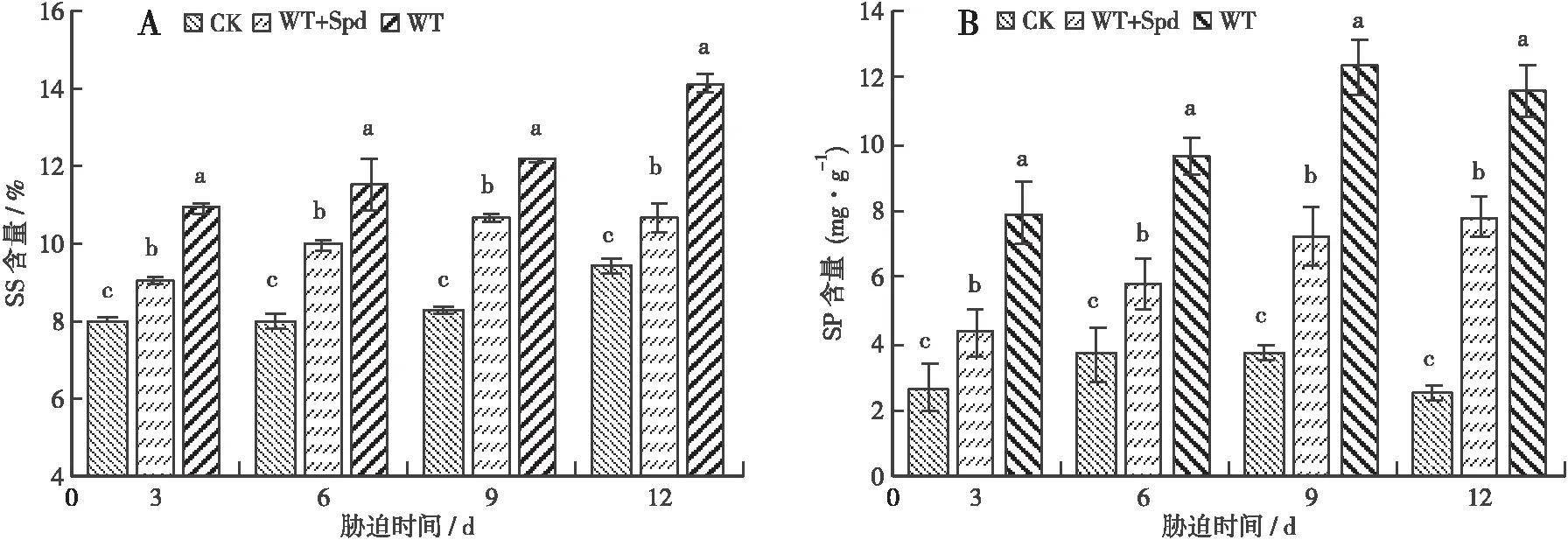
图5 喷施Spd对淹水胁迫下福建山樱花SS含量和SP含量的影响Fig.5 Effect of spraying spermidine on soluble sugar content and souluble protein content of C.campanulata under flooding stress
3.3 喷施亚精胺对淹水胁迫下福建山樱花丙二醛含量和过氧化物酶活性的影响
3.3.1 丙二醛含量 如图6 A所示:随着淹水胁迫时间的延长,胁迫处理的MDA含量均呈上升趋势,与CK处理的差异显著(P<0.05)。胁迫至在第3、第6、第9和第12天时,与CK处理的相比,WT处理的MDA含量分别上升了46.45%、52.05%、72.04%和96.48%(P<0.05),WT+Spd处理的分别上升了30.90%、30.12%、29.80%和78.67%(P<0.05), WT+Spd处理的较WT处理的上升缓慢。
3.3.2 过氧化物酶活性 如图6 B所示:WT处理的POD活性呈先上升后下降的趋势,与CK处理的差异显著(P<0.05),而WT+Spd处理的则一直呈上升的趋势。胁迫至第3、第6、第9天时,WT处理的较CK处理的分别上升了55.81%、96.78%、162.84%;胁迫至第12天时,WT处理的较其胁迫至第9天时的下降了42.61%(P<0.05),但仍比CK处理的高16.57%。胁迫至第3、第6、第9和第12天时,WT+Spd处理的较CK处理的分别上升了23.53%、35.74%、100.68%和80.48%(P<0.05),说明喷施Spd在一定程度上提高了POD活性。
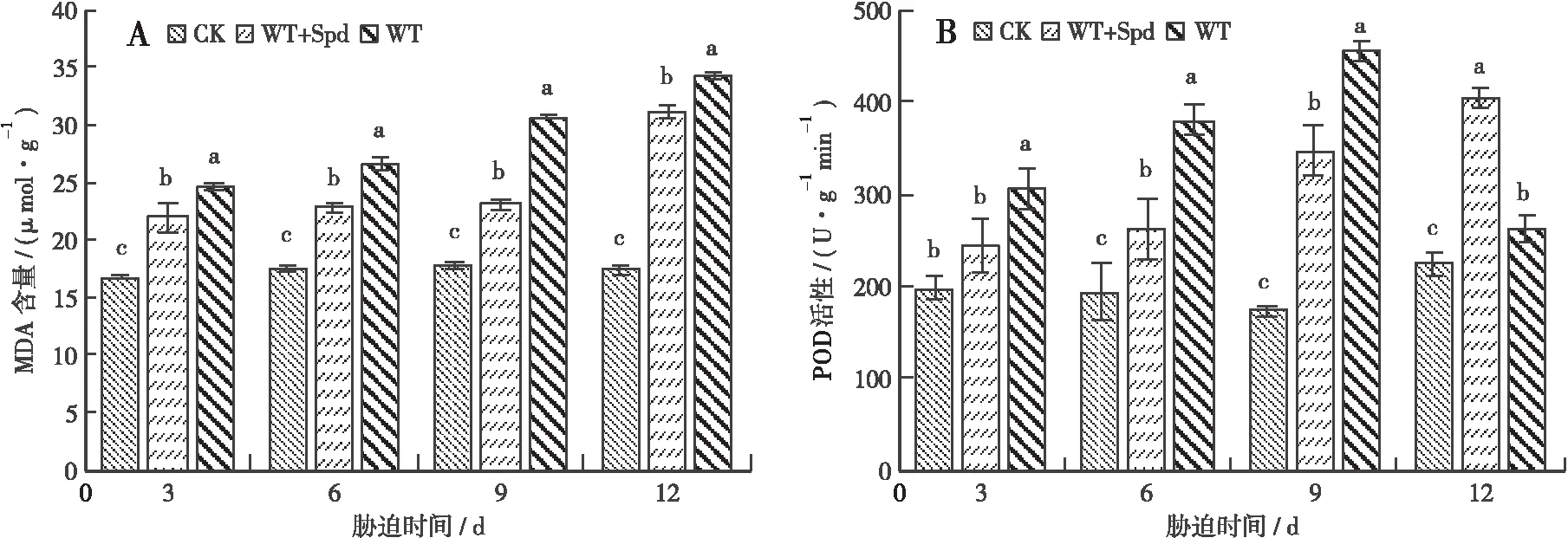
图6 喷施Spd对淹水胁迫下福建山樱花MDA含量和POD活性的影响Fig.6 Effect of spraying spermidine on MDA content and POD activity of C.campanulata under flooding stress.
4 结论与讨论
(1) 叶绿素是植物体内普遍存在的色素,也是光合作用中重要的吸光色素。研究表明,水分胁迫会导致植物光合色素含量及组成比例发生改变[18-20]。Chla和Chlb都可以吸收光能,但只有少数特殊状态的Chla可以将光能转换为电能[21];Chlb决定植物可吸收的波长(460~645 nm)[22];Car可清除逆境中植物产生的活性氧自由基,使光合反应中心免遭破坏[23]。本试验中,淹水胁迫降低了福建山樱花叶片中叶绿素含量,其中Chla含量的下降速率大于Chlb含量的,因此,Chla/b的比值降低了。淹水胁迫至第12天时,淹水胁迫处理的Chla含量和Chlb含量分别较CK处理的下降了26.24%、21.69%。这可能是因为Chla比Chlb对淹水胁迫更敏感[24],也有可能是Chla的降解产物可以促进Chlb的产生[25],这样Chlb可以在Chla的降解过程中得到补偿。淹水胁迫也降低了Car的含量,并且Chl(a+b)的降解速率快于Car的,淹水胁迫至第12天时,淹水胁迫处理的Chl(a+b)和Car含量分别较CK处理的下降了24.90%、20.14%,因此Car/Chl(a+b)的比值提高了,这可能是福建山樱花应对淹水胁迫的一种保护机制。喷施Spd前期,福建山樱花的Chl(a+b)和Car含量有所增加,随后缓慢下降,并提高了Chla/b的比值。这可能是因为Spd能调节淹水胁迫下福建山樱花叶绿素生物合成和分解代谢相关酶的活性,延缓了叶绿素的分解和代谢[26]。
(2) 植物渗透调节物质可在植物叶片失去膨压,体内水势、渗透势降低时发生调节作用。本试验中,淹水胁迫下喷施Spd仍能增加SS含量,但是上升幅度较不喷施Spd仅淹水处理的小,如淹水胁迫至第12天时,WT+Spd处理(淹水+喷施Spd)和WT处理(淹水)的SS含量分别较CK处理的上升了7.97%、29.21%,说明Spd对缓解淹水胁迫下福建山樱花SS含量的变化有效果。这一结果与尤东玲等[3]对玉米研究的结果一致。
(3)植物遭遇淹水胁迫时体内会积累可溶性蛋白,以平衡细胞的吸水和保水。本试验中,WT+Spd处理的福建山樱花SP含量明显低于WT处理的,淹水胁迫至第12天时,WT+Spd处理的SP含量比WT处理的低11.24%。说明随着淹水时间的延长,福建山樱花受到的伤害越大;喷施Spd能缓慢提高福建山樱花SP含量,以维持细胞较低的渗透势,在一定程度上抑制或减轻淹水胁迫对福建山樱花的伤害,这与刘聪聪[27]对番茄(Solsnumlycopersicum)的研究结果一致。
(4)植物细胞内过量的MDA会造成其膜损伤和脂质过氧化。本试验中,相对CK处理,WT+Spd处理的MDA含量较WT处理的上升缓慢,说明喷施Spd使MDA含量减少,抑制了MDA对氧化的损伤作用。喷施Spd对于保护细胞膜系统和清除淹水胁迫下福建山樱花所产生的膜脂过氧化物有一定的作用。这一结果与黄金富等[2]对油茶在淹水胁迫下喷施Spd的研究结果相似。
(5)缺氧或少氧环境下会导致植株活性氧的过量积累[28]。本试验中,在淹水胁迫的前9天,WT+Spd处理较WT处理在一定程度上降低了福建山樱花的POD活性,但淹水胁迫至第12天时,WT+Spd处理的POD活性仍呈上升趋势,较CK处理的上升了80.48%,而WT处理的则明显下降,较其胁迫至第9天时的下降了42.61%。WT+Spd处理的POD活性上升可能是因为Spd降低了活性氧数量,提高了福建山樱花淹水适应能力,这与王双玥琪[13]对东北山樱的研究结果一致。WT处理的POD活性在后期下降可能是因为福建山樱花不能继续抵抗淹水胁迫对其的伤害。有研究[29]表明,淹水胁迫造成桐花树(Aegicerascorniculatum)的POD活性先升后降,与本研究的结果一致。

