铁皮石斛水提物对4T1乳腺癌荷瘤小鼠的抑瘤及免疫调节作用研究
牛壮伟,颜美秋,苏 洁,汪晨兴,韩丽萍,施梦琳,俞静静,陈素红,吕圭源*
铁皮石斛水提物对4T1乳腺癌荷瘤小鼠的抑瘤及免疫调节作用研究
牛壮伟1,颜美秋1,苏 洁1,汪晨兴1,韩丽萍1,施梦琳1,俞静静1,陈素红2*,吕圭源1*
1. 浙江中医药大学药学院,浙江 杭州 310053 2. 浙江工业大学,浙江 杭州 310014
研究铁皮石斛水提物对4T1乳腺癌荷瘤模型小鼠的抑瘤及免疫调节作用,并进一步探讨其作用机制。采用BALB/c雌性小鼠构建4T1乳腺癌荷瘤小鼠模型后,随机分为模型组、盐酸表柔比星组(8 mL/kg)和铁皮石斛水提物低、中、高剂量(0.5、1.0、1.5 g/kg)组,另选10只正常BALB/c雌性小鼠作为对照组,给予相应药物进行干预,观察小鼠生存状态,每3天测量肿瘤直径与短径,连续给药28 d后处死小鼠,称定肿瘤质量,计算抑瘤率;采用小动物活体成像仪和转移灶计数观察肺部肿瘤转移情况;称定小鼠脾脏、胸腺质量,计算脏器系数;苏木素-伊红(HE)染色观察肿瘤、肺部以及脾脏形态学变化;血液分析仪检测荷瘤小鼠外周血中白细胞数目和淋巴细胞占比;ELISA法检测血清中白细胞介素-2(interleukin-2,IL-2)、γ干扰素(interferon-γ,IFN-γ)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平;流式细胞术检测外周血中T淋巴细胞比例;脾淋巴细胞增殖试验检测脾脏中T淋巴细胞、B淋巴细胞增殖能力;Western blotting检测肿瘤组织中磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路相关蛋白表达。与模型组比较,铁皮石斛水提物组小鼠肿瘤生长趋势放缓,肿瘤质量减轻(<0.01),肿瘤组织坏死细胞增多,肿瘤以及肺部转移灶荧光强度显著降低(<0.05、0.01),肺部转移灶数目减少(<0.05、0.01);脾脏、胸腺指数增加(<0.05);外周血中白细胞数目下降(<0.01),淋巴细胞占比提高(<0.05、0.01);血清中IL-2、IFN-γ、TNF-α水平增加(<0.05、0.01);外周血中CD3+T细胞占比升高(<0.05),CD4+/CD8+值上升(<0.01);脾脏中T淋巴细胞、B淋巴细胞增殖能力提高(<0.05);肿瘤组织中PI3K/Akt/mTOR通路相关蛋白表达降低(<0.05、0.01)。铁皮石斛水提物可显著抑制荷瘤小鼠肿瘤的生长与转移,恢复荷瘤小鼠免疫功能,其机制可能与下调PI3K/Akt/mTOR通路表达相关。
铁皮石斛;乳腺癌;免疫调节;T淋巴细胞;PI3K/Akt/mTOR信号通路
据国际权威癌症研究中心最新发布数据表明,恶性肿瘤已成为造成人类死亡的首要原因。乳腺癌是其中发病率最高的恶性肿瘤之一,每年预估新发病例230万人,且发病率呈低龄化、快增长的趋势[1]。目前,临床上对恶性肿瘤的治疗方式常以放化疗为主,但现有化疗药物在抑制肿瘤生长同时对机体免疫系统产生不同程度的破坏,从而严重影响患者的生存质量,在一定程度上限制了临床应用范围和长期使用[2]。因此,寻找安全有效辅助抗肿瘤药物亟为重要。
《医宗必读》曰:“积之成也,正气不足,而后邪气踞之”。中医学认为“正气内虚”是肿瘤发生的内在病机[3]。因此,扶正补虚是中医药治疗肿瘤的基本原则。扶助正气,补益虚弱,可达到实现提高机体免疫功能、加强抵御和祛除病邪能力、抑制肿瘤发生发展、改善患者临床症状的目的。铁皮石斛为兰科植物铁皮石斛Kimura et Migo的干燥茎,其主要活性成分为多糖、联苄、黄酮、生物碱等化学成分。现代药理学研究表明,铁皮石斛具有增强免疫、调节基础代谢及辅助抗肿瘤等作用[4-7]。本研究以4T1乳腺癌荷瘤模型小鼠为研究对象,初步探讨铁皮石斛水提物对荷瘤小鼠的抑瘤作用及其免疫功能的影响,分析铁皮石斛抗乳腺癌的分子机制,为其进一步应用于肿瘤临床治疗提供实验依据。
1 材料
1.1 细胞株
4T1-luc鼠源乳腺癌细胞株由浙江中医药大学高建莉研究员惠赠。用含10%胎牛血清和1%双抗的DMEM培养基,于37 ℃、5% CO2的培养箱中培养,每2~3天传代1次。
1.2 动物
SPF级雌性BALB/c小鼠60只,体质量(20±2)g,购自浙江维通利华实验动物技术有限公司,动物许可证号SCXK(浙)2020-0002。动物饲养于浙江中医药大学实验动物中心SPF级动物实验室,室温(25±2)℃,相对湿度(55±5)%,自然昼夜节律光照环境下自由进食饮水,适应性喂养1周后开始实验。动物实验经浙江中医药大学实验动物管理与伦理委员会批准(批准号ZSLL-2017-023)。
1.3 药材
铁皮石斛由浙江韵芝堂生物科技有限公司提供,经浙江中医药大学黄真教授鉴定为兰科植物铁皮石斛Kimura et Migo的干燥茎。
1.4 药品与试剂
注射用盐酸表柔比星(批号DP2202)购自辉瑞制药有限公司;Anti-Mouse CD3e(批号A20125)、Anti-Mouse CD45(批号A10734)、Anti-Mouse CD8a(批号A10843)、Anti-Mouse CD4(批号A10755)、白细胞介素-2(interleukin-2,IL-2)ELISA试剂盒(批号A202H11231)、γ干扰素(interferon-γ,IFN-γ)ELISA试剂盒(批号A280H10842)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(批号A282H11225)购自杭州联科生物技术股份有限公司;刀豆蛋白A(Con A,批号317T033)购自北京索莱宝科技有限公司;脂多糖(lipopolysaccharide,LPS,批号21145395)购自北京兰杰柯科技有限公司;电泳液(批号121120210422)、转膜液(批号022021219719)购自碧云天生物技术研究所;磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)抗体(批号42527P)、p-PI3K抗体(批号4228L)、蛋白激酶B(protein kinase B,Akt)抗体(批号4691T)、p-Akt抗体(批号4060T)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抗体(批号2983P)购自美国CST公司;兔源β-actin抗体(批号B9901)购自美国Immuno Way公司;HRP标记的山羊抗兔IgG抗体(批号HP0119)购自杭州华安生物科技有限公司;D-荧光素钾盐(批号K903568)购自上海笛柏生物科技有限公司。
1.5 仪器
LSRFortessa流式细胞分析仪(美国BD公司);UV-3600型紫外可见近红外光谱仪(日本岛津公司);Aniview600型多模式动物活体成像仪(广州博鹭腾生物科技有限公司);XT-2000i型全自动血液分析仪(日本SYSMEX株式会社);Tissue-TekVIP5Jr型自动脱水机(日本樱花检验仪器株式会社);MEIKOEC360型包埋机(德国MEIKO公司);LeicaM2245型半自动切片机(德国Leica公司);FLIR ONE Pro热成像仪(美国FLIR公司);Powerwave 340型酶标仪(美国Bio-Tek公司);EPS300型电泳仪(上海天能科技有限公司);QuickChemi5200型化学发光成像仪(杭州莫纳生物科技有限公司)。
2 方法
2.1 铁皮石斛水提物的制备
取铁皮石斛适量,加入12倍量水浸泡30 min,煎煮1 h,滤过;药渣同法再煎煮1次,合并滤液,60 ℃减压浓缩至0.1 g/mL。采用苯酚-硫酸法测定0.1 g/mL的铁皮石斛水提物中总多糖含量,紫外检测波长为488 nm。以葡萄糖标准品质量浓度为横坐标(),吸光度()为纵坐标(),线性回归方程为=0.057 5-0.006 1(2=0.998 1),计算得出铁皮石斛水提物中总多糖质量浓度为(14.93±0.40)mg/mL。临用前用超纯水稀释至给药剂量。
2.2 荷瘤小鼠模型建立
在每只小鼠的右侧倒数第二脂肪垫皮肤部位进行脱毛,在小鼠脱毛部位sc 0.1 mL 4T1-luc乳腺癌细胞(5×106个/mL),48 h后观察接种部位若有2 mm×2 mm粉红色小突起,即表明4T1乳腺癌荷瘤小鼠造模成功。随机选取10只正常小鼠在相应部位sc 0.1 mL生理盐水作为对照组。
2.3 分组与给药
4T1乳腺癌荷瘤小鼠模型构建成功后,根据小鼠体质量和结节大小,随机分为模型组、盐酸表柔比星(EPI,8 mL/kg)组和铁皮石斛低、中、高剂量(0.5、1.0、1.5 g/kg)组,每组10只。铁皮石斛组ig铁皮石斛水提物,对照组和模型组ig等体积纯水,1次/d;EPI组ip药物,1次/周,连续给药28 d。给药期间,观察小鼠体质量、精神状态、毛发、行动等一般指征情况,通过FLIR-Tools热成像仪观察小鼠体表温度。
2.4 检测肿瘤生长体积和抑瘤率
从给药第1天起,每3天用游标卡尺测量1次荷瘤小鼠的肿瘤长径()和短径(),计算肿瘤体积并绘制肿瘤生长曲线。末次给药24 h后,颈椎脱臼处死小鼠,剥离肿瘤称定质量(),计算各给药组抑瘤率。
肿瘤体积=(×2)/2
抑瘤率=1-给药/模型
2.5 小动物活体成像和肺部转移灶计数检测肺部肿瘤转移
给药4周后,各组小鼠ip D-荧光素钾盐(150 mg/kg),使用异氟烷对小鼠进行麻醉,10 min后将其置于小动物活体成像仪中,检测荷瘤小鼠肺部肿瘤转移情况,使用Anview软件对肺部转移灶的荧光值进行定量评价。
末次给药24 h后,颈椎脱臼处死小鼠,摘取小鼠肺脏,用生理盐水冲洗表面血迹,10%福尔马林溶液灌注固定24 h后,计算肺部表面转移灶数目。本研究采用的转移灶评级为4级:I级,直径<0.5 mm;II级,0.5 mm≤直径<1 mm;III级,1 mm≤直径<2 mm;IV级,直径≥2 mm。
总转移数=I级结节个数×1+II级结节个数×2+III级结节个数×3+IV级结节个数×4
2.6 苏木素-伊红(HE)染色观察肿瘤、肺部和脾脏组织病理变化
取各组小鼠肿瘤、肺部、脾脏组织放入10%福尔马林溶液固定48 h后,脱水、包埋、切片、HE染色、封片,最后于显微镜下观察形态学变化。
2.7 脾脏和胸腺指数测定
末次给药24 h后,颈椎脱臼处死小鼠,摘取小鼠脾脏、胸腺,称定质量,计算脏器系数。
脏器系数=脏器质量/体质量
2.8 血液分析仪检测外周血中白细胞数目及淋巴细胞占比
给药3周后,小鼠眼眶取血,置于EDTA抗凝管中,使用全自动血液分析仪测定小鼠外周血中白细胞数目及淋巴细胞占比。
2.9 ELISA法检测血清中细胞因子水平
末次给药24 h后,小鼠眼眶取血,3500 r/min离心15 min,分离血清,按照ELISA试剂盒说明书检测血清中IL-2、TNF-α和IFN-γ水平。
2.10 流式细胞术检测外周血中T淋巴细胞的比例
给药3周后,小鼠眼眶取血,取50 μL置于流式管中,设置空白管、单染管、样本管。空白管不加抗体、单染管加入相对应的抗体,样本管加入抗体FITC-CD45、VF450-CD3、PE-cy7-CD4、Percp5.5-CD8混匀,4 ℃避光孵育15 min,加入1×Lysing Buffer,4 ℃避光孵育20 min,1500 r/min离心5 min,弃上清,加入350 µL PBS重悬后,上机检测CD3+、CD4+、CD8+细胞,并计算CD4+/CD8+值。
2.11 脾脏淋巴细胞增殖实验
无菌摘取各组小鼠1/3脾脏,过200目细胞筛,加入2 mL红细胞裂解液,室温裂解15 min,1500 r/min离心5 min,弃上清,用RPMI 1640完全培养基清洗2次,调整脾细胞密度为5×106个/mL。设置ConA刺激组、LPS刺激组、空白组,分别加入含ConA(10 µg/mL)的RPMI 1640完全培养基、含LPS(20 µg/mL)的RPMI 1640完全培养基、RPMI 1640完全培养基100 µL,每组重复3次,于37 ℃、5% CO2培养箱中培养48 h后,每孔加入10 µL CCK-8溶液,孵育2 h,采用酶标仪于450 nm处检测各孔值。小鼠淋巴细胞的增殖能力用刺激指数(SI)表示。
SI=实验/空白
2.12 Western blotting检测肿瘤组织中PI3K/Akt/ mTOR通路相关蛋白表达
取各组小鼠冻存肿瘤组织,加入RIPA裂解液提取蛋白,经BCA法测定蛋白浓度,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,封闭后,分别加入p-PI3K、PI3K、p-Akt、Akt、mTOR抗体(1∶1000),4 ℃孵育过夜;PBST漂洗3次后,加入二抗,室温摇床孵育2 h,PBST漂洗3次后,进行ECL显色曝光,通过Image J软件分析各目的条带的灰度值。
2.13 统计学分析
3 结果
3.1 铁皮石斛水提物对荷瘤小鼠体质量和体温的影响
如图1-A所示,与对照组比较,模型组小鼠自第3天体质量开始显著下降(<0.05、0.01),精神状态及毛发欠佳;与模型组比较,EPI组小鼠第6天体质量开始显著下降(<0.01),毛发干枯掉落、动作迟缓、精神萎靡,并出现死亡情况;铁皮石斛水提物组小鼠体质量无显著差异,毛发无明显改变、无死亡现象;与EPI组比较,铁皮石斛水提物组小鼠体质量显著增加(<0.01)。如图1-B、C所示,Bx1区域为小鼠腹部区域,与对照组比较,模型组小鼠Bx1区域平均温度升高;与模型组比较,各给药组小鼠Bx1区域平均温度均显著降低(<0.05、0.01)。

C-各组小鼠体表红外热感图 DOE-铁皮石斛水提物 与对照组比较:#P<0.05 ##P<0.01;与模型组比较:**P<0.01 *P<0.05;与EPI组比较:△△P<0.01,下图同
3.2 铁皮石斛水提物对荷瘤小鼠肿瘤生长的影响
如图2所示,与模型组比较,各给药组小鼠自第18天起肿瘤生长速度放缓,肿瘤体积明显减小;给药4周后,各给药组小鼠肿瘤质量较模型组显著降低(<0.01),铁皮石斛水提物低、中、高剂量组平均抑瘤率分别为20.83%、23.32%、23.17%。
3.3 铁皮石斛水提物对荷瘤小鼠肿瘤组织病理变化的影响
如图3所示,模型组小鼠肿瘤组织中肿瘤细胞数目丰富,排列无序且密集,肿瘤细胞呈实性片状弥散性分布,胞质嗜酸性,核大深染,基本无坏死灶;EPI组肿瘤细胞数量明显减少,肿瘤细胞胞质破裂、胞核溶解,肿瘤细胞坏死区域较大;铁皮石斛水提物组小鼠中均发现肿瘤细胞数目减少,排列稀疏,出现明显细胞凋亡,组织结构破损,可见大量坏死细胞。
3.4 铁皮石斛水提物对荷瘤小鼠肺部转移的影响
小动物活体成像结果(图4)显示,与模型组比较,EPI组和铁皮石斛水提物中、高剂量组小鼠肺部肿瘤转移灶荧光强度显著减弱(<0.05、0.01)。肺脏转移灶数(图5)显示,模型组小鼠表面白色隆起转移灶直径多为IV级,且转移灶数目多;铁皮石斛水提物组肺部表面白色隆起转移灶数直径多为II、III级,且转移灶数目显著减少(<0.05、0.01)。
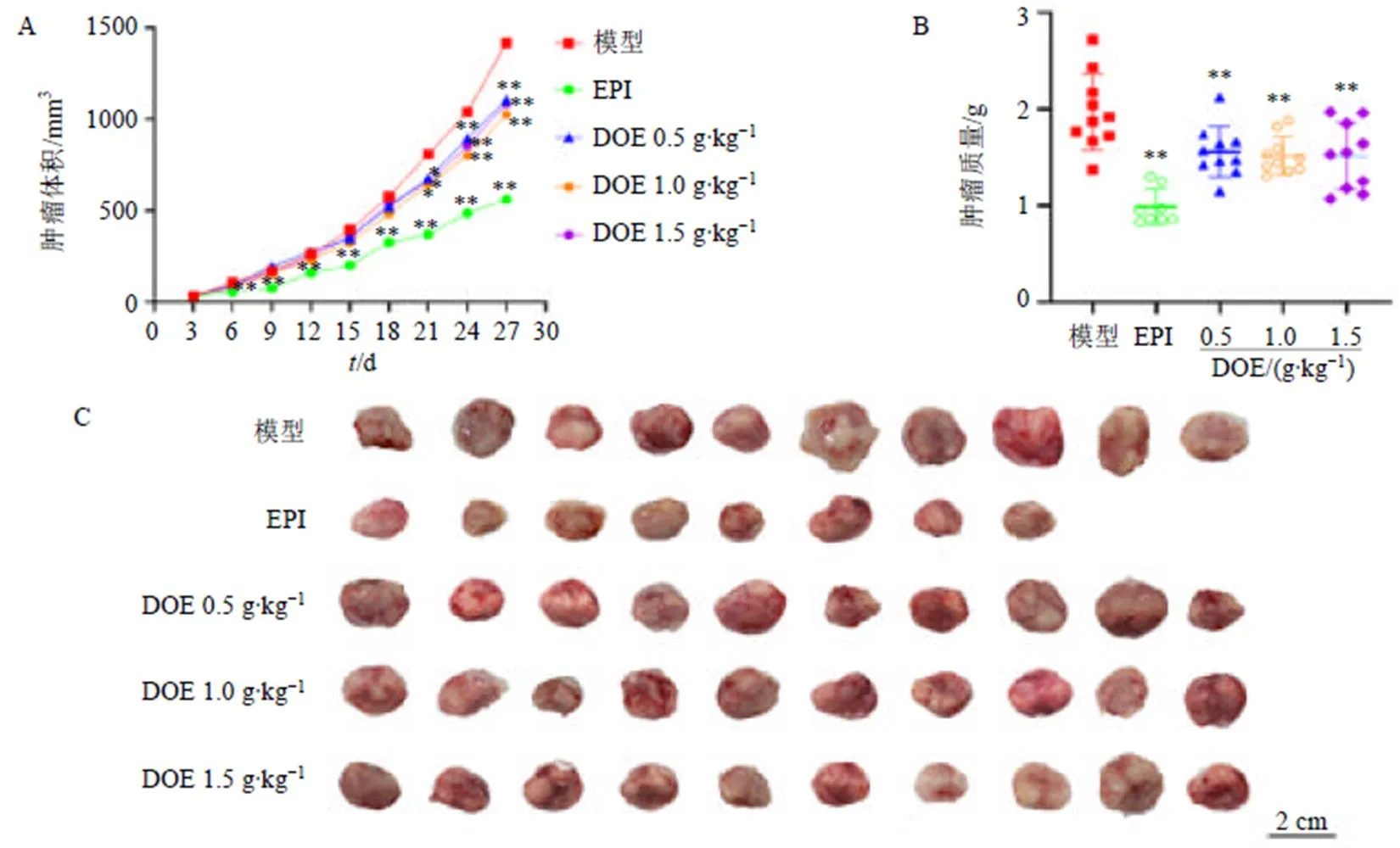
A-肿瘤体积 B-肿瘤重量 C-肿瘤形态学观察
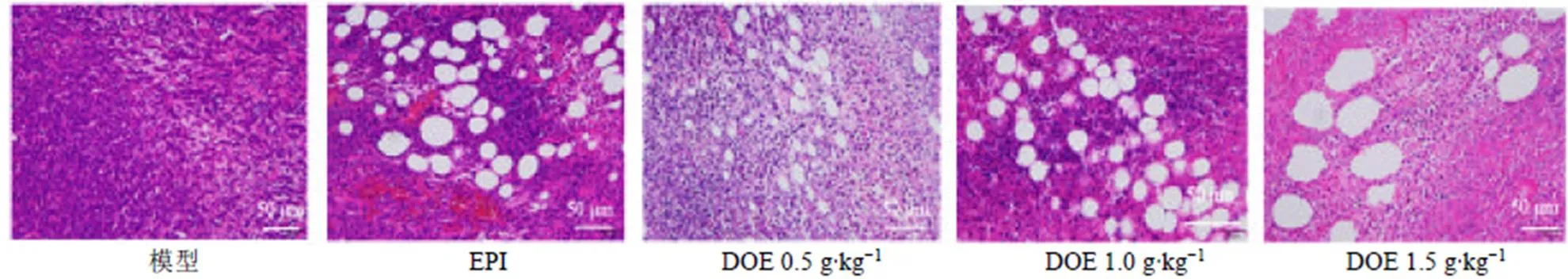
图3 铁皮石斛水提物对荷瘤小鼠肿瘤组织病理变化的影响(HE, ×200)

图4 铁皮石斛水提物对荷瘤小鼠肿瘤荧光强度的影响(, n = 3)

箭头所指即为肺部表面转移灶
3.5 铁皮石斛水提物对荷瘤小鼠肺部组织病理变化的影响
如图6所示,模型组小鼠肺部转移灶成团状增生,边缘可见多个转移的癌细胞灶,转移面积大,肺部癌细胞浸润较多;铁皮石斛水提物组小鼠肺部肿瘤转移灶区域面积减少,肺部癌细胞浸润减少。
3.6 铁皮石斛水提物对荷瘤小鼠脾脏指数和胸腺指数的影响
如表1所示,与对照组比较,模型组小鼠脾脏指数显著升高(<0.01),胸腺指数显著降低(<0.01);与模型组比较,EPI组小鼠脾脏指数和胸腺指数均显著降低(<0.01),铁皮石斛水提物各剂量组小鼠脾脏指数均显著升高(<0.05),铁皮石斛水提物中剂量组胸腺指数显著升高(<0.05);与EPI组比较,铁皮石斛水提物各剂量组小鼠脾脏指数和胸腺指数均显著升高(<0.01)。
3.7 铁皮石斛水提物对荷瘤小鼠脾脏组织病理变化的影响
如图7所示,对照组小鼠脾脏组织红髓与白髓分界清晰,可见较窄边缘区,细胞排列整齐紧密;模型组小鼠脾脏组织白髓与红髓边缘分界不清,边缘区增宽;与模型组比较,各给药组小鼠脾脏组织红白髓交界清楚。
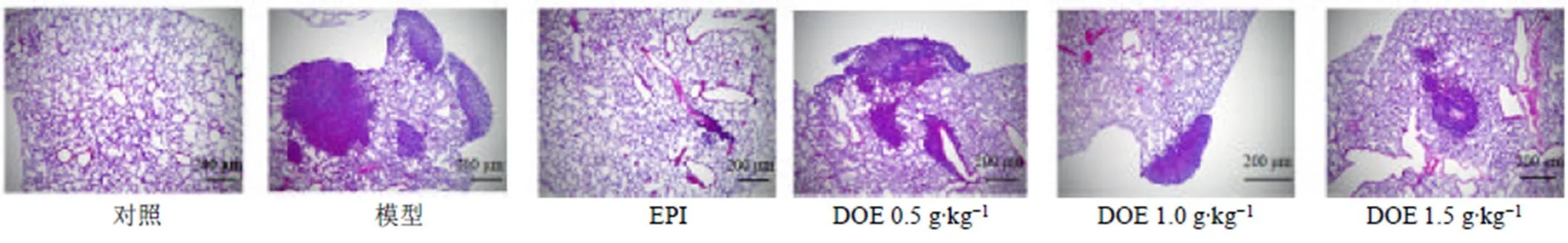
图6 铁皮石斛水提物对荷瘤小鼠肺部组织病理变化的影响(HE, ×40)

表1 铁皮石斛水提物对荷瘤小鼠脾脏指数和胸腺指数的影响()
与对照组比较:#<0.05##<0.01;与模型组比较:**<0.01*<0.05;与EPI组比较:△△<0.01,下表同
#< 0.05##< 0.01control group;*< 0.05**< 0.01model group;△△< 0.01EPI group, same as below tables

图7 铁皮石斛水提物对荷瘤小鼠脾脏组织病理变化的影响(HE, ×200)
3.8 铁皮石斛水提物对荷瘤小鼠白细胞数目和淋巴细胞占比的影响
如图8所示,与对照组比较,模型组小鼠外周血中白细胞数量显著升高(<0.01),淋巴细胞占比显著降低(<0.01);与模型组比较,各给药组外周血中白细胞数量显著降低(<0.01),EPI组淋巴细胞占比显著降低(<0.01),铁皮石斛水提物中、高剂量组淋巴细胞占比显著升高(<0.05、0.01);与EPI组比较,铁皮石斛水提物各剂量组小鼠外周血中白细胞数量和淋巴细胞占比均显著升高(<0.01)。
3.9 铁皮石斛水提物对荷瘤小鼠血清中细胞因子水平的影响
如表2所示,与对照组比较,模型组小鼠血清中IL-2、IFN-γ和TNF-α水平均显著降低(<0.05、0.01);与模型组比较,铁皮石斛水提物各剂量组小鼠血清中IL-2、IFN-γ、TNF-α水平均显著升高(<0.05、0.01);与EPI组比较,铁皮石斛水提物各剂量组小鼠血清中IL-2、IFN-γ、TNF-α水平均显著升高(<0.01)。

图8 铁皮石斛水提物对荷瘤小鼠外周血中白细胞数目和淋巴细胞占比的影响(, n = 8~10)

表2 铁皮石斛水提物对荷瘤小鼠血清中细胞因子水平的影响()
3.10 铁皮石斛水提物对荷瘤小鼠外周血中T淋巴细胞比例的影响
如图9和表3所示,与对照组比较,模型组小鼠外周血中CD3+占比显著下降(<0.01),CD4+/CD8+呈下降趋势;与模型组比较,EPI组CD4+占比和CD4+/CD8+均显著降低(<0.05、0.01),铁皮石斛水提物中剂量组CD3+占比显著上升(<0.05),铁皮石斛水提物各剂量组小鼠外周血中CD4+占比和CD4+/CD8+显著上升(<0.05、0.01),铁皮石斛水提物低、中剂量组CD8+占比显著下降(<0.01);与EPI组比较,铁皮石斛水提物各剂量组CD4+占比和CD4+/CD8+显著上升(<0.01),CD8+占比显著下降(<0.01),铁皮石斛水提物中剂量组CD3+占比显著上升(<0.01)。
3.11 铁皮石斛水提物对荷瘤小鼠脾淋巴增殖能力的影响
如图10所示,与模型组比较,EPI组小鼠脾脏T、B淋巴细胞增殖能力显著降低(<0.05),铁皮石斛水提物中剂量组小鼠脾脏T、B淋巴细胞增殖能力显著升高(<0.05);与EPI组比较,铁皮石斛水提物各剂量组小鼠T、B淋巴细胞增殖能力均显著升高(<0.01)。
3.12 铁皮石斛水提物对荷瘤小鼠肿瘤组织PI3K/Akt/mTOR通路相关蛋白表达的影响
如图11所示,与模型组比较,铁皮石斛水提物中剂量组小鼠肿瘤组织中p-PI3K、PI3K、p-Akt、Akt、mTOR蛋白表达水平均显著降低(<0.05、0.01)。

图9 铁皮石斛水提物对荷瘤小鼠外周血中T淋巴细胞亚群的影响

表3 铁皮石斛水提物对荷瘤小鼠T淋巴细胞的影响()
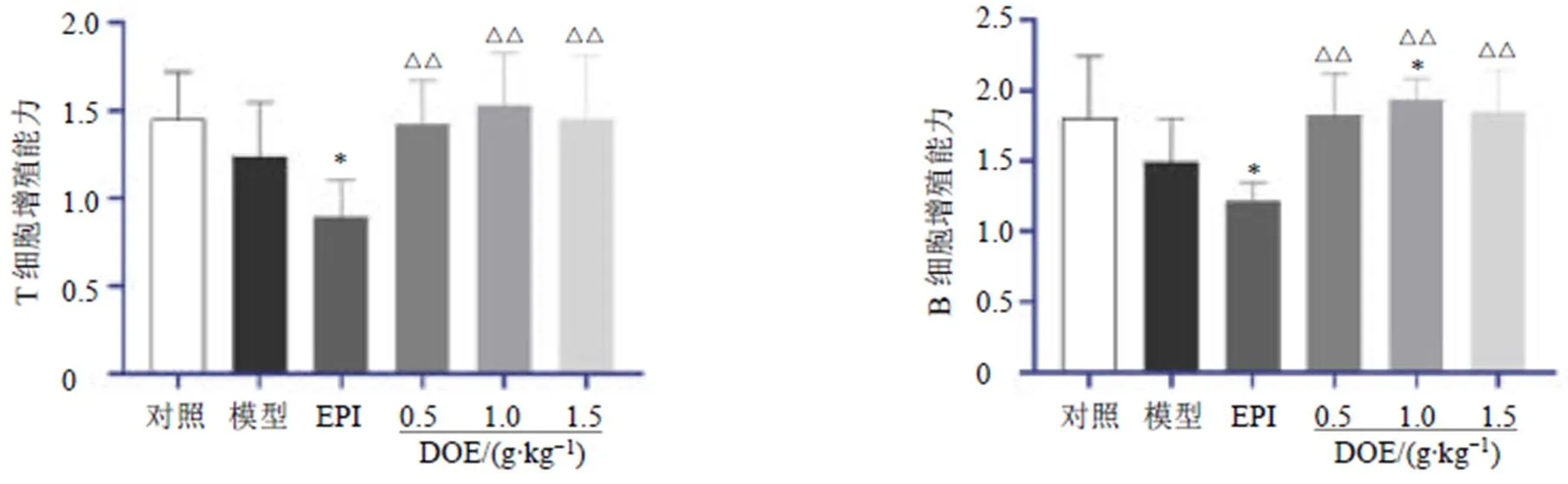
图10 铁皮石斛水提物对荷瘤小鼠脾脏淋巴增殖能力的影响()
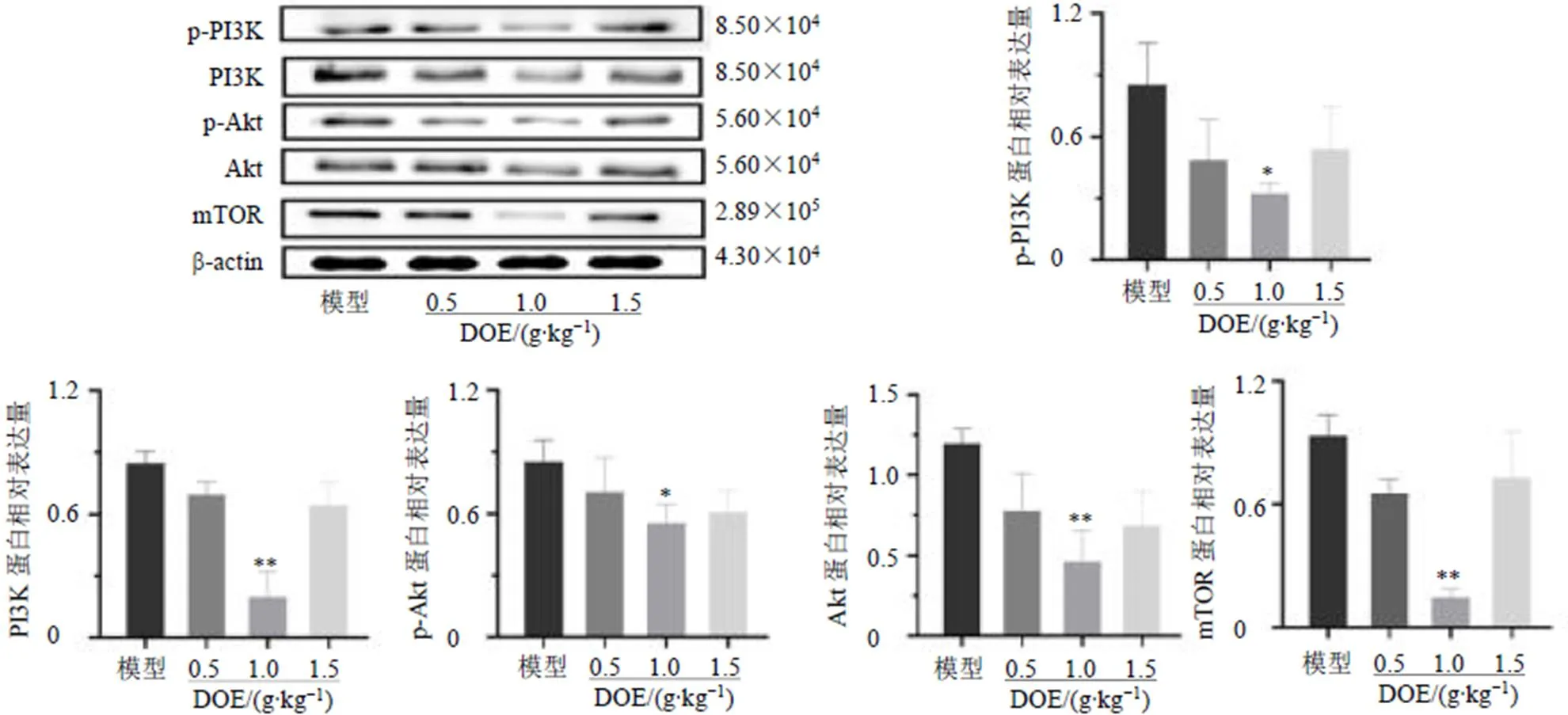
图11 铁皮石斛水提物对荷瘤小鼠肿瘤组织PI3K/Akt/mTOR通路相关蛋白表达的影响(, n = 3)
4 讨论
我国传统医学将肿瘤列入“癥瘕积聚”范畴,《华元化中藏经》记载:“癥瘕由五脏六腑真气失而邪气并逐乃生焉”。中医学认为机体正气不足、气血阴阳亏虚、脏腑功能失调是肿瘤发生的前提和决定因素[8]。其中“阴虚癌瘤”相关假说提出癌毒属于阳邪,认为毒蕴阴亏是恶性实体肿瘤发生的根本病机,从“根”上纠正“阴虚”这一发病之“本”,可有效预防恶性实体肿瘤的发生与发展[9-10]。铁皮石斛具有滋阴清热、益胃生津的功效,《神农本草经》中记载“石斛,除痹,下气,补五脏虚劳赢弱,强阴”。因此,铁皮石斛在临床上也常被用作肿瘤患者的辅助用药[11]。本研究结果显示,铁皮石斛水提物能显著抑制荷瘤小鼠肿瘤的生长速度,减轻肿瘤质量,诱导肿瘤组织细胞凋亡;并可降低荷瘤小鼠原位瘤及肺部部位的荧光强度,减少肺部转移灶的数目,缩小转移灶面积,抑制肿瘤转移。提示,铁皮石斛水提物具有抗肿瘤、抑制肿瘤转移的作用。
中医一直重视正气在疾病中起到的基础性作用。《内经》中记载:“正气存内,邪不可干”等论述均强调了正气在疾病中的作用。《外证医案汇编》则明确指出“正气虚则成岩”,强调了正气在肿瘤中的重要性[12]。现代研究也表明,机体免疫功能与肿瘤发生、发展、浸润、转移等密切相关。化疗作为恶性肿瘤综合治疗的重要手段,极易引发免疫抑制,影响治疗效果及预后,降低患者生存质量。中医把化疗后临床表现归为阴虚内热症候,化疗后会使机体伤津耗气,损阴伤阳,祛邪伤正,不利于患者的康复[13]。因此,在肿瘤治疗的同时,扶助正气、调理阴阳,提高机体免疫功能是肿瘤治疗的关键。中药参与肿瘤免疫治疗并非时直接杀死肿瘤细胞,而是通过激活细胞与体液免疫反应,作为生物反应调节剂来提高机体免疫功能,从而达到抑制肿瘤的目的。脾脏和胸腺作为机体最重要的免疫器官,是T、B等免疫细胞定居的场所,同时也是发生免疫应答及合成免疫活性物质的重要场所,在一定程度上反应免疫功能的强弱[14]。
T淋巴细胞介导的特异性免疫反应是肿瘤免疫的核心,其动态平衡是免疫系统稳定的重要保障[15]。CD4+T细胞的减少可导致细胞因子分泌减少及B淋巴细胞活化率下降,使细胞免疫与体液免疫均受抑制[16]。CD8+T细胞可通过分泌抑制因子抑制细胞毒性T淋巴细胞和B淋巴细胞,起到负调节作用[17]。CD4+/CD8+值降低反映细胞免疫功能受到抑制。大量研究发现免疫缺陷及恶性肿瘤患者CD4+T细胞比例下降,CD8+T细胞比例升高,CD4+/CD8+比值降低[18]。此外,T淋巴细胞分泌的细胞因子也是衡量机体免疫功能的重要指标[19]。IL-2在机体免疫调节网络中处于核心位置,可以刺激T细胞生长,激活淋巴细胞杀伤肿瘤细胞的活性[20]。TNF-α是抑瘤作用最强的细胞因子,能直接杀伤肿瘤细胞[21]。IFN-γ能直接抑制肿瘤的生长,并增强TNF的抑瘤作用[22]。本研究结果显示,与模型组比较,EPI组小鼠脾脏及胸腺指数显著降低、CD4+T细胞比例及CD4+/CD8+值显著下降、脾脏T、B淋巴细胞的增殖能力显著降低,提示化疗药物EPI进一步破坏了荷瘤小鼠的免疫功能。与模型组和EPI组比较,铁皮石斛水提物能显著增加脾脏和胸腺指数,改善脾脏形态学结构,提高脾脏T、B淋巴细胞的增殖能力,调节荷瘤小鼠外周血中异常的白细胞水平,提高外周血中淋巴细胞占比,使CD4+T细胞比例上升,CD8+T细胞比例下降,CD4+/CD8+比值上升,提高血清中IL-2、IFN-γ、TNF-α细胞因子水平。提示铁皮石斛水提物能调节荷瘤小鼠紊乱的免疫系统,提高免疫功能。
近些年来,研究发现PI3K/Akt/mTOR信号通路能够调控多种恶性肿瘤细胞存活、增殖、凋亡、转移的过程,已成为研究抗肿瘤药物的热门靶点通路之一[23-24]。当受到刺激被多种生长因子激活后的PI3K,可通过磷酸化细胞内第二信使4,5-二磷酸磷脂酰肌醇活化下游效应Akt,导致Akt分子构象改变发生磷酸化,激活后的p-Akt通过调控其下游靶蛋白mTOR,从而参与调节细胞增殖、凋亡、转移等生物学行为[25-27]。研究表明,大多数免疫细胞的激活都受到PI3K/Akt/mTOR信号通路的影响[28]。阻断PI3K/Akt/mTOR信号通路可影响肿瘤免疫微环境,解除患者免疫抑制状态,促进患者免疫功能恢复,并提高抗肿瘤固有的免疫反应[29-30]。本研究结果显示,铁皮石斛水提物治疗后可使荷瘤小鼠肿瘤组织中p-PI3K、PI3K、p-Akt、Akt、mTOR蛋白表达水平均有不同程度下降,其中铁皮石斛水提取中剂量组具有显著性差异。提示抑制PI3K/Akt/ mTOR信号通路的激活可能是铁皮石斛水提物抗肿瘤和恢复免疫功能的重要机制之一。
综上所述,“滋阴清热”中药铁皮石斛可抑制4T1乳腺癌荷瘤模型小鼠肿瘤的生长和转移,同时能调节荷瘤小鼠紊乱的免疫系统,恢复其免疫功能;其机制可能与其下调肿瘤组织中PI3K/Akt/mTOR信号通路表达有关。本研究为铁皮石斛用于肿瘤辅助治疗的临床应用提供实验依据,并为未来临床治疗恶性肿瘤提供一定科研参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 田艳涛, 康文哲. 全球癌症发病情况研究新进展 [J]. 中国医药, 2021, 16(10): 1446-1447.
[2] 梁欣妍, 黄迪. 抗肿瘤化疗影响机体免疫功能的研究进展 [J]. 中国科学: 生命科学, 2020, 50(10): 1068-1081.
[3] 宋卿, 季青, 李琦. 中医药调节肿瘤免疫的临床及机制研究 [J]. 中华中医药杂志, 2018, 33(10): 4542-4545.
[4] 吴蓓丽, 吴月国, 赵铮蓉, 等. 铁皮石斛免疫调节作用及相关活性成分多糖的研究进展 [J]. 中草药, 2019, 50(21): 5373-5379.
[5] Chen W H, Lu J M, Zhang J H,. Traditional uses, phytochemistry, pharmacology, and quality control ofKimura et Migo [J]., 2021, 12: 726528.
[6] 吕圭源, 颜美秋, 陈素红. 铁皮石斛功效相关药理作用研究进展 [J]. 中国中药杂志, 2013, 38(4): 489-493.
[7] 奚航献, 刘晨, 刘京晶, 等. 铁皮石斛化学成分、药理作用及其质量标志物 (Q-marker) 的预测分析 [J]. 中草药, 2020, 51(11): 3097-3109.
[8] 任明名, 王俊壹, 程海波. 中医药与肿瘤免疫治疗 [J]. 自然杂志, 2019, 41(4): 275-280.
[9] 孙有智, 刘红宁, 朱卫丰, 等. “阴虚癌瘤相关”假说的提出及其意义 [J]. 江西中医学院学报, 2008, 20(4): 1-5.
[10] 何伶文, 严小军, 刘红宁. 肿瘤病因病机总结及其阴虚病机初探 [J]. 辽宁中医杂志, 2017, 44(5): 934-936.
[11] 郑喆文, 罗根忠, 周云峰. 石斛对乳腺癌抑制作用的研究进展及临床应用 [J]. 安徽医科大学学报, 2017, 52(12): 1893-1896.
[12] 林晓洁, 关若丹, 司徒红林, 等. 中医扶正法预防恶性肿瘤转移的免疫治疗机制 [J]. 中医临床研究, 2015, 7(24): 22-24.
[13] 苏兰芳, 陈涛, 张丽君. 生白膏对阴虚型肿瘤患者放疗后白细胞计数影响的临床研究 [J]. 内蒙古中医药, 2016, 35(14): 54-55.
[14] Qin N, Lu S Y, Chen N,. Yulangsan polysaccharide inhibits 4T1 breast cancer cell proliferation and induces apoptosisand[J]., 2019, 121: 971-980.
[15] 罗慧, 汪琪, 张大昕. T淋巴细胞在肿瘤免疫中的双重作用及其免疫治疗现状 [J]. 肿瘤学杂志, 2019, 25(11): 936-940.
[16] 刘文立, 莫海云. 白及多糖通过调节免疫作用抑制结肠癌CT26荷瘤小鼠肿瘤生长 [J]. 中国免疫学杂志, 2021, 37(8): 941-945.
[17] Xie L, Liu G H, Liu Y J,.andCD8+T cell suppression assays [J]., 2021, 11(10): e4020.
[18] Yang C, Cheng H, Luo G,. The metastasis status and tumor burden-associated CA125 level combined with the CD4/CD8 ratio predicts the prognosis of patients with advanced pancreatic cancer: A new scoring system [J]., 2017, 43(11): 2112-2118.
[19] Qi Q C, Hou Y H, Li A,. Yifei Tongluo, a Chinese herbal formula, suppresses tumor growth and metastasis and exerts immunomodulatory effect in lewis lung carcinoma mice [J]., 2019, 24(4): E731.
[20] Wang C C, Feng L, Su J Y,. Polysaccharides fromNakai with immunomodulatory activity and inhibitory effect on tumor growth in LLC-bearing mice [J]., 2017, 207: 8-18.
[21] Razali F N, Sinniah S K, Hussin H,. Tumor suppression effect ofpolysaccharide fraction on breast cancer via immunomodulation [J]., 2016, 92: 185-193.
[22] Gong Y, Wu J, Li S T. Immuno-enhancement effects ofMurr. polysaccharide on cyclophosphamide-induced immunosuppression in mice [J]., 2015, 8(11): 20631-20637.
[23] Li H Y, Prever L, Hirsch E,. Targeting PI3K/AKT/mTOR signaling pathway in breast cancer [J]., 2021, 13(14): 3517.
[24] Sun X, Ma X M, Li Q W,. Anti‑cancer effects of fisetin on mammary carcinoma cells via regulation of the PI3K/Akt/mTOR pathway:andstudies [J]., 2018, 42(2): 811-820.
[25] Xia P, Xu X Y. PI3K/Akt/mTOR signaling pathway in cancer stem cells: From basic research to clinical application [J]., 2015, 5(5): 1602-1609.
[26] Miricescu D, Totan A, Stanescu-Spinu II,. PI3K/AKT/mTOR signaling pathway in breast cancer: From molecular landscape to clinical aspects [J]. I, 2022, 22(1). 173
[27] Liu R, Chen Y W, Liu G Z,. PI3K/AKT pathway as a key link modulates the multidrug resistance of cancers [J]., 2020, 11(9): 797.
[28] Okkenhaug K. Signaling by the phosphoinositide 3-kinase family in immune cells [J]., 2013, 31: 675-704.
[29] 赵家义, 韩一平. PI3K-AKT-mTOR信号通路抑制剂与肿瘤免疫治疗 [J]. 中国肿瘤生物治疗杂志, 2017, 24(12): 1424-1430.
[30] 李德辉, 苏伊璠. PD-1/PD-L1与PI3K/AKT交叉对话与乳腺癌变免疫微环境 [J]. 中国老年学杂志, 2022, 42(1): 215-218.
Anti-tumor and immunomodulatory effects ofwater extract on 4T1 breast cancer bearing mice
NIU Zhuang-wei1, YAN Mei-qiu1, SU Jie1, WANG Chen-xing1, HAN Li-ping1,SHI Meng-lin1, YU Jing-jing1, CHEN Su-hong2, LYU Gui-yuan1
1. School of Pharmaceutical Sciences, Zhejiang Chinese Medical University, Hangzhou 310053, China 2. Zhejiang University of Technology, Hangzhou 310014, China
To investigate the anti-tumor and immunomodulatory effects ofwater extract on 4T1 breast cancer model mice, and further explore its mechanism.BALB/c female mice were successfully used to establish a 4T1 breast cancer tumor-bearing mouse model. The mice were randomly divided into model group, epirubicin hydrochloride (8 mL/kg) group andwater extract low-, medium-, and high-dose (0.5, 1.0, 1.5 g/kg) groups, and 10 normal BALB/c female mice were selected as control group. Corresponding drugs were given to intervene, survival state of mice was observed. The tumor diameter and short diameter were measured every three days. After continuous administration for 28 d, mice were sacrificed, tumor weight was weighed, and tumor inhibition rate was calculated. Lung tumor metastasis was observed by living animal imager and counting of metastases. Spleen and thymus were weighed and organ coefficients were calculated. HE staining was used to observe the morphological changes of tumor, lung and spleen. The number of white blood cells and proportion of lymphocytes in peripheral blood of tumor-bearing mice were detected by hematology analyzer. The levels of interleukin-2 (IL-2), γ interferon (IFN-γ) and tumor necrosis factor-α (TNF-α) in serum were detected by ELISA. The proportion of T lymphocytes in peripheral blood was detected by flow cytometry. Splenic lymphocyte proliferation test was used to detect the proliferation of T lymphocytes and B lymphocytes in spleen. The expressions of phosphatidylinositol 3-kinase (PI3K)/protein kinase B (Akt)/mammalian target of rapamycin (mTOR) pathway related proteins in tumor tissues were detected by Western blotting.Compared with model group, tumor growth trend ofwater extract group was slowed down, tumor weight was reduced (< 0.01), necrotic cells in tumor tissues were increased, fluorescence intensity of tumor and lung metastases was significantly decreased (< 0.05, 0.01), and number of lung metastases was decreased (< 0.05, 0.01). Spleen and thymus index were increased (< 0.05). The number of white blood cells in peripheral blood was decreased (< 0.01), and proportion of lymphocytes was increased (< 0.05, 0.01). The levels of IL-2, IFN-γ and TNF-α in serum were increased (< 0.05, 0.01). CD3+T lymphocytes in peripheral blood was increased (< 0.05), CD4+/CD8+ratio was increased (< 0.01); Proliferation ability of T lymphocytes and B lymphocytes in spleen were increased (< 0.05). The expressions of PI3K/Akt/mTOR pathway related proteins in tumor tissues were decreased (< 0.05, 0.01).water extract can significantly inhibit tumor growth and metastasis in tumor-bearing mice, and restore immune function in tumor-bearing mice, which may be related to down-regulation of PI3K/Akt/mTOR pathway expression.
Kimura et Migo; breast cancer; immunomodulatory; T lymphocyte; PI3K/Akt/mTOR pathway
R285.5
A
0253 - 2670(2023)01 - 0131 - 11
10.7501/j.issn.0253-2670.2023.01.016
2022-09-23
国家重点研发计划项目(2017YFC1702203);浙江省中医药科技计划项目(2022ZB095);浙江省省级重点实验室项目(2012E10002)
牛壮伟(1995—),男,硕士研究生,研究方向为中药药理学。Tel: 15339951147 E-mail:1585172156@qq.com
通信作者:陈素红,研究员,博士生导师,主要从事中药药理与新产品开发研究。E-mail: chensuhong@zjut.edu.cn
吕圭源,教授,博士生导师,主要从事中药药理与新产品开发研究。E-mail: lv.gy@263.net
[责任编辑 李亚楠]