脱落酸功能类似物萘酮戊酸调控棉花叶片脱落的形态学与转录组分析
周婷婷,杨林,韩小强,田沁怡,陈阅新
(石河子大学农学院/新疆绿洲农业病虫害治理与植保资源利用重点实验室,新疆 石河子 832003)
新疆是我国乃至世界上最重要的棉花生产基地,棉花也是新疆经济发展的战略核心。据统计,2020年新疆棉花种植面积约250.19万hm2,棉花总产达到516.1万t,占全国棉花产量的87.33%[1]。然而,随着对劳动力需求的提升和劳动力成本的增加,棉花价格优势逐渐缩减。因此,发展机采棉成为降低新疆植棉成本的主要举措。随着新疆棉区机采棉的大力推广,棉花机械化收获技术快速发展,棉花标准化和机械化生产带来的经济效益十分显著,有效的解决了新疆棉区劳动力供需问题,促进了棉花发展战略的实施[2]。
棉花机械采收的前提是脱叶剂的使用,在棉花吐絮期使用化学脱叶剂,能够使棉花叶片提前脱落,加快棉铃成熟[3]。脱叶剂的合理使用能够加速棉花叶片脱落,提高机采棉的采摘效率[4]。当前新疆棉区普遍使用的脱叶剂为噻苯隆与敌草隆复配的制剂。噻苯隆属于杂环芳香脲类化合物,影响棉花脱落酸、生长素和乙烯三者之间的平衡,促进棉花叶柄离层的形成,使棉花叶片提前脱落,避免采收时增加棉花杂质[5]。敌草隆是一种除草剂,其与噻苯隆复配,能够加快棉花叶片焦枯,提高低温条件下脱叶效果[6]。然而,作为有机氯农药,敌草隆在土壤中半衰期大于300 d,并且具有较强的生物富集作用,会对生态环境造成严重污染[7]。
棉花叶片的自然脱落是棉花植株体内激素平衡发生变化的结果。在衰老的叶片中,乙烯和脱落酸含量增加,生长素含量下降,使叶片离层两端激素浓度梯度消失,从而对乙烯更加敏感,最终导致叶片脱落[8]。喷施脱叶剂后能够促进棉花内源脱落酸和乙烯的生成,有利于棉花叶片脱落,并且脱叶效果与脱落酸含量呈正相关[9]。外源喷施乙烯或乙烯利也能促进棉花脱叶,并且未展开的幼叶对乙烯更敏感[8]。XU等[10]研究发现噻苯隆和乙烯处理棉花后,促进了叶片离层的形成,细胞分裂素氧化酶/脱氢酶(Cytokinin oxidase/dehydrogenase,CKXs)在棉花叶片离层中上调表达,细胞分裂素响应抑制因子(Cytokinin response regulatory factors,ARRs)的表达量下降,且细胞分裂素和乙烯信号之间相互作用是调控棉花叶片脱落的关键。ARRs是细胞分裂素的负调控因子,影响细胞分裂素的合成。廖宝鹏等[11]研究发现在棉花不同部位主茎叶涂抹噻苯隆会使乙烯信号转导相关基因和乙烯合成相关基因上调表达。乙酰辅酶A合成酶(acetyl-CoA synthetase,ACS)是乙烯合成过程中重要的酶,直接参与乙烯合成,从而影响乙烯含量水平,调控植物生长发育和衰老[12]。乙烯受体基因对器官脱落有着重要的作用,并且发现乙烯利能够促进其表达[13]。DU等[14]研究发现植物毒素冠菌素也可用于棉花脱叶,并通过调解水解酶的活性和参与乙烯信号转导诱导棉花脱叶。
萘酮戊酸(natenpac)是一类新型脱落酸类似物,具有更加简捷的合成路线和多种植物生长调节活性,是一类对ABA受体PYLs具有很好选择性的ABA类激动剂(图1)[15]。在前期的研究中,我们发现萘酮戊酸具有促进棉花叶片脱落的作用[16]。因此,为了深入研究萘酮戊酸对棉花脱叶的的影响,开发环保型棉花脱叶剂,本研究以北疆机采棉主栽品种新陆早64为供试作物,采用萘酮戊酸单剂处理吐絮期棉花,以噻苯隆·敌草隆复配制剂(新疆棉区常规使用的脱叶剂)和清水处理作为对照,通过对脱叶率、内源激素含量、离层形态学研究、叶柄断裂强度和转录组等指标的测定,研究萘酮戊酸对棉花脱叶的诱导,以探明萘酮戊酸对棉花脱叶的作用机制,为萘酮戊酸作为棉花脱叶剂的应用提供理论依据。

图1 萘酮戊酸结构式
1 材料与方法
1.1 试验地基本概况
小区试验在新疆生产建设兵团第八师石河子市北泉镇三分场二连(44°23′21″N,85°58′48″E)进行。试验田采用中等水平施肥,前茬作物为棉花,已连续多年种植。供试棉花品种为新陆早64号;采用机采棉种植模式,一膜6行,行距66+10 cm,宽窄行常规播种模式;2019年4月15日播种,4月22日第1次进水,并于7月8日打顶;种植密度约为19.5万株·hm-2,全生育期采用膜下滴灌。待棉花长到吐絮期(吐絮率约40%),使用背负式电动喷雾器(3WBD-20,台州市凯峰塑钢有限公司)均匀喷施萘酮戊酸单剂(N)、噻苯隆·敌草隆复配制剂(TD, 文中简写为噻苯·敌草隆)和清水(W)(表1)。小区采用随机区组排列,每个处理4个小区,每个小区面积约为67 m2。

表1 试验设计
1.2 供试脱叶剂
1%萘酮戊酸可溶性粉剂(SP),中国农业大学;360 g·L-1噻苯隆·180 g·L-1敌草隆悬浮剂(SC),拜耳股份有限公司。
1.3 方法
1.3.1 棉花脱叶率的调查
每重复随机选取3个采样点,采样点之间棉花长势、水肥、管理情况等一致,具有代表性。每点选取10株连续棉株进行随机标记计数,调查同一标记棉株上施药前、施药后1 d、3 d、6 d、9 d后的棉株叶片数,用公式计算棉花叶片脱落率。

(1)
1.3.2 棉花叶柄离层断裂强度的测量
分别于施药后1 d、3 d、6 d使用数显式推拉力计(SF-100,艾普计量仪器有限公司)测量棉花叶柄离层断裂强度并记录[14]。
1.3.3 棉株植物激素的测定
分别于施药后1 d、2 d、3 d采取各处理的棉花叶柄样品,采集好的样品立即放入液氮中,带回实验室后放入-80 ℃冰箱(TSE4000V,赛默飞世尔科技有限公司)保存,根据PlantIAA、PlantCTK、PlantABA ELISA KIT(上海语纯生物科技有限公司)试剂盒的说明书进行植物激素含量测定。
1.3.4 叶柄离层形态学研究
棉花叶柄离层形态学研究采用XU等[10]的试验方法,略有改动。分别于施药前、施药后1 d、3 d、6 d、9 d采集各处理的棉花叶柄,9 d采集的是棉株上未脱落的叶柄。
1.3.5 棉花叶柄转录组样品处理
分别于施药后1 d、2 d、3 d采取各处理的棉花叶柄样品,采集好的样品立即放入液氮中,带回实验室后放入-80 ℃冰箱保存,将27个样品(3个处理,每个处理3次生物学重复,3个时间点1 d、2 d、3 d)送至Novogene进行RNA测序(RNA-Seq)。在构建文库之前,在1%琼脂糖凝胶上检测RNA的完整性和是否存在DNA污染,再使用分光光度计初步检测RNA浓度和纯度,最后使用Agilent 2100(安捷伦科技有限公司)精确检测RNA完整性。普通真核转录组文库的构建是采用磁珠富集方法,从检测合格的样品总RNA中纯化出带有polyA尾的mRNA,随后将RNA打断成250-300 bp的短片段,以片段化的RNA为反转录模板,使用随机寡核苷酸为引物合成cDNA的第1条链,随后在DNA polymerase体系下,以dNTPs为原料合成第2条链,对纯化后的双链cDNA进行末端修复、加A尾并连接测序接头,用AMpure XP beads筛选200 bp左右的cDNA,进行PCR扩增并纯化PCR产物,最终获得文库。文库构建完成后,先将文库稀释至1.5 ng·μL-1,再用Agilent 2100对文库进行检测,对符合预期的文库使用qRT-PCR进行浓度准确定量,以保证文库质量。文库检测合格后,在Illumina Hiseq平台上对文库进行测序,每端各测150 bp,最终获得了150 bp~150 bp的成对末端读数。所有的读数都与棉花基因组比对(G.hirsutumTM-1)[17]。所鉴定基因的映射测序读数用于基因表达分析,其基因表达水平是基于FPKM(每千碱基转录序列中每百万个碱基测序的预期片段数)计算。使用DESeq-R软件包进行差异分析表达,校正后Padj<0.05的基因被认为是显著差异表达的基因。使用GOSeq-R软件包对差异表达基因进行基因本体(GO)富集分析,校正后的Padj<0.05的被认为是显著富集的。所有的差异表达基因(differentially expressed genes,DEG)通过KOBAS软件进行KEGG通路差异表达基因的统计富集。
1.3.6 差异基因实时定量PCR(qRT-PCR)分析
使用Novogene测序时所用的RNA;利用FastKing gDNA Dispelling RT SuperMIX(天根生化科技(北京)有限公司)试剂盒对RNA进行反转录,然后使用SuperReal PreMix Plus(SYBR Green) (天根生化科技(北京)有限公司)试剂盒和7500 Real Time PCR System(Life Technologies)系统对差异基因的表达量进行qPCR测定。从RNA-Seq中选择同源性较高的基因,使用Primier 5.0软件设计引物,并通过生工生物工程股份有限公司合成引物,所用引物见表2,以GhUBQ7(DQ116441)为内参基因计算表达并使其标准化[18],将处理前的基因表达水平设为1,将标准化的基因表达水平与空白对照进行比较,获得各基因的相对表达量。每个样品设3个重复,qRT-PCR反应程序为95 ℃,10 min;95 ℃,15 s;60 ℃,1 min;40个循环。qRT-PCR数据采用2-ΔΔCt法计算基因相对表达量。
1.3.7 统计分析
所有数据采用Origin 2018和SPSS 18.0软件进行统计分析,通过比较均值的One-Way ANOVA(单因素方差分析)方式,选择LSD(Least-Significant Difference,最小显著性差异法),将置信区间设置为95%,当代表显著性的P<0.05时,表示两组间存在显著性差异。
2 结果与分析
2.1 萘酮戊酸对棉花脱叶率和叶柄断裂强度的影响
萘酮戊酸施药后3 d、6 d、9 d的脱叶率均显著高于空白对照,但低于噻苯·敌草隆处理(图2A)。施药后9 d,萘酮戊酸处理后的脱叶率达到35.46%,噻苯·敌草隆处理后的脱叶率为78.29%,均显著优于空白对照处理。叶柄断裂强度与棉花叶片的脱落有着密切关系。萘酮戊酸、噻苯·敌草隆处理后的棉花叶柄的断裂强度明显低于空白对照处理(图2B)。随着处理时间的变化,噻苯·敌草隆处理后的棉花叶柄断裂强度最小,其次是萘酮戊酸。施药后1 d、3 d、6 d,萘酮戊酸处理后的叶柄断裂强度分别为10.94 N、9.61 N、9.56 N,低于空白对照处理后的断裂强度(13.26 N(1 d)、11.89 N(3 d)、11.28 N(6 d)),但是高于噻苯·敌草隆处理后的棉花叶柄断裂强度(10.64 N(1 d)、6.07 N(3 d)、4.07 N(6 d))。由此可见,外源施用萘酮戊酸能够显著降低棉花叶柄的断裂强度,有利于叶片的脱落,具有促进棉花叶片脱落的功能,但脱叶效果弱于噻苯·敌草隆处理。

A:脱叶率;B:叶柄断裂强度;柱状图上方不同字母则表示差异显著(P<0.05)。图2 萘酮戊酸对棉花断裂强度和脱叶率的影响
2.2 萘酮戊酸对棉花叶柄植物激素含量和叶柄离层形态学的影响
萘酮戊酸和噻苯·敌草隆处理后棉花叶柄处植物激素含量变化见图3。
萘酮戊酸处理后,棉花叶柄内源脱落酸含量逐渐升高,显著高于空白处理,其含量分别为10.74 ng·mL-1(1 d)、12.11 ng·mL-1(2 d)、12.34 ng·mL-1(3 d),但低于噻苯·敌草隆处理后的脱落酸含量。各处理的棉花内源生长素和细胞分裂素含量均逐渐降低,其中生长素含量与空白对照相比差异不显著,细胞分裂素含量显著低于空白对照处理,其含量分别为8.16 ng·mL-1(1 d)、7.49 ng·mL-1(2 d)、7.26 ng·mL-1(3 d),但高于噻苯·敌草隆处理后的细胞分裂素含量。这表明萘酮戊酸处理可以促进脱落酸的生成,降低生长素和细胞分裂素含量,从而促进离层的形成。

A:生长素含量;B:细胞分裂素含量;C:脱落酸含量;柱状图上方不同字母则表示差异显著(P<0.05)。图3 萘酮戊酸对棉花叶柄内源激素含量的影响
萘酮戊酸对棉花叶柄离层形态学的影响见图4。萘酮戊酸处理后6 d,棉花叶柄处开始向内凹陷,可观察到离层的形成;而噻苯·敌草隆处理后3 d叶柄离层处开始向内凹陷,在6 d时,离层处明显断裂,在9 d时断裂程度愈加明显;空白对照处理后9 d仅能观察到棉花叶柄处轻微凹陷。这表明萘酮戊酸处理棉花后,可以加速叶片离层的形成,但效果弱于噻苯·敌草隆处理。

9 d采集的样品为棉花上未脱落的叶柄,比例尺为200 μm。图4 萘酮戊酸对棉花叶柄离层的影响
2.3 萘酮戊酸对棉花叶柄离区的转录组分析
萘酮戊酸处理后在棉花离层表达了8万多个基因,其中萘酮戊酸处理后检测到6 352个差异基因,噻苯·敌草隆处理后检测到26 446个差异基因。萘酮戊酸处理后,差异基因数量逐渐增加,但处理后的第2 d差异基因数量下降(图5A)。噻苯·敌草隆处理后,差异基因数量每天逐渐增加,在第3 d时急剧增加(图5B)。萘酮戊酸和空白对照相比,处理后1 d、2 d、3 d共表达40个差异基因,处理后1 d仅表达1 041个差异基因,处理后2 d仅表达244个差异基因,处理后3 d表达的差异基因数迅速增加到3 846个(图5C)。噻苯·敌草隆处理与空白对照处理相比,处理后1 d、2 d、3 d共表达3 265个差异基因,处理后1 d表达1 134个差异基因,处理后2 d表达1 519个差异基因,处理后3 d表达的差异基因达到12 873个(图5 D)。萘酮戊酸和噻苯·敌草隆相比,萘酮戊酸处理后,在1 d独立表达278个差异基因,3 d独立表达1 522个差异基因;噻苯·敌草隆处理后1 d独立表达1 061个差异基因,3 d独立表达15 406个差异基因(图5E)。

A:萘酮戊酸处理后的差异表达基因数;B:噻苯·敌草隆处理后的差异表达基因数;C:萘酮戊酸处理后不同时间的差异基因数量韦恩图;D:噻苯·敌草隆处理后不同时间的差异基因数量韦恩图;E:萘酮戊酸处理与噻苯·敌草隆处理后1 d和3 d的差异表达基因数量交叉比较;N-1 d为萘酮戊酸处理后1 d;N-2 d为萘酮戊酸处理后2 d;N-3 d为萘酮戊酸处理后3 d;TD-1 d为噻苯·敌草隆处理后1 d;TD-2 d为噻苯·敌草隆处理后2 d;TD-3 d为噻苯·敌草隆处理后3 d;W-1 d为空白对照处理后1 d;W-2 d为空白对照处理后2 d;W-3 d为空白对照处理后3 d。图5 棉花叶柄离层差异基因的变化
基因本体论(GO)分类主要用于识别脱叶过程中生物学过程较活跃的功能类别,一般包括3个主要部分:生物过程(biological process)、细胞组分(cellular component)、分子功能(molecular function)。萘酮戊酸和噻苯·敌草隆相比,差异基因的生物过程相差较大。萘酮戊酸处理棉花后的GO主要富集在1 d和3 d(图6),在生物过程中靠前的是生物过程(biological process)和代谢过程(metabolic process);富集到细胞组分的差异表达基因较少;在分子功能中靠前的是催化活性(catalytic activity)和结合(binding)功能。噻苯·敌草隆处理棉花后的GO主要富集在1 d和3 d(图7),生物过程中靠前的是生物过程(biological process)、代谢过程(metabolic process)、细胞代谢过程(cellular metabolic process)、有机物代谢过程(organic substance metabolic process)、初级代谢过程(primary metabolic process);在细胞分类组分中靠前的是细胞(cell)和细胞组分(cell part);在分子功能中靠前的是催化活性(catalytic activity)和氧化还原酶活性(oxidoreductase activity)。
通过KEGG通路分析以探索对萘酮戊酸和噻苯·敌草隆有反应的差异基因的生物学通路。萘酮戊酸和噻苯·敌草隆处理后的不同时间点表达了不同的KEGG通路,但两者之间有些途径是相似的,例如玉米素的生物合成(zeatin biosynthesis)、丙酮酸代谢(pyruvate metabolism)、类黄酮生物合成(flavonoid biosynthesis)、植物激素信号转导(plant hormone signal transduction)、次生代谢产物的生物合成(biosynthesis of secondary metabolites) (图8)。萘酮戊酸处理后的KEGG途径3天均有表达,而噻苯·敌草隆处理后的KEGG通路只要集中在1 d和2 d,在3 d时有少数的KEGG通路。通过GO功能富集和KEGG通路分析,植物激素信号转导和一些转录因子对于萘酮戊酸引起棉花脱叶有重要的作用。
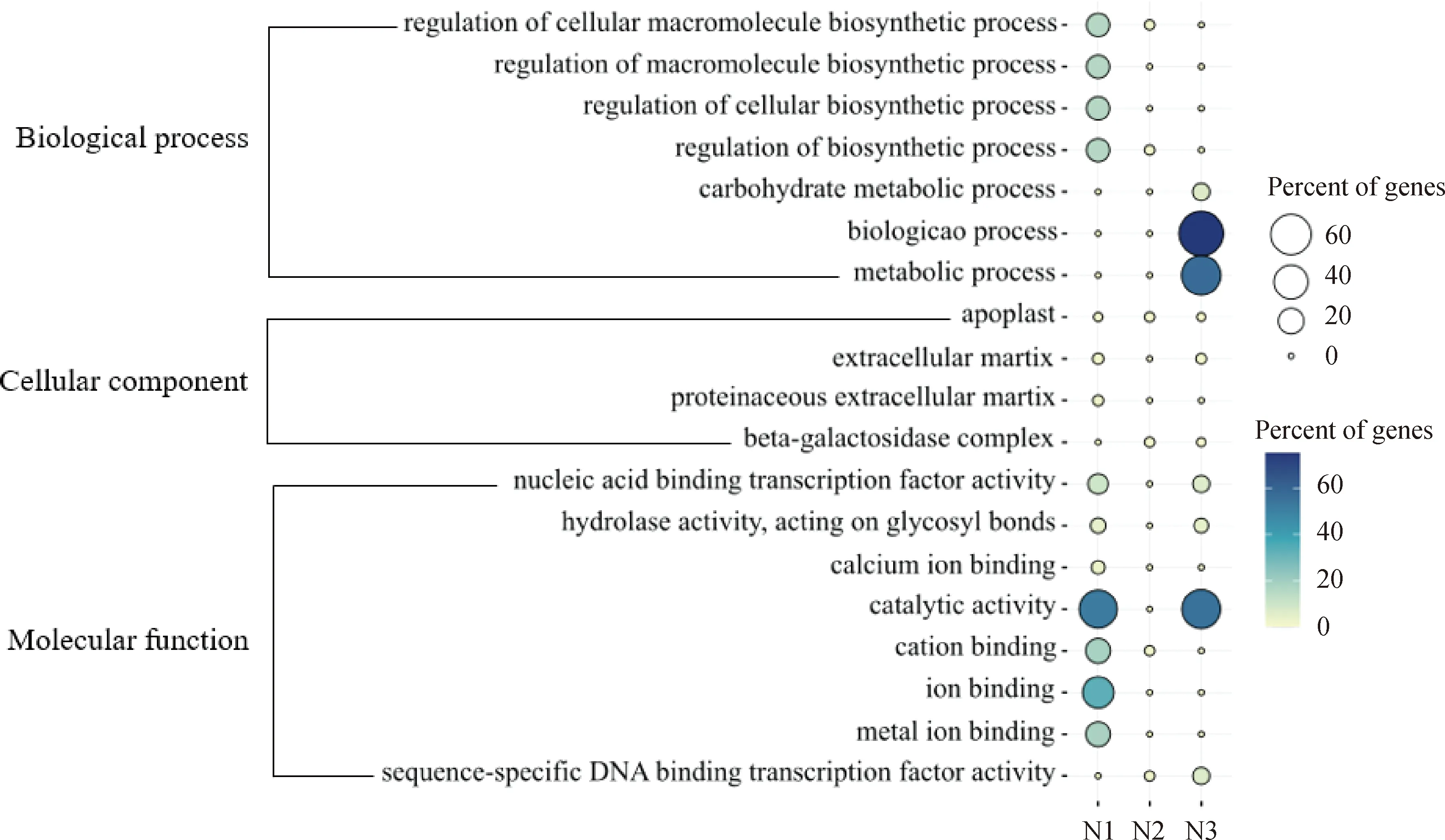
N1为萘酮戊酸处理后1 d;N2为萘酮戊酸处理后2 d;N3为萘酮戊酸处理后3 d。图6 萘酮戊酸处理棉花后的叶柄离区GO(基因本体论)富集

TD1为噻苯·敌草隆处理后1 d;TD2为噻苯·敌草隆处理后2 d;TD3为噻苯·敌草隆处理后3 d。图7 噻苯·敌草隆处理棉花后的叶柄离区GO(基因本体论)富集

N1为萘酮戊酸处理后1 d;N2为萘酮戊酸处理后2 d;N3为萘酮戊酸处理后3 d;TD1为噻苯·敌草隆处理后1 d;TD2为噻苯·敌草隆处理后2 d;TD3为噻苯·敌草隆处理后3 d。图8 KEGG途径分析
2.4 细胞分裂素和乙烯信号传导途径参与脱叶
KEGG通路分析表明,几个细胞分裂素氧化酶/脱氢酶(CKX)基因可能在萘酮戊酸和噻苯·敌草隆处理棉花后在脱叶中有着重要的作用。通过qRT-PCR显示,4个GhCKX基因均差异表达,并且随着时间的推移其表达逐渐上调,其中萘酮戊酸处理后3 d的基因表达倍数均在1.3以上,噻苯·敌草隆处理后3 d的基因表达倍数在2.3 以上,GhCKXs基因表达均上调(图9),相应的细胞分裂素含量水平降低。细胞分裂素反应调节因子(ARRs)主要参与细胞分裂素在植物体内信号转导,qRT-PCR结果显示,ARRs表达呈下降趋势,在3 d时,萘酮戊酸处理后的基因表达倍数均在1.0以下,噻苯·敌草隆处理后的基因表达倍数均在0.4以下,噻苯·敌草隆处理后的基因表达量高于萘酮戊酸处理,不同处理之间相对表达量有所差异,但表达趋势一致。以上结果表明,萘酮戊酸和噻苯·敌草隆处理后促进细胞分裂素降解,从而导致细胞分裂素含量水平降低,这一研究结果与XU等的研究结果相似[10]。


A:GhCKXs和ARRs对应于RNA-Seq数据的表达模式;B—E:CKXs基因相对表达量;F—H:ARRS基因相对表达量。图9 棉花叶柄离层GhCKXs和ARRs的表达验证

A:乙烯相关基因对应于RNA-Seq数据的表达模式;B:EIN3基因相对表达量;C:EIN4基因相对表达量;D:ACO3基因相对表达量;E:ACS基因相对表达量;F:ERF2基因相对表达量;G:ETR1基因相对表达量。图10 棉花叶柄离层乙烯相关基因的表达验证
萘酮戊酸和噻苯·敌草隆处理后,乙烯合成关键基因、乙烯信号转导基因、乙烯传感基因均差异表达(图10)。通过qRT-PCR验证,结果显示,萘酮戊酸和噻苯·敌草隆处理后,ACC氧化酶(ACO3)和ACS表达上调,其中萘酮戊酸处理后3 d的基因表达倍数到达1.3以上,噻苯·敌草隆处理后的基因表达倍数在2.2以上;萘酮戊酸处理后乙烯受体基因(EIN3、EIN4)和一些乙烯响应基因(ETR1、ERF2)的表达不断上调,表达倍数均在1.3以上,噻苯·敌草隆处理后基因表达倍数在2.2以上。这表明萘酮戊酸处理后增强了乙烯信号在棉花体内的传导,从而诱导脱叶。
2.5 赤霉素和茉莉酸信号传导途径参与脱叶
赤霉素受体GIDs是一种可溶性蛋白,在植物中与GAs结合并将信号传递。qRT-PCR验证结果显示萘酮戊酸处理后3 dGID1-1和GID1-2基因表达倍数均在1.8左右(图11),高于噻苯·敌草隆处理(基因表达倍数均在1.3左右)。JAZs(茉莉酸响应因子)是茉莉酸信号途径的转录因子,研究发现JAZ10上调表达,其中噻苯·敌草隆处理后基因表达倍数为3.1,明显高于萘酮戊酸处理(基因表达倍数为1.9);这可能与下游转录因子MYC2结合共同激活茉莉酸下游信号转导有关。结果表明,萘酮戊酸处理后可能激活下游泛素介导的蛋白水解,从而调控细胞周期,诱导叶片衰老。

A:茉莉酸和赤霉素相关基因对应于RNA-Seq数据的表达模式;B:GID1-1基因相对表达量;C:GID1-2基因相对表达量;D:JAZ10基因相对表达量。图11 棉花叶柄离层赤霉素和茉莉酸相关基因的表达验证
3 讨论与结论
研究表明,喷施脱叶剂后能够促进棉花叶片乙烯和脱落酸的生成,促进棉花叶柄离层形成[19]。萘酮戊酸处理能够显著降低棉花叶柄断裂强度,提高棉花脱叶率,并促进叶柄离层形成和叶柄内源脱落酸的生成,降低细胞分裂素和生长素含量,但是效果略差于噻苯·敌草隆处理。高丽丽等[9]研究发现噻苯隆能够加速开启棉花叶片的衰老程序,施药后棉花叶片内源脱落酸含量上升,生长素则逐渐降低。
植物激素及其类似物在农业生产中的应用越来越重要。冠菌素(coronatine, COR)是一种引起黄化病的非寄主特异性植物毒素,是茉莉酸的结构类似物,在某些作物中引起叶片和/或果实脱落。DU等[14]研究发现冠菌素能够降低棉花叶柄断裂强度,促进棉花叶片的脱落,且具有不同于噻苯隆调节棉花脱叶的作用方式。转录组分析结果表明,萘酮戊酸处理后检测到6 352个差异表达基因,且大多数基因与“代谢过程”、“生物过程” “植物激素信号转导”和“次生代谢产物的生物合成”相关。
GAN等和MOYOYUKI等研究发现CKXs基因是一种将细胞分裂素降解成非活性产物的酶,并且使细胞分裂素失去活性,从而降低植物内源细胞分裂素含量[20-21]。萘酮戊酸处理棉花后CKXs上调表达,细胞分裂素含量降低,同时ARRs下调表达。这一研究结果与XU等[10]的研究结果相似,使用脱叶剂后降解细胞分裂素,并且使细胞分裂素失去活性。廖宝鹏等[11]研究发现在棉花不同部位主茎叶涂抹噻苯隆会使乙烯合成相关基因和信号转导相关基因上调表达。刘长英等[13]发现乙烯利可以促进EINs的表达,在成熟果实中表达量高于未成熟的幼果。也有研究发现乙烯合成抑制剂可以延迟番茄叶柄的脱落,乙烯受体基因ETR1和ETR2对器官脱落有着重要的作用[22]。ACO3是乙烯合成关键基因,萘酮戊酸处理后棉花叶柄中乙烯合成相关基因以及信号转导相关基因上调表达,促进乙烯的合成以及在植株体内的信号转导。另外一些赤霉素相关基因下调表达,茉莉酸相关基因上调表达。孙凯文[23]研究发现外源脱落酸处理拟南芥后JAZ1上调表达,本研究中萘酮戊酸处理后JAZ10上调表达。
综上所述,外源使用萘酮戊酸能够明显促进棉花叶柄离层的形成,降低叶柄断裂强度,从而促进棉花脱叶,提高棉花的脱叶率,且在激素信号调控上具有与新疆棉区常规使用的噻苯·敌草隆相似的机理。虽然萘酮戊酸具有促进棉花脱叶的效果,但在各项指标上均弱于噻苯·敌草隆复配制剂。这表明萘酮戊酸在棉花脱叶上的使用,还需要深入研究其与其他脱叶剂产品的复配筛选及相关机理。

