补肾活血汤对大鼠骨髓间充质干细胞体外成骨分化影响的研究
刘金豹,冯 萍,李 刚
(1. 山东中医药大学,山东 济南 250011;2. 济南市第四人民医院,山东 济南 250000)
近年来随着激素在临床上的广泛应用,激素性股骨头坏死跃居非创伤性股骨头坏死的首位,严重影响了患者的生活质量。有研究表明,激素性股骨头坏死与骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)成骨分化障碍密切相关,BMSCs具有多向分化潜能,可以定向分化为成骨细胞、软骨细胞、脂肪细胞等多种功能细胞[1]。近年来,国内外学者发现 Wnt/β-catenin信号通路可能是BMSCs分化、增殖、活性表达的关键信号通路[2-6]。补肾活血方在临床上广泛用于激素性股骨头坏死的治疗,效果显著,但作用机制尚不明确。本研究基于Wnt/β-catenin信号通路探讨了补肾活血汤对BMSCs向成骨细胞分化的影响,旨在为该汤剂治疗激素性股骨头坏死提供分子生物学理论依据。
1 实验材料与方法
1.1实验动物 6周龄SPF级健康雄性SD大鼠30只,体重180~220 g,购自济南朋悦实验动物繁育有限公司,动物许可证号:No.37009200006066。购入后饲养于山东中医药大学附属医院动物房,室温控制在18~26 ℃,相对湿度40%~70%,通风换气环境下标准鼠粮及纯净水适应性喂养。实验严格遵守《实验动物管理条例》,符合医学实验动物伦理学标准。
1.2药物与试剂 补肾活血汤(组方:淫羊藿30 g、杜仲15 g、丹参30 g、川芎15 g、白芍15 g、茯苓12 g、牛膝12 g、鹿角胶10 g、香附9 g、甘草9 g,由山东中医药大学附属医院煎药室制备);DMEM(L)培养基及胎牛血清(杭州四季青生物有限公司,中国);地塞米松、茜素红染料染(Sigma公司,美国);Anti-CD44、Anti-CD45、Anti-CD73、Anti-CD90、Anti-CD105(艾博抗上海贸易有限公司,中国);CCK-8试剂盒(南京霆瑞生物科技有限公司,中国);碱性磷酸酶检测试剂盒(Sigma公司,美国);EASYspin Plus大量组织/细胞RNA快速提取试剂盒(杭州昊鑫生物科技股份有限公司,中国);TaKaRa Prime Script Ⅱ 1st Strand cDNA Synthesis Kit(大连宝生物工程有限公司,中国);SYBR Green I(北京索莱宝科技有限公司,中国); PCR引物(上海生工生物工程股份有限公司,中国)。
1.3主要仪器 超净工作台(苏州艾科科技有限公司),显微镜(日本Olympus公司),电子秤(上海恒平科技有限公司),制冰机(上海畅可制冷设备有限公司),高速冰冻离心机(德国Sigma公司),高压蒸汽灭菌锅(上海雅玛拓科贸公司),烤箱(天津市天宇实验仪器公司),-80 ℃冰箱(中科美菱低温科技有限责任公司),常温4 ℃冰箱(海尔集团),流式细胞仪( 北京众力挽生物科技有限公司),罗氏实时荧光定量PCR仪(赛默飞科技有限公司)。
1.4培养基制备 将20只6周龄SD大鼠随机分为对照组和补肾活血汤组各10只,补肾活血汤组给予补肾活血汤3 mL/250 g(给药量根据Meeh-Rubner公式计算)灌胃,生理盐水给予等量生理盐水灌胃,连续灌胃7 d。末次灌胃后2 h腹主动脉取血,于4 ℃下放置4 h,3 000 r/min离心30 min,取上层血清56 ℃、30 min灭活,同组血清混匀并经0.22 μm一次性滤膜抽滤除菌,然后分别制备含10%对照组大鼠灭活血清的DMEM(L)培养基和含10%补肾活血汤组大鼠灭活血清的DMEM(L)培养基。取含10%对照组大鼠灭活血清的DMEM(L)培养液,加入终浓度10 mmol/L β-甘油磷酸钠、50 mg/L维生素C和10-8mol/L地塞米松制备为含经典成骨诱导剂的DMEM(L)培养基。
1.5细胞获取及实验分组 脱臼法处死3只8周龄SD大鼠,无菌状态下获取大鼠BMSCs,采用全骨髓培养法培养BMSCs,传至第3代后用于实验。实验分为3组:空白对照组细胞在含10%对照组大鼠灭活血清的DMEM(L)培养基中培养,补肾活血汤含药血清组细胞在含10%补肾活血汤组大鼠灭活血清的DMEM(L)培养基中培养,经典成骨诱导剂组细胞在含经典成骨诱导剂的DMEM(L)培养基中培养。
1.6观察指标及方法
1.6.1BMSCs形态学观察及表面抗原鉴定 待第3代BMSCs铺满培养瓶底80%以上时,常规消化细胞;离心收集细胞,PBS洗涤2~3次;计数细胞,保持每100 μL PBS中含106个细胞;根据说明书每管加入抗体(CD105,CD90,CD73,CD44,CD45)染色,冰上避光孵育30~40 min;依次加入定量冷PBS,移至流式管中,上机,流式仪相应光学通道检测。
1.6.2BMSCs增殖率检测 实验分组同1.5。收集BMSCs,按每孔104个接种于96孔培养板培养24 h后,分别加入3组相应培养基中,再次培养1 d后加入10 μL CCK-8试剂,继续孵育1~4 h,在酶标仪490 nm处测定吸光值(OD值),每组6个复孔。同法依次检测培养2 d、3 d、4 d的细胞增殖率。
1.6.3碱性磷酸酶活性检测 实验分组同1.5。将BMSCs按每孔104个接种于96孔培养板培养24 h后,分别加入3组相应培养基中培养14 d后,参照碱性磷酸酶检测试剂盒说明书,酶标仪检测BMSCs中碱性磷酸酶活性,每组6个复孔。
1.6.4茜素红染色 实验分组同1.5。BMSCs细胞培养方法同1.6.3,培养21 d后倒掉培养基,PBS洗涤,4%多聚甲醛固定15 min,茜素红(pH 8.3)孵育30~40 min。镜下观察局部区域呈紫红色或红色代表钙结节形成或钙盐沉积。
1.6.5Wnt3a、β-catenin、CyclinD1和Runx2 mRNA表达RT-PCR检测 实验分组同1.5,3组细胞干预21 d后,参照EASYspin Plus大量组织/细胞RNA快速提取试剂盒说明提取总RNA。总RNA经分光光度计测定OD260/OD280比值介于1.8~2.0。反转录,参照TaKaRa Prime Script Ⅱ 1st Strand cDNA Synthesis Kit试剂盒说明书,20 mL体系合成cDNA。引物由上海生工生物工程股份有限公司设计合成,引物序列及退火温度见表1。PCR 扩增条件:94 ℃预变性3 min,94 ℃ 30 s,60 ℃ 30 s,72 ℃ 40 s,45个循环,72 ℃延伸7 min。PCR产物与内参GAPDH基因修正,将检测所得CT值转换为基因相对表达量进行统计学分析。

表1 Wnt/β-catenin信号通路相关因子RT-PCR检测引物序列和退火温度
1.7统计学方法 采用SPSS 26.0统计软件对数据进行分析,多组间比较采用单因素方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结 果
2.1BMSCs形态 全骨髓培养法获取BMSCs起初以悬浮为主,接种48 h后首次全量换液后可见数目较多的贴壁细胞,倒置相差显微镜观察主要为圆形、梭形、纺锤形、多角形等几种形状,培养10~14 d,细胞呈典型的集落样生长,中心呈旋涡状,贴壁细胞达80%~90%进行传代;第1代细胞增殖加快,大量细胞呈梭形生长,向外伸出伪足,细胞纯度增高;经过3次传代纯化后,第3代细胞形态单一,光镜下贴壁细胞呈现出成纤维状或纺锤状,贴壁生长迅速,细胞增殖快。各期BMSCs形态见图1。
2.2BMSCs表面抗原鉴定 传至第3代的BMSCs流式细胞仪检测显示,CD44阳性表达率为97.39%, CD45阳性表达率为1.69%,CD73阳性表达率为83.91%,CD90阳性表达率为80.19%,CD105阳性表达率为84.58%。见图2。
2.3BMSCs增殖情况 随着培养时间的延长,3组BMSCs增殖率逐渐增高;补肾活血汤含药血清组干预3 d、4 d的BMSCs增殖率均明显高于同期经典成骨诱导剂组和空白对照组(P均<0.05),经典成骨诱导剂组明显高于空白对照组(P<0.05)。见图3。
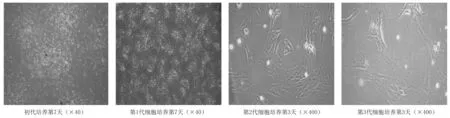
图1 不同时期的大鼠骨髓间充质干细胞形态

图2 流式细胞仪检测大鼠骨髓间充质干细胞表面抗原阳性表达情况
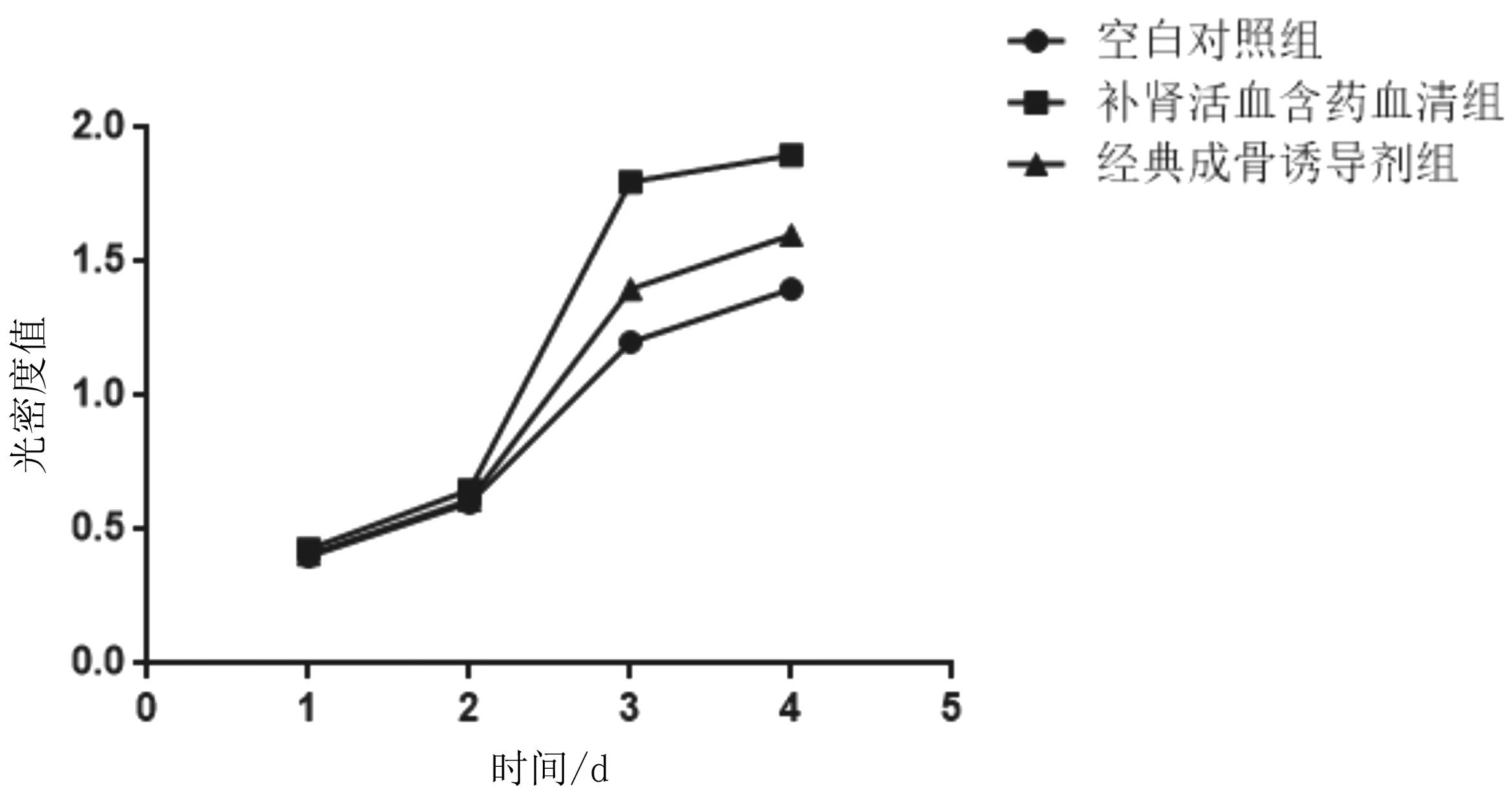
图3 各组大鼠骨髓间充质干细胞增殖情况
2.4BMSCs中碱性磷酸酶活性 干预14 d后,补肾活血汤含药血清组及经典成骨诱导剂组碱性磷酸酶活性均明显高于空白对照组(P均<0.05),补肾活血汤含药血清组与经典成骨诱导剂组比较差异无统计学意义(P>0.05)。见图4。
2.5茜素红染色BMSCs成骨分化情况 细胞培养21 d后,空白对照组未见明显阳性区域;补肾活血含药血清组和经典成骨诱导剂组可见明显片状阳性区域,由集落 为中心放射性向四周生长。见图5。
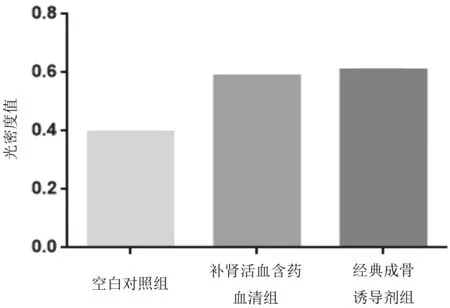
图4 干预14 d后各组大鼠骨髓间充质干细胞中碱性磷酸酶活性
2.6BMSCs中Wnt/β-catenin信号通路相关因子mRNA表达情况 补肾活血方含药血清组和经典成骨诱导剂组Wnt3a、β-catenin、CyclinD1、Runx2 mRNA相对表达量均明显高于空白对照组(P均<0.05),补肾活血汤含药血清组与经典成骨诱导剂组比较差异均无统计学意义(P均>0.05)。见图6。
3 讨 论
BMSCs是目前国内外研究的热点,其具有保持自我更新和多向分化的能力,可以分化为成骨细胞、脂肪细胞、软骨细胞、成纤维细胞、神经元、心肌细胞及肝细胞等[7-8]。大量研究证实,BMSCs的分化障碍在激素性股骨头坏死发生、发展中发挥了重要作用[9-10]。如何定向成骨诱导分化BMSCs可为骨质疏松、股骨头坏死等疑难疾病的治疗提供理论基础。

图5 干预21 d后各组大鼠骨髓间充质干细胞茜素红染色表现(×100)
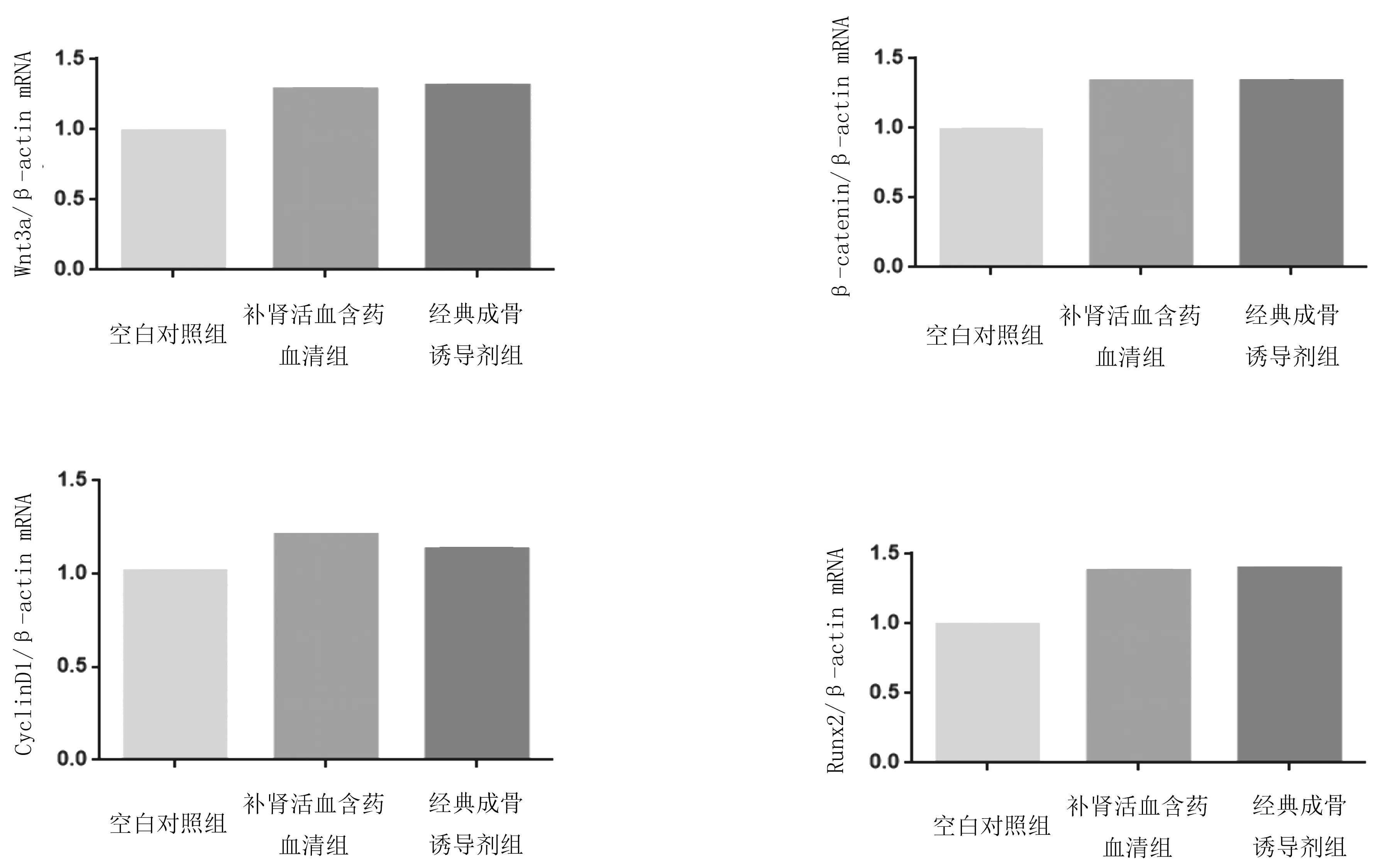
图6 干预21 d后各组大鼠骨髓间充质干细胞中Wnt 信号通路相关因子mRNA相对表达量
BMSCs缺乏特异性的识别标志,但是同时具有间充质细胞、上皮细胞和内皮细胞的特点[11]。Arufe等[12]认为BMSCs的标志物有CD105、CD90、CD73、CD44、CD45。随着研究的深入,体外分离纯化、培养扩增BMSCs及其鉴定技术都取得了巨大的进展。本研究采用成熟的全骨髓培养法培养、纯化BMSCs,与国内外研究一致,获得了较理想的用于体外实验的BMSCs。但是成骨诱导分化尚未形成统一的标准,目前诱导BMSCs成骨分化的方法众多,可以应用物理方法、化学药物、细胞因子促进其成骨分化,也可以通过骨细胞共培养、转基因作用和中药提取物作用下促成骨分化,其中补肾活血药物在MBSCs成骨诱导分化中显示出优势。
本实验所用补肾活血方中淫羊藿、杜仲、牛膝、鹿角胶填精益髓,壮阳生精,使“阳得阴生、阴得阳化,阴充阳旺而源不绝”;丹参、川芎、白芍活血化瘀,消肿止痛,“瘀血去、新血生,气血通达而痛自止”;佐以茯苓、香附健脾化饮,舒肝理气,行气滞以畅气机,化湿浊以行津液;使药甘草缓急止痛、调和诸药。本方从整体观念出发,治病求本,重在补肾健骨,同时活血化瘀,使气血通畅、筋骨强劲,从而起到改善股骨头坏死区域血供和缓解临床症状的目的。现代中药药理学研究表明,补肾药物可提高机体免疫功能,调节机体内激素水平,刺激BMSCs增殖、成骨分化和成熟[13-14]。本实验结果显示,补肾活血汤含药血清组及经典成骨诱导剂组BMSCs增殖率、碱性磷酸酶活性明显高于空白对照组,茜素红染色的阳性区域明显多于空白对照组,说明补肾活血汤具有明显促进BMSCs增殖和成骨分化的能力。
Wnt信号通路在骨骼发育和内稳态方面发挥着重要作用。Wnt/β-catenin信号途径由19种分泌蛋白家族组成,Wnt3a是现已知的一种蛋白。β-catenin是Wnt/β-catenin信号通路的核心蛋白,CyclinD1和Runx2是其信号通路下游重要的靶向蛋白。其中CyclinD1是细胞G1/S期行进中必不可少的细胞调节因子,主要功能是促进细胞增殖。β-catenin蛋白为间充质干细胞的成骨分化提供了一种分子转导信号,并且实验证实β-catenin 可通过增强间充质干细胞对于骨形态发生蛋白-2(BMP-2)的应答来诱导其向成骨细胞分化[15]。Gaur等[16]研究表明,Runx2是经典Wnt通路中的一个靶基因,β-catenin的稳定表达和TCF1的激活能够启动早期成骨细胞转录因子Runx2/Cbfa1/Aml3表达,从而决定BMSCs向成骨细胞的分化。近年来国内外学者均认为激活经典Wnt信号通路可以促进BMSCs向成骨分化。刘光旺等[17]研究表明补肾填精中药血清可通过激活Wnt/β-catenin信号通路促进去势小鼠BMSCs成骨分化。李新建等[18]研究表明,补肾活血汤能够通过激活Wnt/β-catenin信号通路促进兔激素性股骨头缺血坏死BMSCs的成骨分化。本实验结果显示,补肾活血汤和经典的成骨诱导剂都可以促进Wnt/β-catenin信号通路成骨因子Wnt3a、β-catenin、CyclinD1和Runx2的表达,促进成骨分化。
综上所述,补肾活血汤可以促进BMSCs的增殖与成骨分化,其机制可能与经典Wnt信号通路的激活有关,这对于激素性股骨头坏死的治疗有重要意义。但是补肾活血汤成分复杂,作用靶点多,其促进BMSCs增殖与成骨分化的机制还有待于进一步研究、探讨。
利益冲突:所有作者均声明不存在利益冲突。

