CO-15%CO2 混合气体还原碳化MoO2 制备Mo2C 的动力学机理分析
王 璐,李红肖,阙标华,薛正良
1) 武汉科技大学钢铁冶金及资源利用省部共建教育部重点实验室,武汉 430081 2) 佛山(华南)新材料研究院,佛山 528200 3) 武汉科技大学省部共建耐火材料与冶金国家重点实验室,武汉 430081
碳化钼(Mo2C)是由C 原子填入至Mo 晶格而形成的一类间充型过渡金属碳化物,具有类似铂族金属的电子结构与表面性质,在加氢脱硫、加氢脱氮、烷烃合成与异构化、燃料电池和电解水析氢等方面展现出优异的催化效能,可与铂、铱和铑等贵金属相媲美,是一种非常有潜力的铂族金属替代物,被誉为“类铂催化剂”[1-4].Mo2C 优异催化性能的发现,有望解决铂族金属大量消耗及能源紧缺的问题.因此,研发低成本、高效率、简便快捷的Mo2C 制备方法逐渐受到材料领域和催化领域专家学者们的广泛关注[5-6].
Mo2C 传统的制备方法是将金属钼和活性炭置于球磨机内机械活化,而后在真空气氛中历经碳化而得[7].该法较为简单,但需较高的温度和压力,对设备要求极高,而且生成的产物颗粒粗大、比表面积较低.近年来,国内外学者对Mo2C 粉体进行了制备方法的探索,其中比较常见的有碳热还原法[8]、程序升温法[9]、气相沉积法[10]、单源前体法[11]和超声波合成法[12]等.程序升温法是实验室研究最多也是工业实践应用中最为普遍的一种制备方法,但是该法作为反应介质的烃类或烃类/氢气的混合气体在高温下极易发生裂解,以致后期积碳较多,产物不纯[13-15];反应过程中生成的产物水同样会导致最终产物与中间产物发生水热烧结或晶格流化,进而降低产物比表面积.而COCO2混合气体在反应过程中能够有效避免产物水和沉积碳的产生[16-18],且其在其他过渡金属氧化物的反应方面也进行了大量研究[19-22],是一种具有较广应用前景的还原-碳化气体,在程序升温制备Mo2C 方面具有巨大优势.为此,本文以MoO2为原料,CO2体积分数为15%的CO-15%CO2混合气体为还原-碳化剂对Mo2C 粉体的制备进行研究;结合热力学计算、场发射扫描电子显微镜 (FESEM)、X 射线衍射(XRD)、热重(TG)、比表面积测试(BET)等手段和方法对反应过程的动力学和机理以及产物性能进行表征,以期为规模制备Mo2C粉体材料提供新的途径和思路.
1 实验原料和步骤
1.1 实验原料
原料为分析纯MoO2粉末(纯度99.95%),XRD分析确定其主要成分为MoO2,几乎不含其他杂质组分;FE-SEM 显示该粉末主要呈片状且表面致密光滑,如图1 所示.课题组前期在采用不同体积比的CO-CO2混合气体还原MoO3时发现:当CO2体积分数为零(高纯CO)时,在反应后期会有少许自由碳析出;当CO2体积分数增至15%时,反应后期失重率几乎接近恒值,产物为Mo2C;继续增加CO2体积分数至45%时,最终产物则为MoO2[23].结果表明混入一定体积CO2的CO-CO2混合气体可以有效减少析碳反应的发生,提高产物纯度;然而,若CO2体积分数过高,MoO2则不能被进一步还原,Mo2C 无法制出.因此,综合考虑选取CO2体积分数为15%的CO-15%CO2混合气体为本实验所用反应气体介质.

图1 MoO2 粉末.(a) XRD 图;(b) FE-SEM 形貌图Fig.1 MoO2 powder: (a) XRD pattern;(b) FE-SEM morphology
1.2 实验步骤
具体实验装置示意图参考前期工作[24].变温实验中,在氧化铝坩埚内装入约70 mg MoO2粉末,然后分别以2、5、10 和15 K·min-1的升温速率加热炉体同时通入100 mL·min-1的CO-15%CO2混合气体进行程序升温还原,反应结束后通入同等流量的高纯氩气作为保护气氛直至样品冷却至室温.恒温实验中,首先以10 K·min-1的升温速率加热炉体并通氩气以排尽反应体系中的空气,当样品温度达到指定值之后,将氩气切换为CO-15%CO2混合气体至反应接近平台重量不再变化;之后再次切换为氩气直到冷却至室温;最后收集不同条件所得产物进行物相转变和形貌演变规律分析.
2 结果
2.1 动力学曲线
图2 为CO-15%CO2混合气体下程序升温还原MoO2的变温动力学曲线.整个升温反应阶段曲线呈现“S”形状;当升温速率从2 K·min-1逐步提高至5、10 和15 K·min-1时,MoO2的开始还原温度从953 K 逐渐升高至997、1015 和1031 K;反应完全时的温度从1100 K 逐渐升高至1201、1318 和1383 K.不同升温速率下反应失重率相近且接近恒值,与MoO2完全还原碳化成Mo2C 的理论失重率(20.322%)相符,如式(1)和(2)所示.
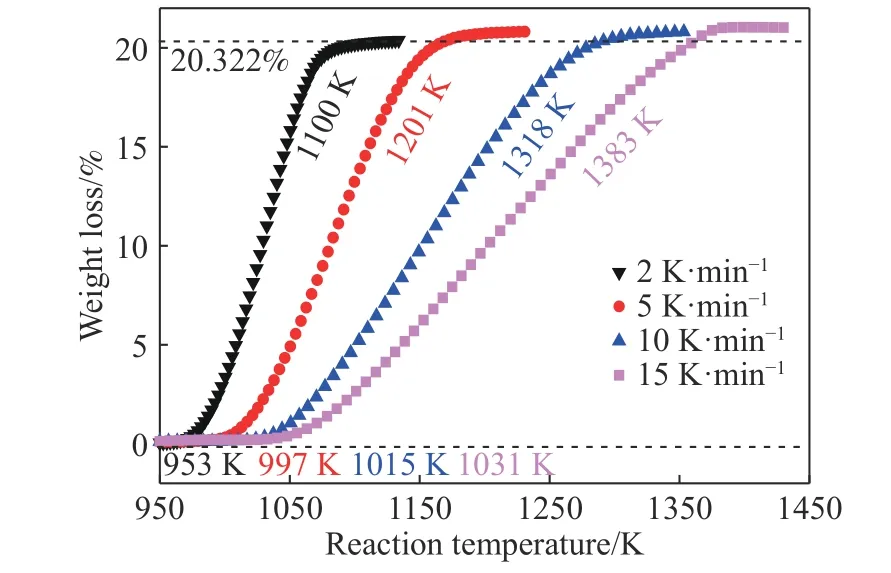
图2 CO-15%CO2 混合气体下程序升温还原MoO2 的变温动力学曲线Fig.2 Nonisothermal kinetic curves for the temperature-programmed reduction of MoO2 by CO-15%CO2 mixed gases
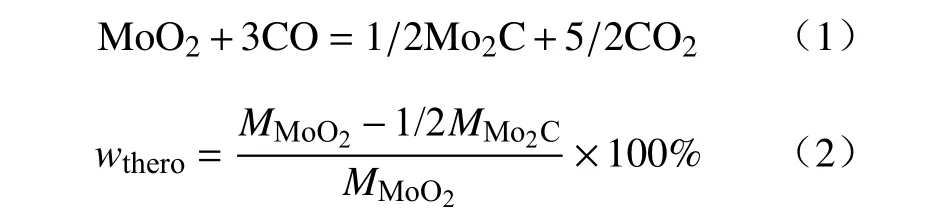
式中,MMoO2和MMo2C分别为MoO2和Mo2C 的摩尔质量,g·mol-1;wthero为反应(1)的理论失重率.
图3 为CO-15%CO2混合气体下恒温(993~1153 K)还原MoO2的动力学曲线.从图中可以看出,6 个特定反应温度下反应物的失重率约为18.8%,与理论失重率(20.322%)存在一定偏差.且温度越高,反应速率越快;然而,当反应温度升至1123 K 之后,继续升高温度反应速率的增幅减缓.
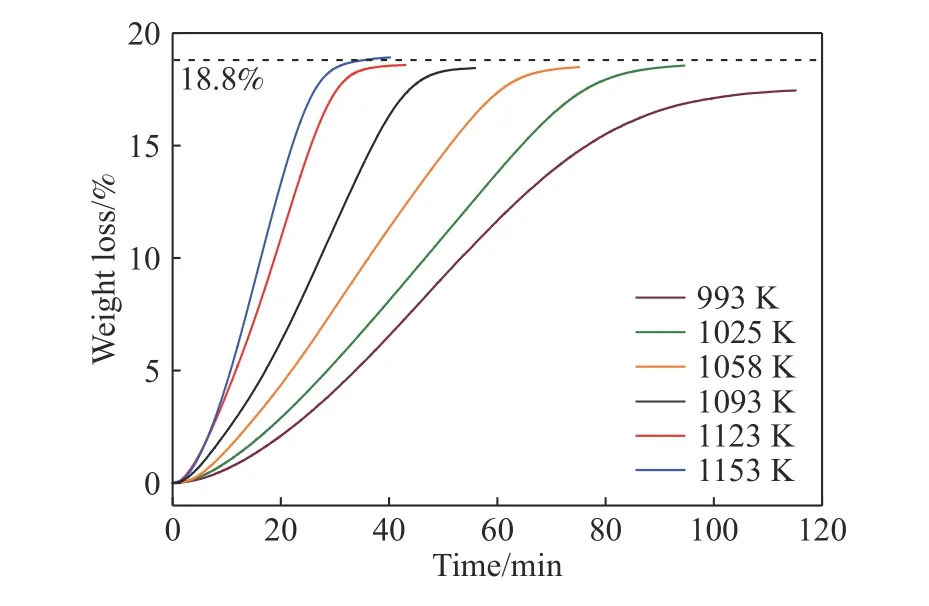
图3 CO-15%CO2 混合气体下恒温还原MoO2 的动力学曲线Fig.3 Isothermal kinetic curves for the reduction of MoO2 by CO-15%CO2 mixed gases
2.2 XRD 衍射分析
图4 显示升温速率分别为2、5、10 和15 K·min-1时MoO2粉末在CO-15%CO2混合气体下经程序升温还原所得最终产物的XRD 检测结果.通过与Mo2C 标准卡片(PDF : 35-787)比较发现,4 个升温速率下所得样品所有衍射峰均与Mo2C 标准卡片特征峰完全对应,表明变温实验所得产物均为Mo2C,这与图2 所得反应失重率相符.
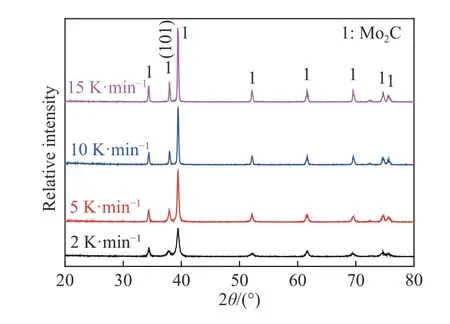
图4 不同升温速率下CO-15%CO2 混合气体中程序升温还原MoO2 所得最终产物XRD 结果Fig.4 XRD patterns of the samples obtained by the temperatureprogrammed reduction of MoO2 by CO -15%CO2 mixed gases at different heating rates
CO-15%CO2混合气体在993~1153 K 范围内恒温还原MoO2所得最终产物XRD 衍射结果如图5(a)所示.从图中可以看出,6 个温度下所得产物衍射峰均与Mo2C 标准卡片(PDF: 35-787)特征峰完全一致,表明恒温下反应所得产物为Mo2C.此外,随着温度升高,39.436°对应的特征衍射峰逐渐变得瘦高,表明产物结晶度逐渐升高.根据(101)晶面衍射峰对应的半高宽,利用谢乐公式(3)[25]计算不同温度下Mo2C 的晶粒尺寸,结果如图5(b)所示,表明温度越高,晶粒尺寸越大;且晶粒尺寸与温度之间具有良好的线性关系,相关系数R高达0.982,拟合结果如式(4)所示.

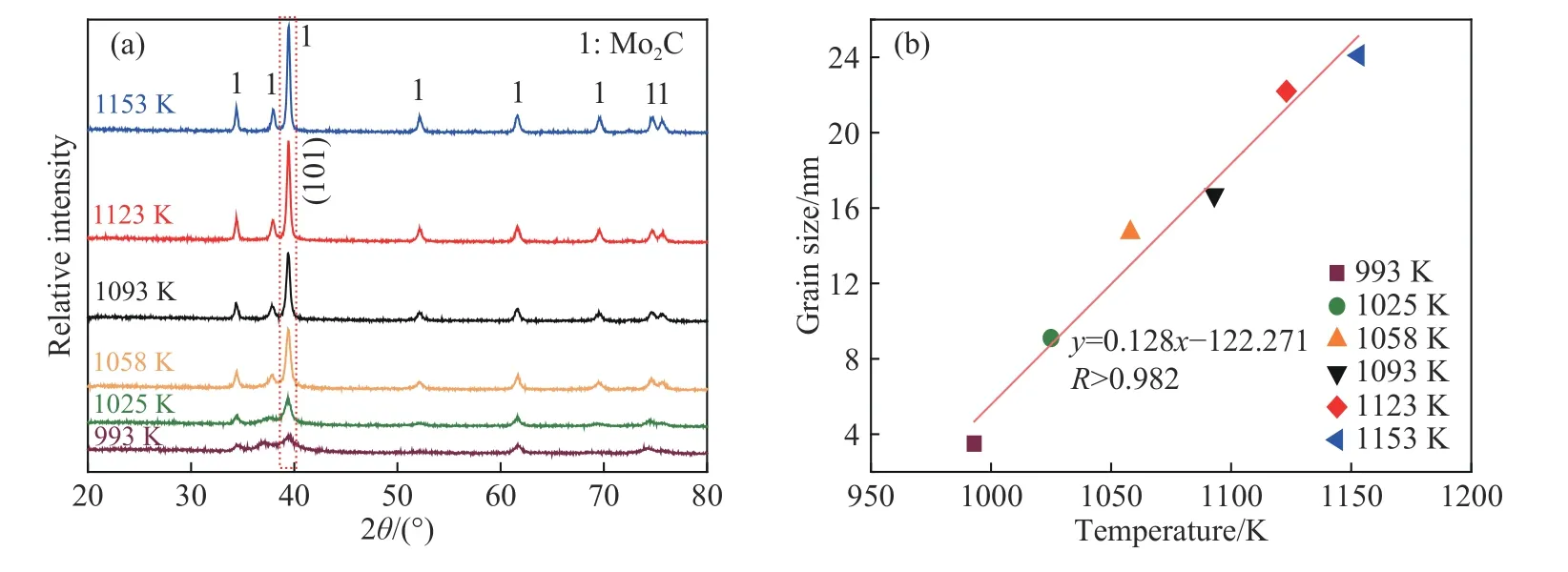
图5 CO-15%CO2 混合气体恒温还原MoO2 所得产物结果图.(a) 物相分析;(b) 晶粒尺寸Fig.5 Results of the product obtained by reducing MoO2 with CO-15%CO2 mixed gases at different temperatures: (a) XRD pattern;(b) grain size
式中,D为垂直于某个晶面的晶粒尺寸,nm;K为谢乐常数,此处取值0.890;γ为X 射线波长,0.1540 nm;B为样品衍射峰半高宽,rad;θ为布拉格衍射角,°.
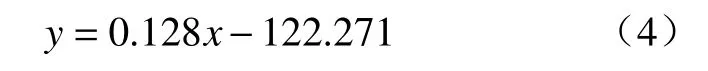
为了探明MoO2转变为Mo2C 的反应过程,本文以993 K 为例研究该反应不同进度下所得产物的物相演变,截取的3 个中间阶段(α=0.263、0.503和0.744)位置以及所得产物XRD 检测结果如图6所示.α为反应进度,定义为某一时刻反应物的实际失重率与该反应达到平台时的最大失重率之比,如式(5)所示.由图6(b)可知,不同反应进度下所得产物的衍射峰均与MoO2或Mo2C 相对应,表明MoO2转变为Mo2C 反应为一步反应,没有中间物相的生成.
图6 (a)CO-15%CO2 混合气体在993 K 下还原MoO2 的失重曲线;(b)不同反应进度下对应产物的XRD 结果Fig.6 (a) kinetic curves of the reduction of MoO2 by CO-15%CO2 mixed gases at 993 K;(b) XRD patterns of the samples obtained at different reaction extents

式中,wt为某一时刻t该反应的实际失重率,%;wmax为反应达到平台时的最大失重率,%.
2.3 FE-SEM 观察
图7 展示了升温速率为2、5、10 和15 K·min-1时CO-15%CO2混合气体程序升温还原MoO2所得产物形貌结果.可以看出,产物Mo2C 保持与原料MoO2一致的薄片状;当升温速率为2 和5 K·min-1时,Mo2C 表面较为平整光滑,然而部分裂纹和孔隙同样存在(图7(a)红圈区域);当升温速率为10 K·min-1时,Mo2C 表面开始变得粗糙(图7(c));继续提高升温速率至15 K·min-1,反应结束时温度高达1383 K(图2),此时Mo2C 表面变得更加粗糙,褶皱和裂纹更为明显,如图7(d)所示.

图7 CO-15%CO2 混合气体在不同升温速率下还原MoO2 所得产物形貌.(a) 2 K·min-1;(b) 5 K·min-1;(c) 10 K·min-1;(d) 15 K·min-1Fig.7 Morphologies of the samples obtained by the temperatureprogrammed reduction of MoO2 by CO -15%CO2 mixed gases at different heating rates: (a) 2 K·min-1;(b) 5 K·min-1;(c) 10 K·min-1;(d) 15 K·min-1
图8 为不同温度下CO-15%CO2混合气体恒温还原MoO2所得Mo2C 的形貌图.从图中可以看出,Mo2C 与原料MoO2具有相似的片状形貌,但不同反应温度下,产物形貌存在一些细微差异.当温度较低(993 和1025 K)时产物较为致密,多面体或椭圆形状颗粒居多(图8(a)和(b));当温度升至1058 K 时,产物表面开始变得粗糙,多面体或椭圆形颗粒减少,薄片状颗粒增多(图8(c));继续升高温度至1093、1123 和1153 K 时,产物几乎全为薄片状颗粒,与原料形貌极为相似,同时微孔和裂纹同样存在,这与变温实验结果相似.

图8 不同温度下CO-15%CO2 混合气体恒温还原MoO2 所得Mo2C 形貌图.(a) 993 K;(b) 1025 K;(c) 1058 K;(d) 1093 K;(e) 1123 K;(f) 1153 KFig.8 Morphologies of the samples obtained by the isothermal reduction of MoO2 to Mo2C by CO-15%CO2 mixed gases at different temperatures: (a) 993 K;(b) 1025 K;(c) 1058 K;(d) 1093 K;(e) 1123 K;(f) 1153 K
图9 为MoO2在993 K 下经CO-15%CO2混合气体恒温还原不同反应进度时所得产物形貌图.整个反应过程中,产物形貌没有发生明显变化,呈现表面较为光滑的薄片状,与MoO2原料一致.同样,反应后期产物表面部分微孔和裂纹同样存在,这与图7 和图8 结果相符.

图9 993 K 下CO-15%CO2 混合气体恒温还原MoO2 不同反应进度所得产物形貌.(a1~a3) α=0.263;(b1~b3) α=0.503;(c1~c3) α=0.744;(d1~d3) α=1Fig.9 Morphologies of the samples obtained by reducing MoO2 with CO-15%CO2 mixed gases at 993 K for different reaction extents: (a1-a3)α=0.263;(b1-b3) α=0.503;(c1-c3) α=0.744;(d1-d3) α=1
3 讨论
3.1 反应机理分析
由XRD 结果可知,CO-15%CO2混合气体恒温还原MoO2在不同反应进度所得产物均只含MoO2和Mo2C,而不存在其他中间物相,表明Mo2C是由MoO2和混合气体经一步反应所得.研究表明[26],高纯CO 在低温下(1070~1342 K)还原MoO2至Mo2C 为一步反应机理,然而在高温下(1423~1485 K),MoO2则优先还原成金属Mo,而后金属Mo 再进一步碳化成Mo2C,两者独立依次分开进行.本文所用温度介于1070~1342 K 之间甚至更低,故研究结果与文献[26]报告相符.热力学软件FactSage 7.3[27]计算所得CO-MoO2二元相图(图10)结果表明,MoO2转变至Mo2C 的临界温度大约为907 K,比本文变温实验所测最低开始反应温度(953 K)略低.分析温度产生偏差的原因可能在于相图所标温度是在理想平衡状态下所测,与本文实际反应所处气氛、温度、时间等因素存在较大差异.随着反应的进行,产物整体形态基本保持原料的片状形貌,然而在颗粒表面出现微孔和褶皱,这可解释为:1 mol 的MoO2经反应生成0.5 mol Mo2C,而两者之间存在较大密度差异;当MoO2原料密度由6.470 g·cm-3增至Mo2C产物的9.180 g·cm-3时,对应的摩尔体积则由19.774 cm3·mol-1缩减至11.105 cm3·mol-1[23],即该反应在实际进行过程中存在体积缩减行为,因此产物颗粒表面会产生大量裂纹和微孔以维持整体一致的片状形貌特征.该反应机理如图11 所示.

图10 CO 和MoO2 二元相图Fig.10 Binary phase diagram between CO and MoO2
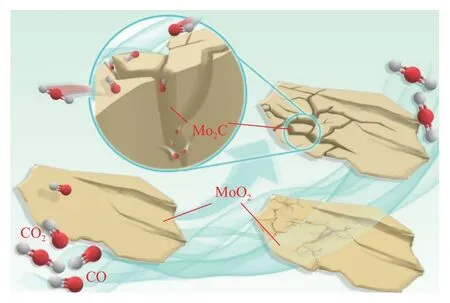
图11 CO-15%CO2 混合气体还原MoO2 为Mo2C 的反应机理图Fig.11 Mechanism for the reduction of MoO2 to Mo2C by CO-15%CO2 mixed gases
BET 测试结果表明1213 K 下所得产物比表面积为12.863 m2·g-1,该值远大于C 还原MoCl2制备的Mo2C 比表面积(2.311 m2·g-1)[28],和采用urea-glass法制出的Mo2C 粉末比表面积(9.101 m2·g-1)[29].值得注意的是,本文所用原料MoO2的比表面积仅为0.650 m2·g-1,制成Mo2C 之后,比表面积增大约20 倍.比表面积的显著增加极有可能是Mo2C 表面大量褶皱、中孔或微孔的产生所致.另外,本文采用的是添加一定CO2体积分数的CO-15%CO2混合气体,反应过程中CO 的析碳反应受到抑制,生成的沉积碳减少,这是Mo2C 比表面积增加的又一重要原因.饱和KCl 溶液中的线性扫描伏安曲线结果(图12)表明采用该法制出的Mo2C 电催化析氢性能较好.由此可以预测,若采用颗粒更小或比表面积更大的MoO2为起始原料,可能制备出更优催化性能的Mo2C.
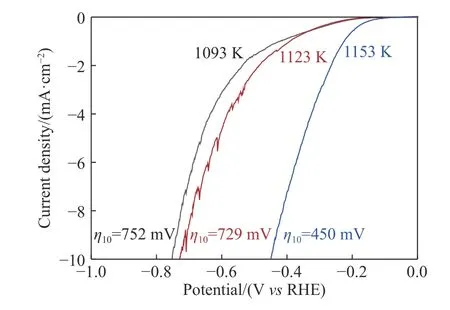
图12 不同温度下制备的Mo2C 样品的线性扫描伏安曲线Fig.12 Linear sweep voltammetry curves of the samples obtained at different temperatures
3.2 动力学分析
3.2.1 模型的选择
本法制备的Mo2C 表面存在微孔和裂纹有利于气体反应物穿过产物层,扩散阻力较小,故气体的扩散不太可能为该反应的控速环节[30].且恒温动力学曲线呈现“S”形状,温度越低,诱导期越长,故可推知形核与核心长大极有可能为该反应的限制性环节.从图3 还可看出,动力学曲线的中间部分线性关系较好,表明化学反应也有可能为该反应的控速环节.为进一步探究CO-15%CO2混合气体还原MoO2至Mo2C 的限制性环节,以1093 K下的动力学数据为例,采用不同的气固反应动力学模型进行线性拟合,结果如图13 所示.本文所用常见形核与核心长大、化学反应动力学模型方程如表1 所示[31-33],其中,k为机理函数速率常数,可由阿伦尼乌斯方程表示:

图13 不同模型拟合1093 K 下的动力学数据.(a) 形核与核心长大模型;(b) 化学反应模型Fig.13 Kinetic-fitting results for the experimental data obtained at 1093 K with different gas-solid reaction models: (a) nucleation-growth model;(b) chemical reaction model
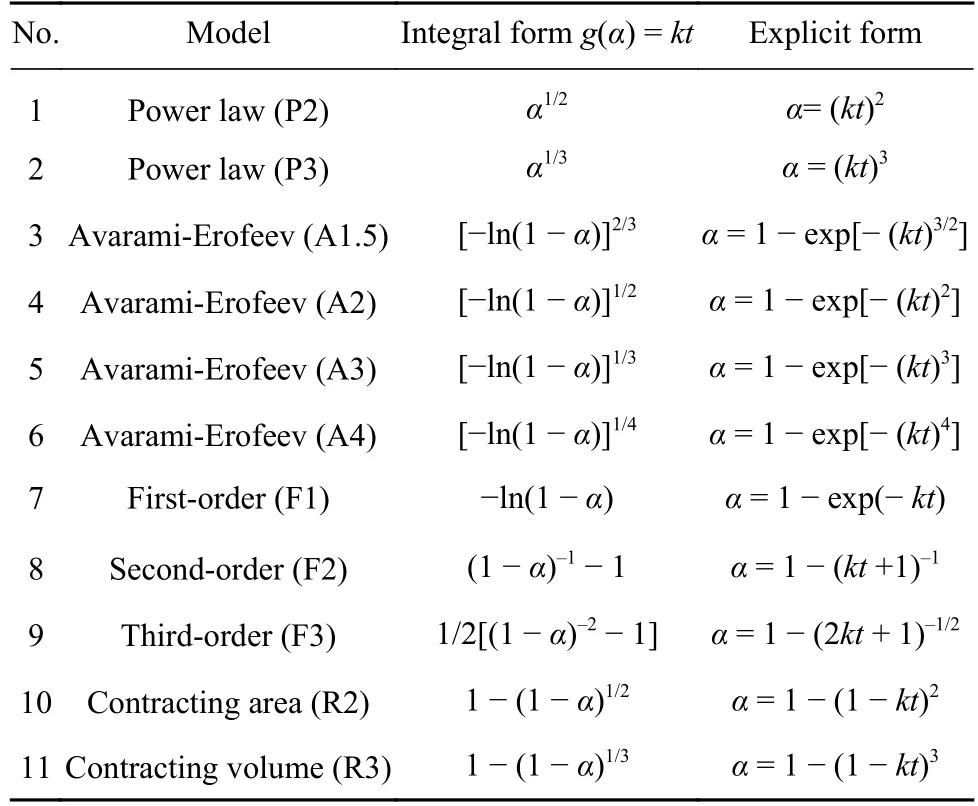
表1 常见的气固反应动力学模型方程[31-33]Table 1 List of the common gas-solid reaction kinetic models[31-33]
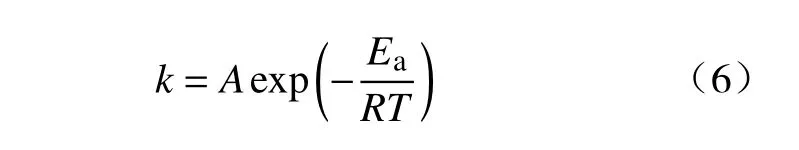
式中,A为指前因子,min-1;Ea为表观活化能,J·mol-1;R为气体常数,8.314 J·mol-1·K-1;T为 温度,K.由图13 可知,形核与核心长大模型和化学反应模型的拟合结果均不能很好地对实验数据进行表达,即该反应不是由单一方式控速.在图13(a)所示形核与核心长大模型中,A3 模型拟合线性关系较好,而在图13(b)所示化学反应模型中,R2 模型拟合结果较好;由此可推知,CO-15%CO2混合气体还原MoO2至Mo2C 的过程极有可能为A3 模型和R2 模型共同控制.
3.2.2 模型的应用
假定总反应进度α由式(7)表示:

式中,r1和r2为分别为A3 模型(α1)和R2 模型(α2)的比例系数[34-35].本文以1093、1123 和1153 K下的数据为例,将上述线性关系较好的A3 模型和R2 模型分别代入式(7)进行计算,结果如图14 所示.可以看出,采用A3 和R2 的组合模型所得拟合结果非常贴合实验数据,相关系数高达0.991,其中形核与核心长大模型A3 和化学反应模型R2 占比分别为68.9%和31.1%,对应的表观活化能分别为80.651 和121.002 kJ·mol-1.因此,CO-15%CO2混合气体还原MoO2至Mo2C 的反应动力学方程可表示为:
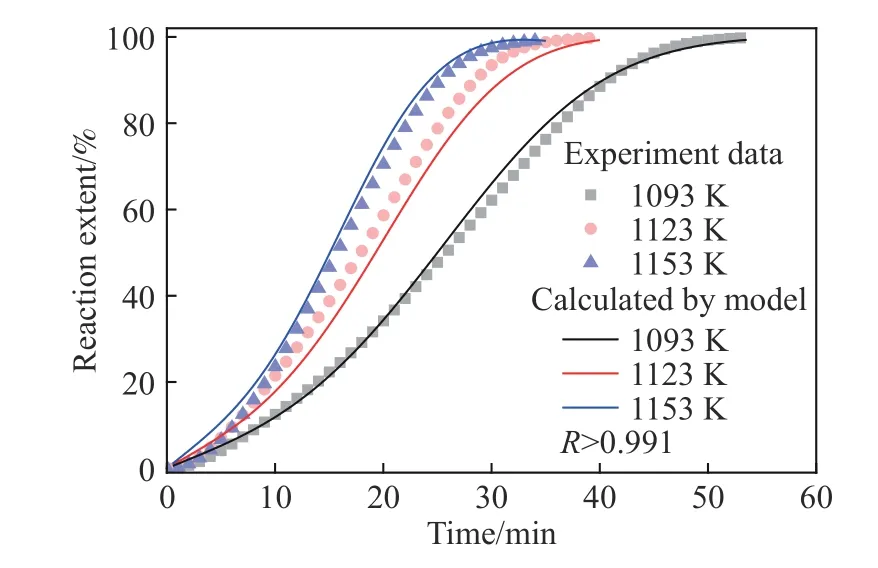
图14 1093、1123 和1153 K 下恒温动力学曲线和拟合结果比较Fig.14 Comparisons of fitting and measured reaction extent vs reaction time curves for the experimental data obtained at 1093,1123,and 1153 K
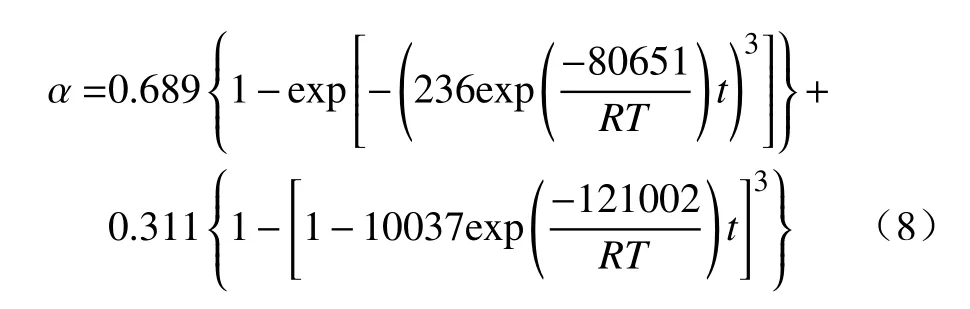
4 结论
(1) CO-15%CO2混合气体程序升温还原MoO2过程中,升温速率越快,MoO2的开始反应温度和完全反应温度均越高;恒温还原实验过程中,温度越高,反应速率越快.
(2) 反应所得产物Mo2C 基本保持与原料MoO2相似的片状形貌,然而由于气体的逸出、产物摩尔体积的缩减以及沉积碳的减少,产物比表面积比原料显著升高,由原料的0.650 m2·g-1增至12.863 m2·g-1,增幅约20 倍.
(3) 动力学分析表明CO-15%CO2混合气体还原MoO2至Mo2C 的过程由形核与核心长大(A3)模型和化学反应(R2)模型共同控制;其中A3 模型占比68.9%,求取的表观活化能为80.651 kJ·mol-1;R2 模型占比31.1%,求取的表观活化能为121.002 kJ·mol-1.

