两种新型冠状病毒核酸检测试剂盒的性能验证
方炳雄,陈晓佳,刘 琪,赵 炜,阮 杰* (.普宁市人民医院精准医学中心,广东普宁 55300;.广东医科大学医学技术学院,广东东莞 53808)
新型冠状病毒(SARS-CoV-2)是β 属单股正链RNA病毒,为有包膜的RNA 病毒[1]。该病毒的全基因组序列是由冠状病毒开放阅读框(ORF)、核壳蛋白N 基因和包膜蛋白E 基因等组成[2-3]。国家卫生健康委员会发布《新型冠状病毒肺炎诊疗方案(试行第八版修订版)》指出:新型冠状病毒的病原体检测方法主要是实时荧光定量聚合酶链反应(荧光PCR 法)[4]。根据中国合格评定国家认可委员会(CNAS)《医学实验室质量和能力认可准则及其在分子诊断领域的应用说明(CNAS-CL02-A009)》文件要求,临床实验室开展分子诊断检验项必须进行检测系统的性能验证,分子诊断领域中定性检测项目验证内容至少应包括检测下限、特异性、抗干扰能力、准确度等[5-6]。本研究参照中国合格评定国家认可委员会(CNAS)制定的CNASGL039《分子诊断检验程序性能验证指南》[7],利用新型冠状病毒核酸性能验证参考品和广东省新型冠状病毒检测室间质控品对两种国产的新型冠状病毒核酸检测试剂盒的灵敏度、精密度、准确度、特异性及抗干扰能力进行性能验证,以期为同行在开展新项目制定性能验证方案时提供参考。
1 资料和方法
1.1 标本来源
性能验证参考品来自广州邦德盛生物科技有限公司的新型冠状病毒(SARS-CoV-2)核酸性能验证参考品(规格型号:BDS-CKP-034,批号:2021001),其中包含阳性参考品、检测限参考品、分析特异性参考品、精密度参考品和干扰物参考品。标准物质浓度为2.0E+05 copies/μL,编号为GBW(E)091132。广东省新型冠状病毒检测室间质控品来自广东省临床检验中心,用于全省核酸检测质量控制评价标本。编码为20200301、20200302、20200303、20200304、20200305和20210201、20210202、20210203、20210204、20210205。
1.2 试剂与仪器
检测试剂来自国产的新型冠状病毒2019-nCOV的核酸检测试剂盒(荧光PCR 法),一种是国械注准20203400063,生产批号2020095,检测时间为110 min,下文称为试剂A;另一种是国械注准20203400749,生产批号:2021094,检测时间为70 min,下文称为试剂B。使用全自动核酸提取仪(杭州奥盛仪器有限公司Auto-Pure 32A)与核酸提取或纯化试剂盒(广州赛百纯生物科技有限公司,批号:SUP011602-21-0114)配套进行核酸提取。采用ABI Q5 实时荧光定量PCR 仪(美国Applied Biosystems quantstudio 5)进行扩增检测。
1.3 检测方法及结果判读
按照核酸提取试剂说明书提取参考品的核酸,按照检测试剂盒说明书操作,试剂A 的扩增反应条件为:50 ℃ 15 min,95 ℃ 15 min,94 ℃ 15 s,55 ℃ 45 s,45个循环,在55 ℃采集荧光信号。若检测样本在FAM和VIC 通道Ct 值≤40,且有明显的扩增曲线,则判断样本2019 新型冠状病毒阳性;若检测样本在FAM 和VIC 通道无扩增曲线或Ct 值>40,且Cy5 通道有扩增曲线,则判断样本2019 新型冠状病毒阴性;若检测样本仅在FAM 或VIC 单一通道Ct 值≤40,另一通道无扩增曲线,结果需复检,复检结果一致则可判断为阳性,复检结果为阴性则判断为阴性。
试剂B 的扩增反应条件为:50 ℃ 2 min,95 ℃2 min,95 ℃ 5 s,60 ℃ 35 s,10 个循环;95 ℃ 5 s,60℃ 35 s,32 个循环,在60 ℃采集荧光信号。若检测样本在FAM 和VIC 通道Ct 值≤30,且有明显的扩增曲线,则判断样本2019 新型冠状病毒阳性;若检测样本在FAM 和VIC 通道无扩增曲线或Ct 值>30,且Cy5 通道有扩增曲线,则判断样本2019 新型冠状病毒阴性;若检测样本仅在FAM 或VIC 单一通道Ct 值≤30,另一通道无扩增曲线,结果需复检,复检结果一致则判断为阳性,复检结果为阴性则判断为阴性。
1.4 性能验证实验
1.4.1 灵敏度实验 利用广州邦德盛生物科技有限公司提供的5 个检测限参考品(L1-L5)以及不含SARSCoV-2 RNA 的RNA 样品稀释液共同制备的阳性参考品进行检测,其浓度分别为2.0E+05、2.0E+04、2.0E+03、5.0E+02、2.5E+02 和1.25E+02 copies/mL。厂家声称的最低检测限为500 copies/mL,前3 个浓度重复检测10 次,后3 个浓度重复检测20 次。要求应符合厂家声称的最低检测限,且阳性符合率应≥95%。
1.4.2 精密度实验 利用广州邦德盛生物科技有限公司提供的精密度参考品进行检测,其中包含R1(低值)SARS-CoV-2-RNA 2.0E+03 copies/mL 阳性标本和R2(中值)SARS-CoV-2-RNA 2.0E+04 copies/mL阳性标本。利用同一样本重复检测10 次,计算变异系数(CV)值,用于评价实验的重复性,要求CV 值不超过5%。
1.4.3 准确度实验 利用本实验室参加2020 年和2021 年两次广东省临床检验中心提供的新型冠状病毒检测室间质评及广州邦德盛生物科技有限公司提供的阳性参考品,共20 个样本评价试剂盒的准确性,按照临床样本检测流程进行实验,通过实验结果与样本信息比较,计算出准确度。
1.4.4 特异性实验 验证与新型冠状病毒种属相近或引起症状相似的其他病原体,如人冠状病毒HCoVOC43、人冠状病毒HCoV-HKU1、人冠状病毒HCoV-229E、人冠状病毒HCoV-NL63、新型冠状病毒SARS、甲型流感病毒、乙型流感病毒、呼吸道合胞病毒、人副流感病毒、腺病毒、肠道病毒、肺炎支原体、EB 病毒、人巨细胞病毒、结核分枝杆菌以及2 个人类基因组DNA 标本有无交叉反应。本次特异性实验对每个标本重复检测2 次,检测结果均为阴性,则特异性验证实验符合要求。
1.4.5 抗干扰实验 验证咽拭子或痰液标本中可能存在的血红蛋白、白蛋白、胆红素、甘油三酯、总Ig G、总Ig M 和抗核抗体,以及样本中可能存在的新型冠状病毒治疗药物,如利巴韦林+阿奇霉素、奥司他韦、阿奇霉素、头孢曲松、妥布霉素、盐酸组胺和氯化钠是否会干扰新型冠状病毒核酸检测。干扰物参考品是加入干扰物质的弱阳性标本,浓度为2.0E+03 copies/mL,干扰物参考品样本信息如表1 所示。利用参考品进行核酸提取,每个参考品重复检测2 次,要求标本中可能存在的内源性物质或治疗药物对检测结果无干扰。

表1 干扰物参考品样本信息
2 结果
2.1 灵敏度实验
在2.0E+05、2.0E+04、2.0E+03、5.0E+02、2.5E+02和1.25E+02 copies/mL 6 个浓度中,试剂A 的阳性率均为100%,检出限为1.25E+02 copies/mL;试剂B 在前5 个浓度的阳性率为100%,在第6 个浓度阳性率为50%(10/20),检出限为2.5E+02 copies/mL。如图1、2 所示,试剂A 和试剂B 在500 copies/mL 中检测阳性率均为100%,能够达到厂家检出限500 copies/mL 的要求,灵敏度验证合格。

图1 试剂A 灵敏度扩增曲线(左图为2.5E+02 copies/mL,右图为1.25E+02 copies/mL)
2.2 精密度实验
在2.0E+03 copies/mL(R1)水平,试剂AN基因的CV 值为0.37%,ORF1ab基因的CV 值为0.61%;试剂BN基因的CV 值为1.23%,ORF1ab基因的CV值为1.48%。在2.0E+04 copies/mL(R2)水平,试剂AN基因的CV 值为0.16%,ORF1ab基因的CV 值为0.22%;试剂BN基因的CV 值为0.87%,ORF1ab 基因的CV 值为0.54%。两种试剂的CV 值均小于5%,符合试剂说明书的要求,精密度验证合格。
2.3 准确度实验
10 个室间质评标本和10 个阳性参考品的两种检测试剂检测结果与已知结果一致,一致率为100%,符合试剂说明书的要求,准确度验证合格。检测结果如表2 所示。

表2 两种试剂的准确度验证结果
2.4 特异性实验

图2 试剂B 灵敏度扩增曲线(左图为5.0E+02 copies/mL,右图为2.5E+02 copies/mL)
检测16 个含有与新型冠状病毒种属相近或引起症状相似的其他病原体及2 个含人类基因组DNA的参考品,每个参考品重复2 次检测。原始荧光多组分曲线(Multicomponent Plot)如图3 所示,扩增曲线(Amplification Plot)如图4 所示。参考品的N 基因和ORF1ab 基因均无扩增曲线,图中的扩增曲线为内标基因Cy5,表明以上病原体间不存在交叉反应,特异性好,符合试剂说明书要求,特异性验证合格。
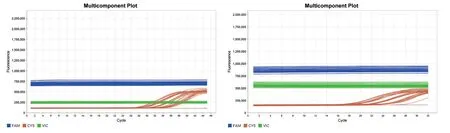
图3 特异性实验荧光多组分曲线图(左为试剂A,右为试剂B)

图4 特异性实验扩增曲线(左为试剂A,右为试剂B)
2.5 抗干扰实验
检测14 种在咽拭子或痰液标本中可能存在的内源性干扰物或新型冠状病毒治疗药物的干扰物参考物,重复测定2 次,两种试剂的结果均为阳性,如图5所示,抗干扰验证合格。

图5 抗干扰实验扩增曲线(左为试剂A,右为试剂B)
3 讨论
新型冠状病毒核酸检测作为新型冠状病毒肺炎的确诊手段,在临床上为快速诊断和疗效评估发挥重要作用[8],在疫情防控中,是落实“四早”防控要求的重要手段,能发挥疫情防控中的“排雷”作用。分子诊断检测项目在应用于临床之前,需要进行严格的性能评估,确保检测质量[9]。
国内外使用的新型冠状病毒核酸检测试剂盒非常多,报道过利用不同的方法验证检测试剂的性能评价[10]。使用国家标准品进行梯度稀释,验证新型冠状病毒核酸检测试剂,发现需要选择配套的核酸提取试剂,才能得到较良好的性能验证结果[11]。使用少量临床新型冠状病毒阳性标本及参考品对核酸检测试剂进行性能验证评价[12]。同时也有学者发现部分核酸检测试剂盒对弱阳性标本的检出能力欠佳的情况[13]。因此,在自身实验室条件下,较为全面地进行性能验证评估,才能较好地保障检测质量的可靠性和准确性。
本研究使用第三方的新型冠状病毒核酸性能验证参考品,以及广东省临床检验中心颁发的室间质评标本,对两种国产的新型冠状病毒核酸检测试剂盒性能验证。验证内容包括灵敏度、精密度、准确度、特异性和抗干扰能力5 个方面,确保对新冠病毒核酸检测做好质量控制。
灵敏度是指检测试剂对待测标本的检测能力,若灵敏度过低,则可能导致假阴性出现[14-15]。灵敏度高的检测试剂,能够较好地检测出病毒拷贝数较低的标本。试剂A 的检出限可达125 copies/mL,试剂B 的检出限可达250 copies/mL,均优于厂家声称的检出限:500 copies/mL。使用检出限较低的检测试剂在检测病毒低拷贝数的标本更具优势,有利于避免假阴性的发生;提高新型冠状病毒肺炎患者的早期检出率,有利于快速确定传染源。
精密度对同一标本进行多次重复测量所得到的结果的一致程度,通常以CV 表示。两种检测试剂在中值R2 水平和临界值R1 水平,检测结果的CV 值均小于5%,符合试剂说明书要求标准,试剂A 和试剂B 的精密度验证合格。精密度高的检测,能较好地保障检测的稳定性。
检测方法的准确度是指检测结果与真值之间的一致性[16]。利用广东省颁发的室间质评品和第三方的阳性参考品来验证两种检测试剂的准确度,室间质评检测结果与真实结果一致,阳性参考品的检测结果也均为阳性,准确度为100%。表明这两种检测试剂盒能够满足准确度的要求。
本实验检测16 种分别含有与新型冠状病毒种属相近或引起症状相似的其他病原体及2 个含人类基因组的DNA。两种试剂的检测结果均为阴性,没有发生交叉反应,表明两种检测试剂的特异性好,有利于避免假阳性的发生,提升临床的辨别判断能力。
使用抗干扰能力好的检测试剂,可以避免临床样本可能存在的内源性物质或治疗药物对检测结果的影响,造成检测结果出现假阴性的现象。两种试剂在检测中分别加入14 种常见干扰物质的弱阳性标本,也能得出准确结果,说明两种检测试剂抗干扰能力好。
综上所述,本实验针对灵敏度、精密度、准确度、特异性和抗干扰性5 个方面验证两种国产新型冠状病毒核酸检测试剂盒的效果,实验结果均符合要求,可用于临床。

