44例马尔尼菲篮状菌感染患者的临床特征及预后分析
邱付兰 邱树胜 林燕青 刘辉钟荣荣
(1.福建医科大学附属龙岩第一医院检验科,龙岩 364000;2.福建省龙岩市第二医院药剂科,龙岩 364000;3.福建省龙岩市第二医院检验科,龙岩 364000;4.福建医科大学附属龙岩第一医院急诊科,龙岩 364000)
马尔尼菲篮状菌(Talaromycesmarneffei, TM)是篮状菌属中唯一温度双相型真菌,TM所致侵袭性真菌病称为马尔尼菲篮状菌病(talaromycosis marneffei,TSM),主要发生于免疫力低下,特别是细胞免疫缺陷患者,是东南亚国家及我国南方地区艾滋病患者重要的机会性感染致病菌。近年来随着我国糖尿病、器官移植、肿瘤、自身免疫性疾病的增加及化疗药物、广谱抗生素、激素的大量使用,HIV阴性的TSM患者逐渐增多,该病临床症状复杂多样且误诊率高,未及时诊断及正确抗真菌治疗易发生播散性感染,病情进展迅速可致患者死亡。艾滋病(AIDS)合并TSM的报道多见,但HIV阴性的TSM国内报道较少。本研究对福建龙岩地区44例TSM患者进行回顾性分析,探讨马尔尼菲篮状菌病的临床特征、实验室检查特点及预后,为TSM的早期诊断和治疗用药提供依据。
1 资料与方法
1.1 研究对象
纳入2017年1月至2021年11月在福建医科大学附属龙岩第一医院和龙岩市第二医院住院的马尔尼菲篮状菌感染患者44例(女5例占11.4%,男39例占88.6%)。回 顾 性 分 析 44例患者的基本情况、流行病学特点、临床表现、实验室和影像学检查结果、治疗转归等临床资料,AIDS的诊断符合《中国艾滋病诊疗指南(2018版)》[1]的诊断标准,并经龙岩市疾病预防控制中心蛋白印迹试验(western blotting,W.B)确诊。纳入标准:①经血、骨髓、胸腹水、创面分泌物培养阳性;②痰、肺泡灌洗液培养马尔尼菲篮状菌阳性且有宿主因素+临床证据符合侵袭性肺部真菌感染临床诊断标准。排除标准:①临床资料不完整或失访者;②没有使用抗真菌治疗但病情有改善者。
本研究通过医院医学伦理审批。
1.2 方法
马尔尼菲篮状菌培养 经血、骨髓、痰、胸腹水、肺泡灌洗液、组织、创面分泌物培养马尔尼菲篮状菌阳性,TM培养鉴定:取胸腹水、血液、骨髓于血培养瓶,报阳涂片镜检疑似马尔尼菲篮状菌转种两个SDA平板,痰和创面分泌物直接两个SDA平板,肺泡灌洗液接种两支SDA管,以上培养基分别放入25℃和35℃孵育箱培养。马尔尼菲篮状菌鉴定:25℃培养3~7 d出现两种菌落形态:一种菌落为淡灰色至红色膜样,背面红色;另一种菌落为淡黄色绒样菌落,产生红色色素渗入培养基中;菌体镜检可见细长分枝分隔菌丝和典型的帚状枝。35℃培养2~3 d呈灰白色,表面光滑无色素的酵母样菌落,镜检可见圆形、椭圆形及两端钝圆有分隔的长形孢子。血液或骨髓培养为TM的患者确诊为播散性马尔尼菲篮状菌病。
体外药敏试验 采用美国赛默飞公司的YeastOne真菌药敏板,取12株SDA平板上35℃培养7 d TM菌落按说明书操作进行药敏试验,35℃培养96 h判读结果。因CLSI和EUCAST均无TM的药敏判定折点,故药敏结果仅报MIC值。质控菌株:克柔念珠菌ATCC 6258,近平滑念珠菌ATCC 22019。
血清1-3-β-D葡聚糖(G试验)和半乳甘露聚糖(GM试验) G实验:根据北京金山川科技发展有限公司提供的1-3-β-D葡聚糖试剂说明书,1-3-β-D葡聚糖浓度>60 pg/mL时,判定为阳性。GM实验:采用美国伯乐公司的曲霉菌抗原检测试剂盒,GM阳性参照欧洲侵袭性真菌感染的标准定义:单次血清GM>1.0,支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)GM>1.0;单次血清GM>0.7并且 BALF GM>0.8[2]。
1.3 统计学分析
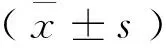
2 结 果
2.1 人口学资料
44例患者均为龙岩本地人,以农村男性患者多见。其中HIV阳性22例,HIV阴性22例。HIV阳性组19~60岁占81.8%,HIV阴性组>60岁老年人占59.1%;收治时间年度分布:2017年7例(15.9%),2018年3例(6.8%),2019年10例(22.7%),2020年6例(13.6%),2021年18例(40.9%),呈逐年增长趋势;其发病月份分布:HIV阳性组以4~6月发病率最高,而HIV阴性组以1~3月发病率最高(见表1)。HIV阳性组基础病:慢性阻塞性肺气肿2例、慢性乙肝1例、前列腺增生1例;HIV阴性组基础病:慢性阻塞性肺气肿5例、肿瘤3例、呼衰3例、糖尿病3例、痛风2例、肺结核1例、红斑狼疮1例。
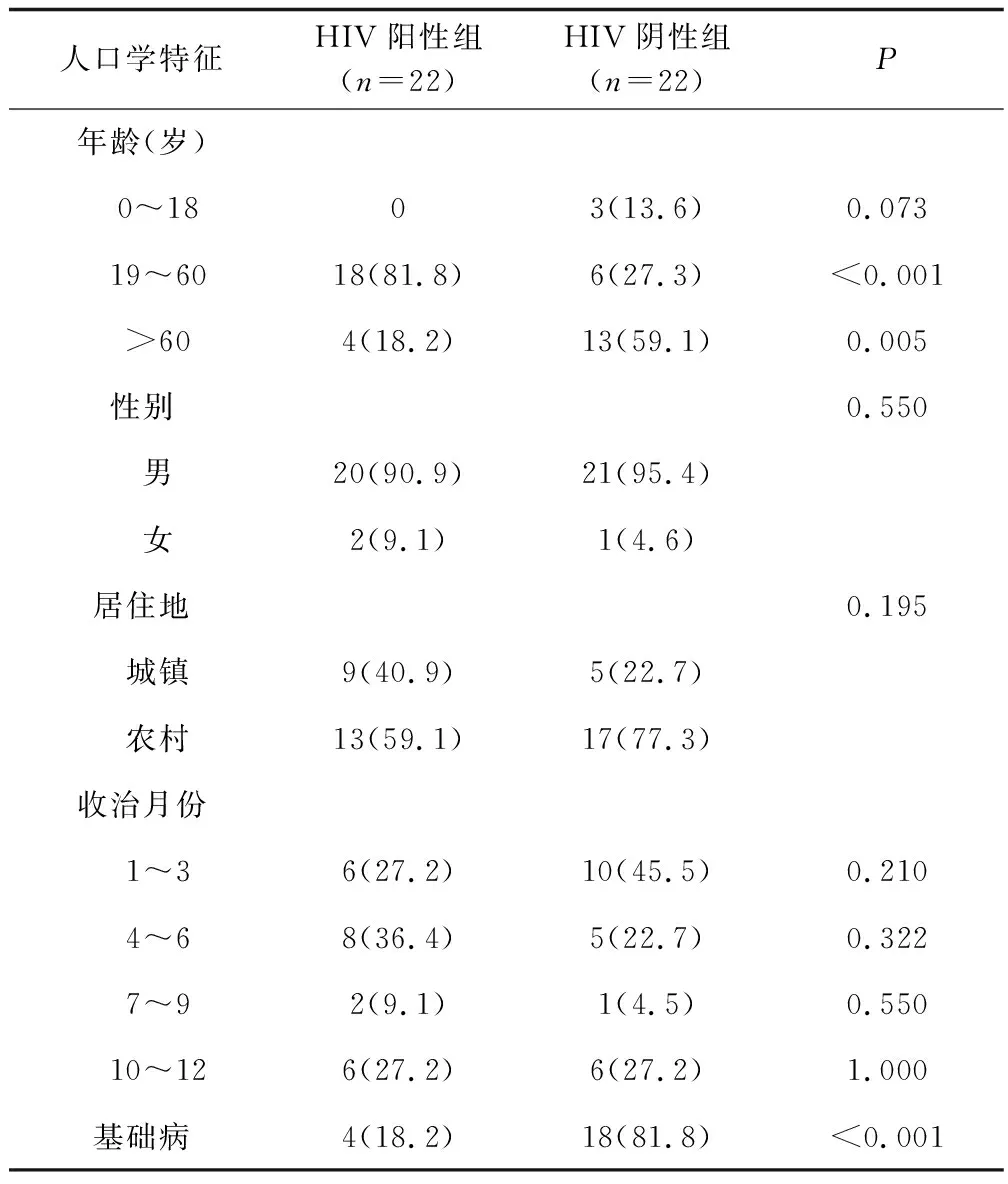
表1 研究对象的一般资料Tab.1 Baseline date of included patients [例(%)]
2.2 临床表现
HIV阳性组所有患者均有发热,其次以贫血、肺部感染多见;而HIV阴性组最常见为肺部感染,9.1%患者有关节病变、未见口腔损害(见表2)。
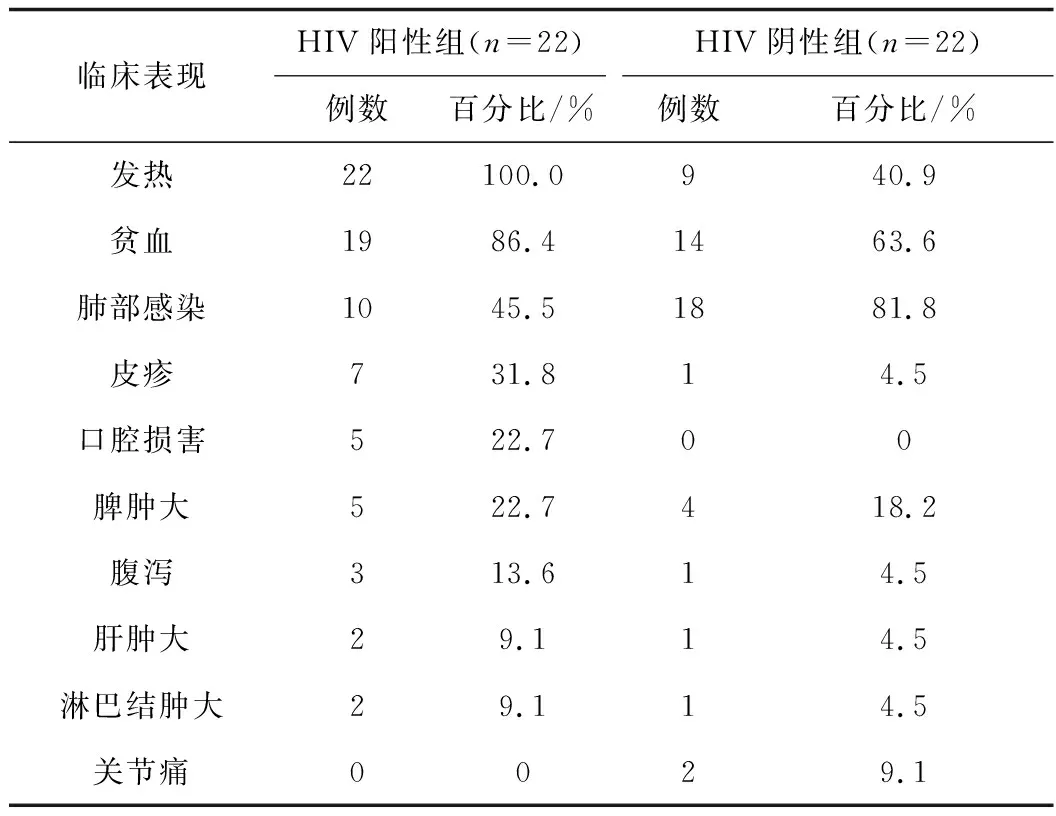
表2 马尔尼菲篮状菌病的临床表现Tab.2 Clinical manifestations of TSM
2.3 实验室检查及药敏结果
播散性TSM占68.2%(30/44),70%为HIV阳性患者;患者血清G试验阳性率39.4%(13/33),GM试验阳性率28.1%(9/32);HIV阳性组的G试验阳性率81.8%(9/11),GM试验阳性率70.0%(7/10);HIV阴性组的G试验阳性率18.2%(4/22);GM试验阳性率9.1%(2/22),5例患者同时做BALF GM均为阴性。除总胆红素与C反应蛋白的P值>0.05无显著性差异外,其余指标P值<0.05存在显著性差异,特别是白细胞、淋巴细胞、CD4+T淋巴细胞、谷草转氨酶HIV阳性组明显低于HIV阴性组,95.4%HIV阳性组TSM的CD4+T淋巴细胞<50个/μL(见表3)。12株TM药敏试验MIC结果:阿尼芬净4~8 μg/mL,米卡芬净和卡伯芬净2~8 μg/mL,5-氟胞嘧啶0.06~0.5 μg/mL,泊沙康唑0.008~0.06 μg/mL,伏立康唑0.008~0.25 μg/mL,伊曲康唑0.015~0.12 μg/mL,氟康唑2~64 μg/mL,两性霉素B 0.12~1 μg/mL。棘白菌素类和氟康唑的MIC值较高,其余3种唑类药物和两性霉素B的MIC值较低。
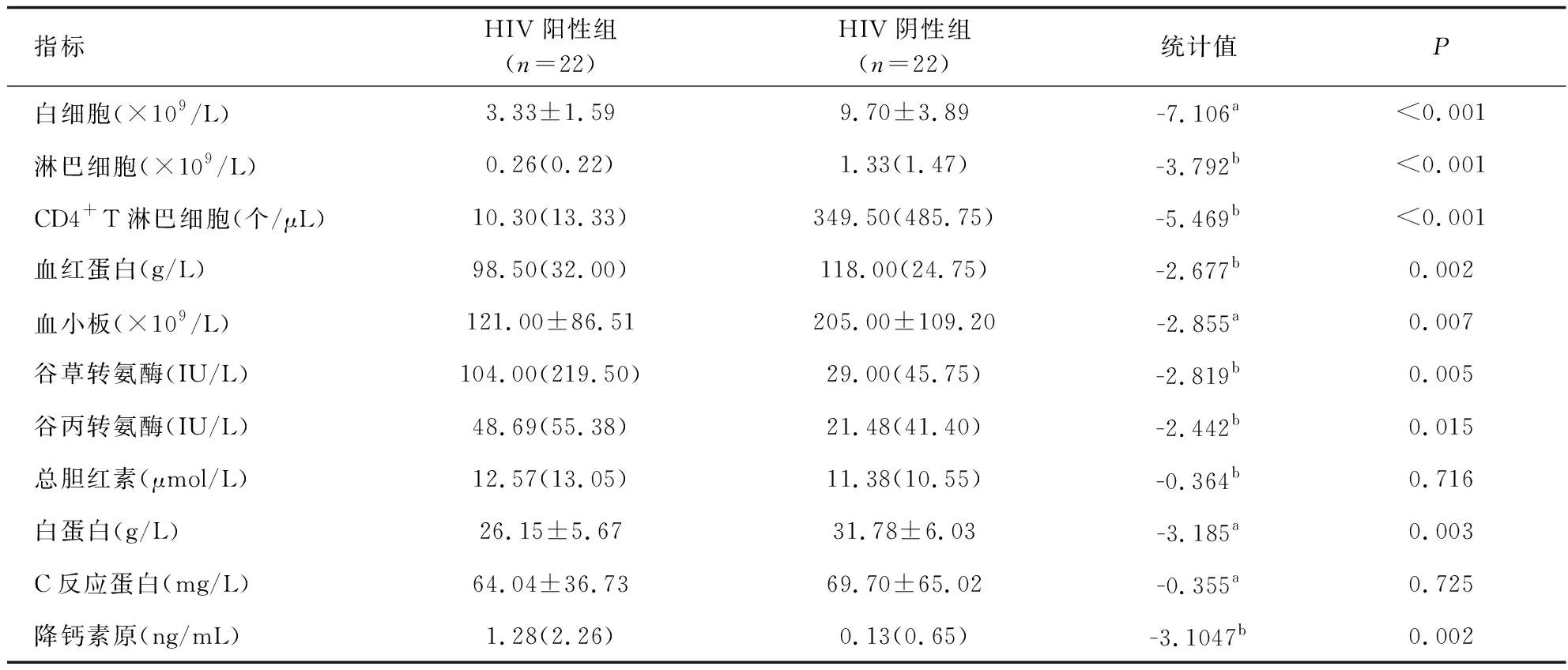
表3 马尔尼菲篮状菌病实验室结果比对Tab.3 Comparison of laboratory test results of TSM
2.4 影像学检查
44例患者胸部CT检查均有双肺异常,32例斑片状或斑点状影,24例小结节影,3例毛玻璃影,3例空洞,3例粟粒状影。腹部CT有13例结果异常,其中9例脾肿大,2例患者肝脾均肿大,5例腹腔结节,2例腹腔积液。HIV阳性和阴性组无明显差别。
2.5 治疗与结局
22例HIV阳性TSM患者中,使用伏立康唑+伊曲康唑8例,单用伏立康唑4例,伊曲康唑2例,氟康唑1例,7例患者病重放弃治疗;22例HIV阴性TSM患者使用伏立康唑9例,氟康唑2例,伊曲康唑1例、伏立康唑+两性霉素B 1例,8例患者病情恶化或基础病无法控制自动出院。两组患者的死亡率和好转率相同,分别为45.5%(10/22)、54.5%(12/22)。
3 讨 论
TSM临床上可分为播散型和局限型,播散型是最常见临床类型,局限型以肺部感染为主要临床特征。空气—呼吸道传播为TSM主要传播途径,随着HIV的流行和AIDS患者的增加、糖尿病、自身免疫性疾病、肿瘤、器官移植患者的增加,TSM发病率逐年增加。本研究结果显示,2017—2021年TSM的发生率呈上升趋势,与国内多数文献报导相近[3-4],这可能与近年来国内医学界对真菌感染的重视并培训提高临床医生和微生物人员的相关真菌病基础知识及临床技能有关。TSM发病月份以春、夏季为主,福建龙岩春夏两季温暖湿润有利于TM的流行。与HIV阳性者相比,HIV阴性者组年龄更大,基础病也更多,以呼吸系统多见,发热、肝脾肿大及脐状皮损较少,实验室检查中WBC、CD4+T淋巴细胞、HB、PLT、ALB、AST、ALT、PCT具有统计学意义;HIV阳性组播散型TSM占95.5%,而HIV阴性组以局限型为主占59.1%,并以肺部感染多见;提示临床对AIDS患者淋巴细胞特别是CD4+T淋巴细胞<30个/μL,且合并肝损害时应警剔播散型TSM,而对于高龄、有慢性肺部疾病、使用免疫抑制剂或放化疗的肿瘤患者应及时进行真菌培养以尽早识别TSM。HIV阴性组中有3例年龄<8个月的播散型TSM患者,2例患者确诊TSM前即因严重脓毒症、多器官衰竭合并重症肺炎死亡,1例患者转上级医院治疗病情好转;Lee等[5]研究发现,信号传导与转录活化因子1(STAT1)功能获得性紊乱以及γ-干扰素(IFN-γ)、STAT1信号通路和免疫基因缺陷可能与HIV阴性儿童TS感染相关。因条件限制此3例患儿在我院未完善免疫缺陷相关基因检测,后续对于此类病例应加强关注。呼吸系统是TSM最常受累部位,胸部影像学表现复杂多样,缺乏特征性改变,胸部CT斑片状或斑点状影最为多见,常合并结节影、空洞、粟粒样病变、毛玻璃密度影、肺门或纵隔淋巴结肿大或胸腔积液等,需注意与肺结核、细菌性肺炎、病毒性肺炎、肺恶性肿瘤或肺孢子菌肺炎等疾病相鉴别[6-7]。“脐凹样”或“小火山样”疣状皮疹为TSM患者比较有代表性的临床特征,对临床诊断具有一定的提示意义,本研究中HIV阳性组31.8%患者出现了特征性皮疹,略低于吴联朋等[4]研究结果。AIDS合并TSM患者未见有累及骨骼系统,但在HIV 阴性患者有2例出现关节痛,该现象可能与 HIV 阴性患者白细胞数量和中性粒细胞功能明显高于 HIV 阳性患者有关[8],有研究认为溶骨性病变通常发生在中性粒细胞聚集的部位,该处蛋白水解酶的释放可导致组织溶解、液化和坏死[9]。
培养是诊断TSM的金标准,但因需时间较长(3~7 d),而早期诊断、及时使用抗真菌药物治疗是降低病死率的关键。G和GM试验是侵袭性真菌感染常用联合检测指标,能早于临床症状和影像学异常的4~7 d出现阳性;但G试验无种属特异性,GM是曲霉细胞壁的特异抗原成份,文献报道GM试验对曲霉和青霉的交叉反应率>70%[10]。本文结果显示HIV阳性组TSM的G试验阳性率81.8%,GM试验阳性率70.7%,与文献报道接近[4,11],提示G和GM对艾滋病合并TSM具有早期诊断意义;对于HIV阴性TSM而言,血清G阳性率仅为18.2%、血清GM阳性率为9.1%,对HIV阴性TSM而言这两项指标诊断价值有限,HIV阳性组患者多为播散性TSM,血液中有较高浓度的1-3-β-D葡聚糖和半乳甘露聚糖,因此阳性率较高;而HIV阴性组患者多为肺部局限性感染,血液中真菌抗原少,导致G和GM的阳性率低,但由于样本数量较少,仍需进一步验证。因G和GM试验在检测中易受抗菌药物及血液制品等影响致假阳性,在临床诊治过程中建议短期内多次连续检测动态观察并结合临床资料及影响学表现综合判断G和GM试验阳性结果的意义。将G和GM与聚合酶链式反应(PCR)技术相结合,可以更快速、更准确地诊断流行地区的马尔尼菲篮状菌感染[12]。甘露聚糖蛋白( Mp1p )是马尔尼菲篮状菌细胞壁特异性多糖抗原,以Mp1p为抗原检测相应的抗体可用于马尔尼菲篮状菌感染的检测,且与其他病原菌无交叉反应[13],可快速诊断早期TSM。
针对AIDS合并TSM,美国疾病预防控制中心推荐使用:两性霉素B(0.6 mg·kg-1·d-1),静脉滴注2周后,伊曲康唑(200 mg/d)口服,2次/天,持续治疗10周。HIV阴性与HIV阳性TSM在治疗剂量及药物选择上两者并无差异,但疗程较长(180 d)[14];有文献报道两性霉素B、伊曲康唑、酮康唑、伏立康唑均对TSM治疗有效,但氟康唑疗效欠佳,不推荐[15],本研究药敏结果显示棘白菌素类和氟康唑的MIC值较高,泊沙康唑、伏立康唑、伊曲康唑和两性霉素B的MIC值较低,提示本地区TSM的治疗可选上述MIC低的药物。TSM的病死率为45.5%,高于文献报道[4,14],但与王星等[2]报道福建泉州的AIDS合并TSM的48.5%病死率接近。病死率高可能有以下原因:①患者就诊时已属于疾病晚期,病情危重病变快,抗真菌治疗药物未达到有效作用前患者已死亡;②部分患者因经济原因放弃治疗;③临床对该病的认识不足,特别是HIV阴性TSM患者,多为高龄且常伴有慢性肺部疾病、自身免疫性疾病、肿瘤、糖尿病等基础疾病,病情进展快,病情恶化来不及确诊并使用抗真菌药物导致死亡。值得注意的是在收集资料时发现有2例慢性阻塞性肺气肿患者的痰培养检出TM,同时合并细菌感染,临床使用抗细菌药物但未使用抗真菌药物,患者病情好转出院,提示对于HIV阴性患者在痰培养中检出TM时还应结合痰直接涂片、影像学检查、临床表现等综合判断是定植菌还是致病菌。
综上所述,AIDS合并TSM患者多为播散型,可行G、GM、TM特异抗原抗体及血培养检测;而对于HIV阴性的伴有基础病的老年患者,应及时进行感染部位的真菌培养,尽早识别病原体。早期诊断、合理治疗是关键,同时临床医师应加深对TSM的认识并及时采取预防措施和相应治疗,以降低TSM患者病死率,改善预后和提高生活质量。

