基于高效液相色谱特征指纹图谱法探究不同品种苜蓿中黄酮抗氧化活性的谱-效关系
关淑文 潘予琮 寇 伟 年 芳 蒋林树*
(1.北京农学院动物科学技术学院,奶牛营养学北京市重点实验室,北京102206;2.甘肃农业大学动物科学技术学院,兰州730070)
苜蓿(alfalfa)属多年生草本植物,产量高且营养成分丰富,是世界上最重要的饲料之一[1]。其功能包括增强机体生长性能、提高奶牛泌乳性能以及增加饲料转化率[2]。苜蓿所富含的黄酮类营养活性物质(木樨草素、芹菜素、苜蓿素等)具有抗氧化功能,优质的苜蓿黄酮含量可达10.35 mg/g[3]。有研究表明,饲喂紫花苜蓿黄酮显著增强奶牛血清抗氧化酶、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性,降低丙二醛(MDA)含量[4]。用含0.2%苜蓿黄酮的饲粮饲喂绵羊可增强机体利用蛋白质能力,调节脂质代谢平衡,提高氮利用率,维持能量代谢和体内钙磷平衡,有一定促生长作用[5]。将60 mg/kg苜蓿黄酮添加到奶牛饲粮中,提高了抗氧化酶活性,调节了奶牛瘤胃微生物菌群和免疫细胞数量,非特异性细胞的免疫功能得以增强[6-7]。但不同品种苜蓿营养活性成分含量不一[8],对奶牛生产性能的影响存在差异[9]。因此,确定不同来源苜蓿中黄酮的主成分具有重要意义。
2002年,李戎等[10]最早系统性提出中药谱-效关系理论,利用多重统计分析方法阐明“图谱”与“效果”的关系。这极大地帮助了畜牧学科挖掘天然植物发挥活性效果时的物质基础以及其内部成分的拮抗与协同作用[11]。谱-效关系理论的基础是建立指纹图谱,最大程度地获取天然植物中活性成分的化学信息[12],其方法是选择不同品种、地理位置、收获时间的样品或利用不同提取方法收集的样本作为变量,通过液相色谱分析、气相色谱分析等手段建立对应样本的指纹图谱,结合动物或细胞试验测定植物提取物对某一生物效应的数据,最后通过主成分分析、相关性分析和回归分析等研究手段构建相应的谱-效关系,筛选出植物提取物中该生物效应的主效因子[13]。
因此,本试验旨在研究从14种苜蓿中提取的黄酮在不同浓度下对1,1-二苯基-2-三硝基苯肼(DPPH)、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)自由基的清除率和还原力的影响。采用高效液相色谱法(HPLC)对14种苜蓿的黄酮成分分析,并进行标准品的比对,建立相应指纹图谱,进行谱-效关系分析,进而对有效成分进行筛选,为苜蓿黄酮作为一种天然抗氧化饲料添加剂在动物生产中的应用提供思路。
1 材料与方法
1.1 试验材料
14种不同来源品种苜蓿见表1。试验中所用芦丁标准品(≥99%)、苜蓿素(≥98.9%)、芹菜素(≥98.2%)、槲皮素(≥99.2%)、山奈酚(≥99.8%)、异鼠李素(≥99.3%)来自上海源叶生物科技有限公司;无水乙醇、色谱级甲醇、色谱级乙腈来自河北净森宝贝化工产品有限公司;亚硝酸钠(NaNO2)、硝酸铝[Al(NO3)3]、氢氧化钠(NaOH)、铁氰化钾(K3[Fe(CN)6])、三氯乙酸钠(C2HCl3O2)、氯化铁(FeCl3)购自上海麦克林Macklin生化科技有限公司;DPPH和ABTS-二铵盐购自Sigma-Aldrich®公司。试验中所用电子天平(ME204/02)来自梅特勒-托利多(METTLER TOLEDO)仪器有限公司,高效液相色谱仪(Waters e2695)及PDA检测器(2998)来自美国Waters公司,超声波清洗器(KQ-500DE)来自昆山市超声仪器有限公司,酶标仪(Multiskan FC)来自Thermo公司。

表1 14种不同来源品种苜蓿
1.2 试验方法
1.2.1 苜蓿黄酮提取
参考潘予琮[3]提取条件,采用乙醇超声提取法,各取1 g不同品种苜蓿粉末,加入30 mL 80%的乙醇溶液,超声提取35 min。将提取液用真空冷冻干燥器进行浓缩干燥,成固体状备用。将制备好的14种不同苜蓿黄酮提取物配制成浓度为4 mg/mL的溶液,进行后续试验。
1.2.2 DPPH自由基清除
分别吸取14种不同浓度的苜蓿黄酮提取物溶液加入96孔板中,每孔100 μL,再添加100 μL DPPH试剂,充分混匀,室温下避光孵育30 min。使用酶标仪于517 nm处测定吸光值,记为A1;同时取100 μL不同品种苜蓿黄酮提取物溶液加入100 μL 95%乙醇,以同样方法测定吸光度,记为A2;对照组取100 μL DPPH试剂加入100 μL 95%乙醇,吸光值记为A0。重复4次上述操作。按下面的公式计算DPPH自由基清除率:

1.2.3 ABTS自由基清除
用95%乙醇稀释ABTS工作液得到ABTS自由基储备液。调节ABTS储备液在734 nm波长下的吸光值为0.70±0.05。然后在96孔板中分别加入0.6 mL不同浓度的14种苜蓿黄酮提取物溶液,再吸取2.4 mL配制好的ABTS储备液,室温下避光孵育10 min,使用酶标仪在734 nm处测定吸光值,记为A1;对照组吸取0.6 mL 95%乙醇加入2.4 mL ABTS储备液,用上述方法测另一吸光值,记为A2。重复3次上述操作。按下面的公式计算ABTS自由基的清除率:

自由基清除率越大,抗氧化活性就越强,反之抗氧化活性越弱[18]。
1.2.4 还原力测定
取2.5 mL 1% K3[Fe(CN)6]溶液和2.5 mL浓度为0.2 mol/L的磷酸盐缓冲液,调节pH至6.6,分别加入含有1 mL不同浓度的14种苜蓿黄酮提取物溶液的试管中,置于50 ℃水浴锅中摇晃20 min至均匀,反应充分后急速冷却,取出。加入2.5 mL 10% C2HCl3O2溶液,振荡混匀,置于离心机内,在3 000 r/min的转速下离心10 min,弃去沉淀,取上清液2.5 mL移入另一试管中。加入2.5 mL去离子水和0.5 mL 1% FeCl3溶液,振荡混匀,于700 nm波长处测定各管吸光值。根据吸光度值大小可以推测不同苜蓿来源黄酮的还原力,表示为吸光值越高,苜蓿黄酮的还原力越强。
1.2.5 标准品溶液的制备
分别称取2.5 mg芹菜素、山奈酚、苜蓿素、槲皮素、异鼠李素和芦丁的标准品加入装有色谱级甲醇的25 mL定容瓶中,在超声下溶解。立刻取以上6种溶液各0.5 mL,置于5 mL离心管中,加入甲醇稀释,振荡混匀后立刻取2 mL过滤,得到浓度为20 ng/mL的标准品溶液。
1.2.6 HPLC条件
将浓度为4 mg/mL的14种不同品种苜蓿黄酮提取物溶液用于高效液相色谱仪分析。选择Phenomenex的Luna C18色谱柱(250 mm×4.6 mm,5 μm)。流动相采用低浓度,乙腈(A):0.5%磷酸溶液(B)。梯度洗脱:0~15 min,渐变至15%~20% B;15~20 min,变为20% B;20~55 min,渐变为20%~35% B;55~60 min,0.5%磷酸溶液逐渐由35%升至85%;60~90 min,维持在85% B。进样量10 μL,柱温25 ℃,流速1.0 mL/min;在350 nm下检测。
1.3 统计分析
测定数据的平均值、标准误及可决系数(R2)通过Excel 2016进行计算。采用SPSS 22.0统计软件处理,并结合Origin模型计算半数抑制浓度系数(IC50)并进行单因素方差分析和标准化回归系数分析,相似度评价参考《中药色谱指纹图谱相似度评价系统(2012)》进行评估。
2 结果与分析
2.1 指纹图谱的建立
2.1.1 HPLC指纹图谱建立
将浓度为4 mg/mL的14种不同品种的苜蓿黄酮提取物溶液按上述条件进行HPLC分析,将出峰时间和色谱峰面积记录下来制成图表。利用《中药色谱指纹图谱相似度评价系统(2012)》评估14种苜蓿的黄酮色谱数据的相似度,时间窗宽度为0.5 min,采用中位数对照图谱生成法,将S1设为参照图谱,得到14种苜蓿来源的黄酮HPLC叠加图,如图1所示。
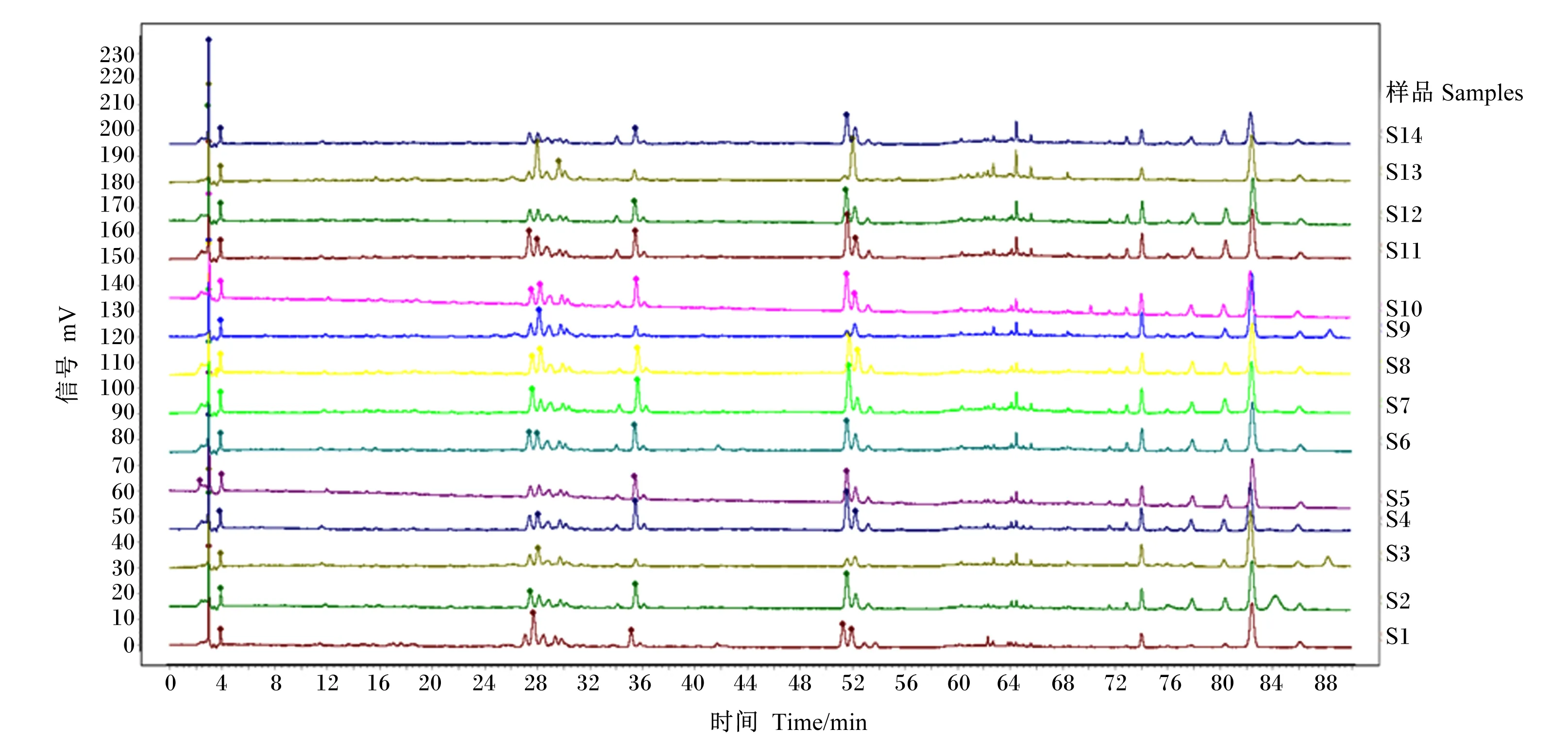
图1 14种苜蓿中的黄酮HPLC叠加图
2.1.2 相似度评价
通过《中药色谱指纹图谱相似度评价系统》对14种苜蓿来源的黄酮相似度进行评估。结果的数值越大,相似度越高。如表2所示,不同品种苜蓿来源黄酮相似度存在差异,范围在0.471~0.976,除S3、S9和S13与标准品相似度较差,其他苜蓿来源黄酮相似性较高。这表明不同来源苜蓿中黄酮类活性物质种类和含量相似。
2.1.3 共有峰指证
通过对浓度为4 mg/mL的14种苜蓿来源黄酮的色谱进行比对,从中提取9个共有峰,如图2所示。本实验室前期研究中,通过共有峰与相同浓度标准品之间的比对,指认出峰2为芹菜素,峰3为苜蓿素,峰4为山奈酚,而峰5、峰6、峰7、峰8、峰9色谱峰分离彻底,无拖尾现象,保留峰面积稳定[3],因此选用峰8作为参照峰,通过HPLC统计出14种苜蓿来源的黄酮共有峰面积如表3所示。

表2 14种苜蓿来源的黄酮相似度

图2 14种苜蓿来源的黄酮共有峰

表3 14种苜蓿来源的黄酮9个共有峰的面积

续表3样品Samples峰1Peak 1峰2Peak 2峰3Peak 3峰4Peak 4峰5Peak 5峰6Peak 6峰7Peak 7峰8Peak 8峰9Peak 9S11147 493273 063110 81838 667121 89368 293131 615407 56956 404S12117 22420 26694 76036 570107 94182 683116 972386 03656 053S1373 43967 93675 5508 050113 09833 64574 561517 74962 282S1484 777176 34897 20728 77871 31757 12996 288267 14738 005
2.2 不同苜蓿来源的黄酮抗氧化能力
2.2.1 不同苜蓿来源的黄酮对DPPH自由基的清除率
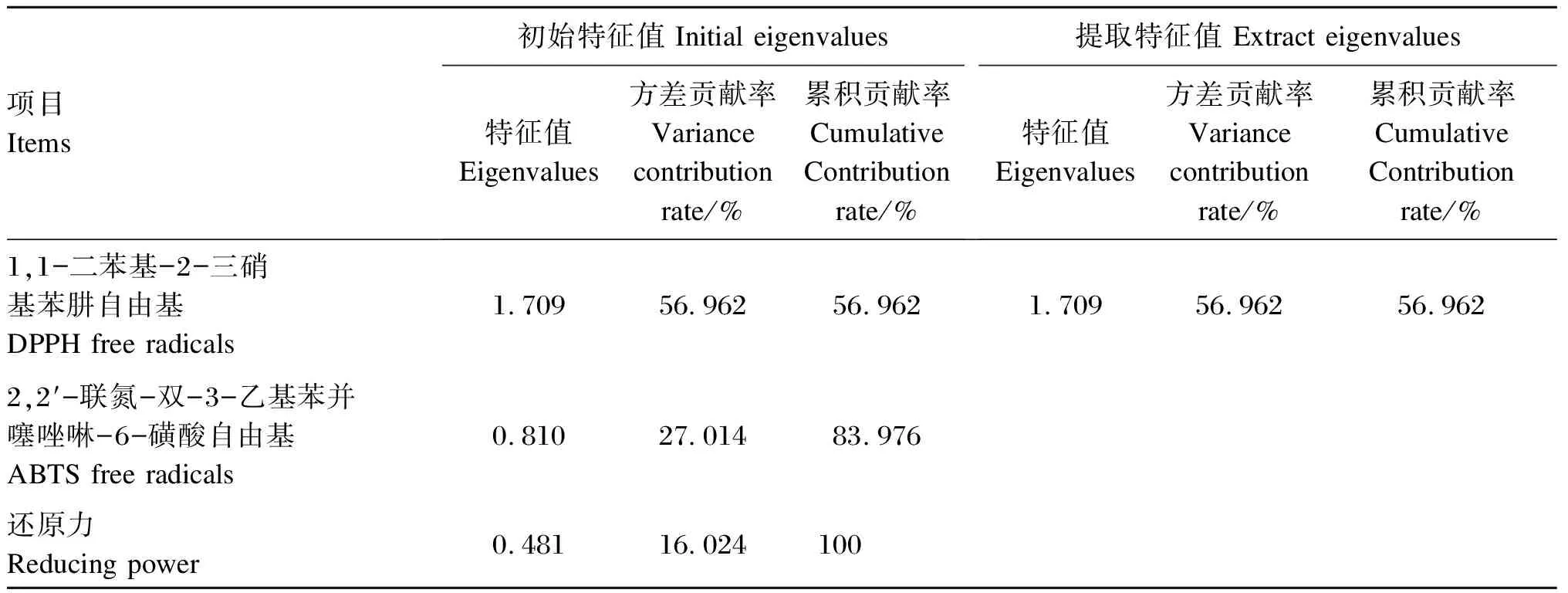
如表4所示,将不同浓度14种苜蓿来源的黄酮清除率数据导入Origin 8.0软件中,利用线性曲线拟合得到表4中的公式,其中,除S8和S32样品为三项式拟合外,其他均为二项式拟合,且R2均在0.995~0.999,有较高的拟合度,不同品种苜蓿中的黄酮对DPPH自由基清除率影响不同,IC50从小到大依次为:S13 表4 14种苜蓿来源的黄酮清除DPPH自由基的IC50 2.2.2 不同苜蓿来源的黄酮对ABTS自由基的清除率 同2.2.1所述方法,计算得出ABTS自由基清除拟合公式如表5所示,S1、S2、S8、S10、S12样品的清除率拟合曲线为三项式,其余的均为二项式拟合,且R2的值在0.992~0.999,ABTS自由基清除率IC50值由小到大依次为:S1 2.2.3 不同苜蓿来源的黄酮的还原力 同2.2.1所述方法,计算得出14种苜蓿中黄酮的还原力拟合公式如表6所示,均符合对数函数趋势,且R2的值在0.961~0.989,还原力的半数最大效应浓度系数(EC50)值由小到大依次为:S2 表5 14种苜蓿来源的黄酮清除ABTS自由基的IC50 表6 14种苜蓿来源的黄酮还原力的EC50 2.3.1 主成分分析 采用SPSS 26.0软件,对共有峰面积以及14种苜蓿来源的黄酮对DPPH、ABTS自由基的IC50值和还原力的EC50值进行Z标准化处理,计算得出DPPH、ABTS的IC50和还原力的EC50三者的初始特征值、提取特征值,结果如表7所示,DPPH的方差贡献率为56.962%,ABTS的贡献率为27.014%,还原力的贡献率为16.024%,其中DPPH贡献率最大,因此能更好地反映抗氧化效果。 表7 主成分分析 2.3.2 偏最小二乘法分析 首先将共有峰面积和DPPH、ABTS的IC50值和还原力的EC50值进行标准化处理。然后将DPPH、ABTS的IC50值和还原力的EC50值分别作为Y1、Y2、Y3,9个共有峰面积分别作为X1~X9值。最后利用SIMCA 14.1软件计算X对Y的标准化回归系数(图3所示),得到回归方程为Y1=0.589X1-0.231X2+0.183X3-0.013X4-0.396X5+1.046X6-0.315X7+0.559X8-0.902X9,峰1、峰3、峰6、峰8的回归系数为正值,其余峰的回归系数为负值;Y2=0.653X1+0.115X2-2.131X3+1.383X4+0.734X5-0.233X6+0.145X7+0.713X8-1.237X9,峰1、峰2、峰4、峰6、峰7的回归系数为正值,其余峰的回归系数均为负值;Y3=0.033X1-0.787X2+1.411X3-0.98X4-0.593X5-0.073X6+0.43X7+0.045X8+0.529X9,峰1、峰3、峰7、峰8的回归系数为正值,其余峰的回归系数均为负值。 图3 自由基清除的回归系数 2.3.3 多变量间的相关分析 将共有峰面积与DPPH、ABTS的IC50值和还原力的EC50值利用SPSS 26.0软件进行多变量相关分析,结果如表8所示,峰1、峰6的面积与DPPH抗氧化活性显著相关(P<0.05),且均为正相关;峰2的面积与还原力的活性显著相关(P<0.05),且为负相关。 通过建立黄酮类化合物特征指纹图并结合其作用效果进行谱-效关系分析是一个热门应用方法,使人们能够更加准确、快速地把握黄酮类化合物的作用。本试验通过高效液相色谱法测定了14种苜蓿来源的黄酮提取物,建立了不同品种苜蓿中黄酮的特征指纹图谱。结果显示不同苜蓿来源中黄酮之间的相似度范围在0.471~0.976,说明不同品种之间黄酮类别存在着差异。黄酮类化合物的基础结构是2个通过C3键链接的苯环,不同黄酮类化合物苯环上的基团不同,主要包括以下几种:查尔酮类、二氢黄酮类、黄烷醇类和异黄酮类等[2]。因此,不同品种苜蓿中黄酮类物质具有多样性,对不同自由基的清除存在着差异。 表8 共有峰与DPPH、ABTS的IC50值和还原力的EC50值的相关性分析 本试验采用体外抗氧化法,测定不同品种苜蓿黄酮对DPPH、ABTS的IC50和还原力的EC50。将不同浓度苜蓿黄酮清除DPPH、ABTS的能力以及还原力通过线性拟合,计算该数值为50%时,所需苜蓿黄酮的浓度,即IC50(EC50)值,IC50(EC50)的值越小,表示该品种的苜蓿黄酮抗氧化活性越强,反之,表示苜蓿黄酮抗氧化活性越弱。结果显示,苜蓿黄酮清除DPPH自由基和ABTS自由基的能力呈剂量依赖式增强。这与郭新颖等[14]研究结果一致,随着苜蓿黄酮浓度的增加,DPPH自由基清除率越高。但在达到一定浓度后继续升高苜蓿黄酮的浓度并不能进一步加强其自由基清除力。本试验中不同苜蓿品种来源的黄酮清除自由基的IC50值不同,S13品种苜蓿的黄酮DPPH自由基清除率最高(1.12 mg/mL),S4品种苜蓿的黄酮对DPPH清除率最低(2.149 mg/mL);S1品种苜蓿的黄酮对ABTS自由基的清除率最高(0.309 mg/mL),S9品种苜蓿的黄酮清除ABTS自由基的效率最低(0.759 mg/mL);S2品种苜蓿的黄酮还原力的EC50最高(0.035 mg/mL),S13品种苜蓿的黄酮还原力的EC50最小(0.143 mg/mL)。康超等[15]的研究表明,提取自不同品种芒果核中的多酚和黄酮类化合物清除超氧阴离子和羟基自由基的能力不同,这与本研究结果相似。由此可以看出,不同苜蓿来源的黄酮对不同氧化自由基清除能力不同,可能由于不同苜蓿来源的黄酮组成成分及含量不同所造成。这一结果为苜蓿黄酮作为抗氧化活性物在动物饲料添加剂中的筛选提供有效依据。 钱松等[16]通过体外法研究15批次地稔醇提物的抗氧化能力,采用主成分分析法,发现DPPH自由基清除率贡献值最大。本试验将DPPH、ABTS的IC50值和还原力的EC50值进行主成分分析,得出DPPH自由基清除率贡献值最大(56.962%),其次是ABTS(27.014%),最后为还原力(16.024%),说明DPPH自由基清除率能更好地反映14种苜蓿来源黄酮的抗氧化活性。为了进一步探究14种苜蓿中黄酮的谱效关系,利用偏最小二乘法建立共有峰面积与DPPH、ABTS的IC50值及还原力EC50值的回归方程。根据标准回归系数可知峰1、峰3(苜蓿素)、峰6、峰8对DPPH自由基清除率影响呈正相关,各成分之间通过协同作用促进自由基的清除,其余峰均为负相关,有抑制自由基清除的作用;峰1、峰2(芹菜素)、峰4(山奈酚)、峰6、峰7对ABTS自由基清除回归系数为正值,其余峰的回归系数均为负值;峰1、峰4(山奈酚)、峰7、峰8与还原力的回归系数为正值,其余峰的回归系数均为负值。因此,这说明抗氧化活性是由多种黄酮类成分共同所决定的,而不同的成分对不同的自由基清除有不同的结果[17]。通过多变量间的相关分析发现,对在清除DPPH自由基方面,峰1和峰6表现出显著正相关;在还原力方面,峰2与其表现出显著负相关。这与通过偏最小二乘法分析得出结果一致,说明该分析具有可靠性。 本试验主要以14种苜蓿来源的黄酮为原料,通过体外法分别测定了14种苜蓿中黄酮清除DPPH、ABTS的能力和还原力,结果显示,来自S13品种的黄酮对DPPH自由基清除力最佳,S1品种的黄酮对ABTS自由基清除力最佳,S2品种的黄酮的还原力最强。通过不同苜蓿来源的黄酮指纹图谱构建,初步确定了黄酮中具有抗氧化活性的成分,即峰1、峰3(苜蓿素)、峰6、峰8为DPPH自由基清除主效因子,峰1、峰2(芹菜素)、峰4(山奈酚)、峰6、峰7为ABTS自由基清除主效因子,峰1、峰4(山奈酚)、峰7、峰8为还原力的主效因子,为苜蓿黄酮作为一种天然抗氧化饲料添加剂在动物生产中的应用提供理论依据。


2.3 谱效关系分析

3 讨 论

4 结 论

