复合益生菌发酵饲料对羔羊营养物质表观消化率、血清激素含量、粪便微生物及消化酶活性的影响
丁亚伟 郭云霞 王海玉 杨彩虹 田星哲 徐艳辉 段春辉**严 慧 纪守坤 刘月琴 张英杰
(1.河北农业大学动物科技学院,保定071000;2.河北农业大学生命科学学院,保定071000)
羔羊哺乳期的生长发育对断奶重及后续育肥性能有重要影响。而哺乳羔羊饲养管理不当会影响胃肠道发育,降低饲料营养物质消化利用率,腹泻率居高不下,严重影响养殖效益。因此,通过营养调控方式促进哺乳羔羊胃肠道发育,提高营养物质利用率、降低腹泻是目前推动我国养羊业健康发展的根本途径。发酵饲料含有大量乳酸菌、有机酸、活性肽、寡聚糖等代谢产物,可增加饲料适口性和营养价值,利于幼龄动物的消化吸收[1]。同时,低pH和高有机酸会降低肠道沙门氏菌的数量[2],增加乳酸菌和双歧杆菌数量[3],有益于肠道菌群平衡,降低腹泻率。农业部公布的微生物添加制剂有乳酸菌、酵母菌、芽孢杆菌和霉菌四大类,与单一菌种相比,在发酵过程中常选用多菌种发酵,通过菌种之间互补或者协同作用可以弥补单一菌种的短板,应用效果较好[4]。研究表明,仔猪饲喂益生菌发酵豆粕后,肠道内容物放线菌门、厚壁菌门和变形菌门相对丰度显著升高,梭菌属和拟杆菌属的相对丰度显著下降,腹泻率显著降低[5]。研究发现,复合益生菌发酵饲料可降低动物有害气体的排放[6],同时饲料酸化可防止霉变、抑制有害菌生长,进而减弱大肠杆菌及其他腐败菌的活力[7],减少蛋白质向氨和胺的转化[8],同时可将部分的臭源化合物氧化成无臭物质,从而降低粪便中有害气体排放,改善饲养环境[9]。当前,益生菌发酵饲料的研究多集中于单胃动物,在对幼龄反刍动物上的研究鲜有报道。基于此,本试验以玉米-豆粕型饲料原料为发酵底物,以乳酸杆菌、枯草芽孢杆菌和地衣芽孢杆菌为复合菌种制备发酵饲料,旨在研究添加不同比例发酵饲料对哺乳羔羊营养物质表观消化率、血清生长相关激素含量和粪便消化酶活性、氨气含量、微生物菌群数量的影响,以期为复合益生菌固体发酵饲料在羔羊培养中的应用提供理论依据和技术支撑。
1 材料与方法
1.1 试验时间与地点
本试验在衡水市武邑县志豪畜牧科技有限公司进行,试验时间为2021年8—10月。
1.2 发酵饲料制备
乳酸杆菌RSG-1(CGMCC22061,≥108CFU/mL)、枯草芽孢杆菌B-1(CGMCC22064,≥108CFU/mL)、地衣芽孢杆菌Y5-39(CGMCC22062,≥108CFU/mL)分别在MRS和NB培养基中37 ℃培养24 h。根据Design 11.0软件中Mixture模型设计益生菌单独及不同复合比例发酵,测定发酵后饲料可溶性蛋白含量确定最佳比例是1∶1∶4,所有菌株由河北农业大学生命科学学院生物医药系分离并保存。发酵底物是由玉米粉、豆粕和麸皮(6.0∶2.5∶1.5)组成,按照发酵温度30 ℃,接种量10%,含水量45%,在25 kg发酵袋发酵14 d,开封后发酵料在室温放置14 d可保证最佳饲用效果。发酵饲料组成及营养水平见表1。
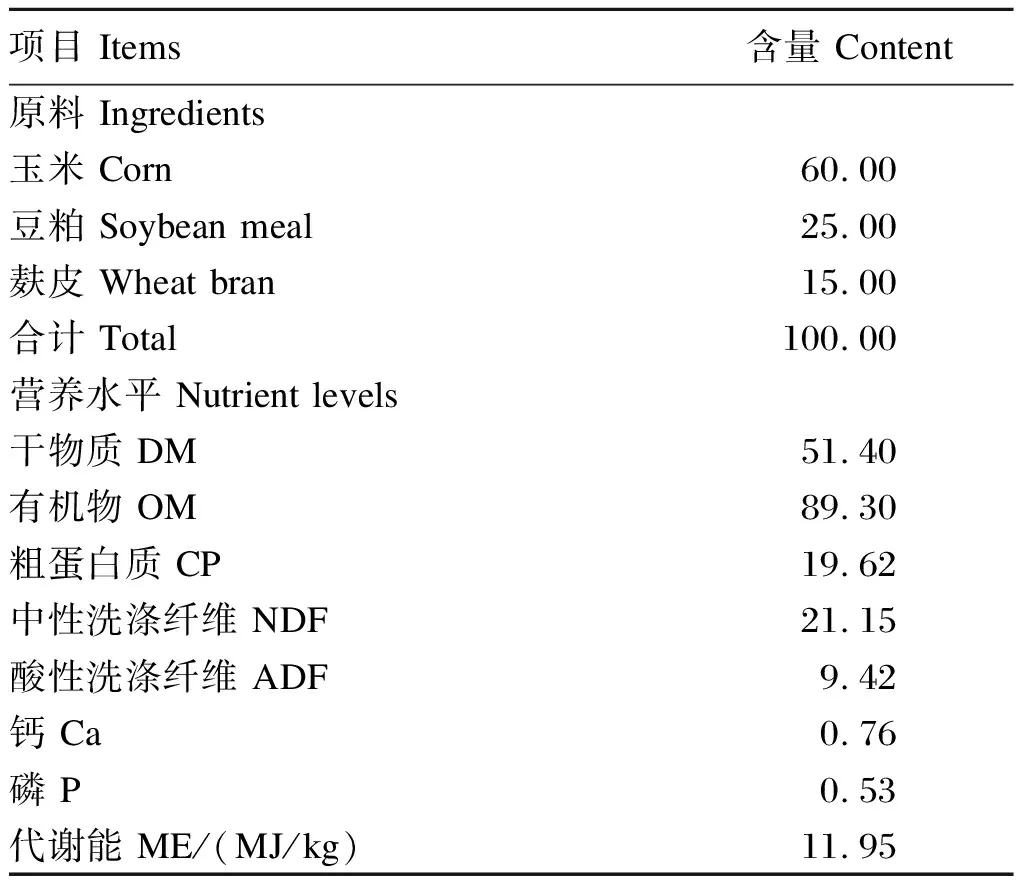
表1 发酵饲料组成及营养水平(风干基础)
1.3 试验设计
1.3.1 饲养试验
选择体重为(6.80±0.30) kg的15日龄湖羊羔羊48只(公母各占1/2),按照体重和性别随机分为4组,每组12个重复,每个重复1只羊,所有羔羊随母哺乳并补饲开食料,试验1、2、3和4组分别饲喂含有0、5%、10%和15%发酵饲料的开食料。试验饲粮根据等能等氮原则,参照NRC(2007)标准进行配制,饲喂羔羊前将发酵饲料与开食料混合均匀后饲喂,试验饲粮组成及营养水平见表2。预试期5 d,正试期40 d,羔羊60日龄断奶。断奶当天所有羔羊颈静脉采血5 mL,4 000 r/min离心20 min,收集上层血清测定生长激素(GH)、胰岛素(INS)和胰岛素生长因子-Ⅰ(IGF-Ⅰ)含量,同时利用直肠采粪法采集新鲜粪便,测定消化酶活性、微生物菌群数量和氨气(NH3)含量。
试验开始前对羊舍进行打扫消毒及驱虫,试验期间每15 d对羊舍四周及地面进行消毒。试验羔羊在母子圈饲养,母羊无法进入羔羊圈舍,羔羊可自由出入,所有羔羊断奶前随母哺乳加补饲开食料,断奶后继续饲喂哺乳期开食料。正试期间试验羊每日07:00和17:00饲喂2次,羔羊自由采食与饮水。
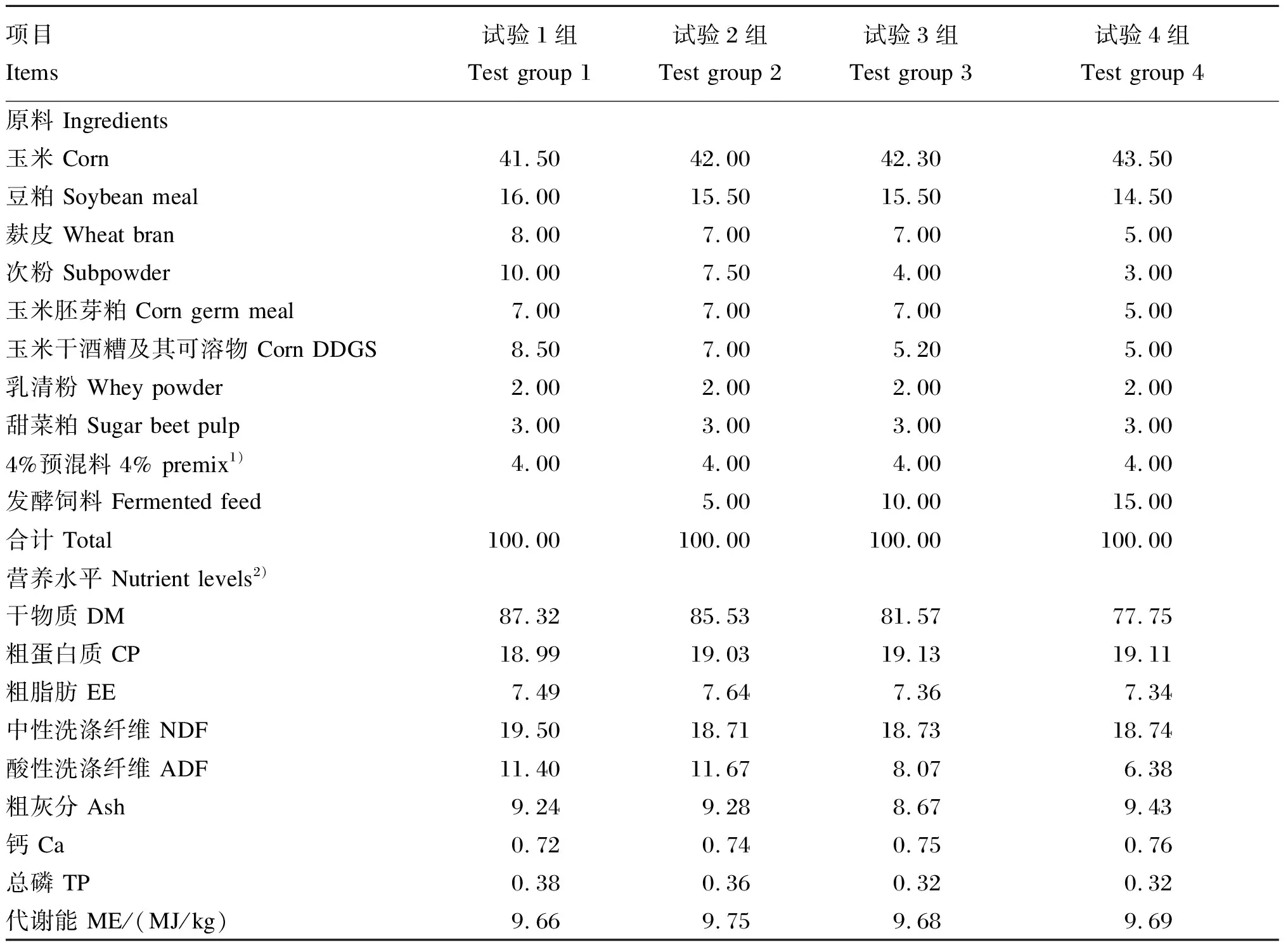
表2 试验饲粮组成及营养水平(干物质基础)
1.3.2 消化试验
羔羊60日龄断奶后每组随机选取3只体重相近、健康的羔羊进行消化试验,试验羊每只于代谢笼中室内饲养,预试期4 d,正试期3 d,试验期间自由饮水与采食,正试期间每日08:00前利用全收粪法收集新鲜粪便进行称重计为前1 d的排粪量,将每日收集新鲜粪样去除羊毛和其他杂物,一部分按每100 g粪样加5 mL体积分数10%硫酸固氮,用于测定粗蛋白质(CP)含量,另一部分不做处理,用于总能(GE)及中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量测定。同时收集试验羊饲粮样品,并记录羔羊的给料量和剩料量,计算羔羊每日采食量。试验结束后,将3 d采集的饲粮与粪样分别混合,于-20 ℃冷冻保存待测。
1.4 样品采集及测定方法
1.4.1 营养物质表观消化率
饲粮和粪样解冻后放入65 ℃烘箱内烘干48 h,回潮24 h称重,经粉碎过16和40目网筛制成分析样品,参照《饲料分析及饲料质量检测技术》[10]测定样品中CP、粗脂肪(EE)、干物质(DM)、钙(Ca)、总磷(TP)、NDF、ADF含量和GE。某营养物质表观消化率计算公式如下:
某营养物质表观消化率(%)=100×(食入
该营养物质含量-粪中该营养物质含量)/
食入该营养物质含量。
1.4.2 血清GH、INS和IGF-Ⅰ含量测定
采用酶联免疫吸附试验(ELISA)试剂盒测定血清中GH(检测范围0.2~10.0 ng/mL)、INS(检测范围5 ~100 mIU/L)、IGF-Ⅰ(检测范围15~600 μg/L)含量。试剂盒均购自江苏酶免实业有限公司。
1.4.3 粪便消化酶活性测定
直肠粪样采用比色法测定粪便中α-淀粉酶(α-AL)、脂肪酶(LPS)和纤维素酶(CL)活性,采用微板法测定粪便中胰蛋白酶(Try)活性。以上试剂盒均购自睿信生物科技有限公司。
1.4.4 粪便NH3含量测定
新鲜直肠粪样置于500 mL磨口玻璃瓶中,37 ℃下发酵2 d。参照鲁琳等[11]中纳氏试剂比色法测定粪样中NH3含量,用内装10 mL吸收液的大气采样器抽取100 mL气体,速度小于0.1 L/min,采气5 L,然后经0.005 mol/L硫酸溶液进行吸收,采样10 min后使用分光光度计于波长425 nm处比色。NH3含量计算公式如下:
C=(A-A0)Bs/V0。
式中:C为粪便中氨气含量(mg/m3);A为样品溶液吸光度;A0为空白溶液吸光度;Bs为计算因子(μg/吸光度),是标准曲线斜率的倒数;V0为标准状态下采样体积(L)。
1.4.5 粪便微生物菌群数量测定
直肠粪样采用平板计数法测定乳酸杆菌、双歧杆菌、大肠杆菌和沙门氏菌数量。乳酸杆菌采用MRS培养基,双歧杆菌采用BBL培养基,37 ℃培养48 h进行计数。大肠杆菌采用EMB培养基,沙门氏菌采用SS培养基,37 ℃培养24 h进行计数。菌落数量单位以每克粪便中所含菌落形成的对数[lg(CFU/g)]表示。
1.5 数据处理与分析
利用SPSS 22.0软件中one-way ANOVA程序对数据进行单因素方差分析,Duncan氏法进行多重比较。数据均采用“平均值±标准误”表示,以P<0.05表示差异显著,P<0.01为差异极显著,以P>0.05为差异不显著。
2 结果与分析
2.1 复合益生菌发酵饲料对羔羊营养物质表观消化率的影响
由表3可知,试验3组羔羊DM采食量显著高于试验4组(P<0.05),极显著高于试验1组(P<0.01),与试验2组无显著差异(P>0.05);试验2组显著高于试验1组(P<0.05),与试验4组无显著差异(P>0.05);试验1和4组DM采食量无显著差异(P>0.05)。各组间DM表观消化率无显著差异(P>0.05)。试验3组食入氮和消化氮显著高于试验2和4组(P<0.05),极显著高于试验1组(P<0.01);试验2和4组显著高于试验1组(P<0.05)。各组粪氮无显著差异(P>0.05)。试验3组羔羊CP表观消化率显著高于试验2组(P<0.05),极显著高于1组(P<0.01),与试验4组无显著差异(P>0.05);试验2和4组羔羊CP表观消化率显著高于试验1组(P<0.05)。试验3组GE摄入量显著高于试验1和2组(P<0.05),极显著高于试验4组(P<0.01),试验4组显著低于试验1和2组(P<0.05)。试验3组消化能显著高于试验2组(P<0.05),极显著高于1和4组(P<0.01),试验2组显著高于1组(P<0.05),极显著高于4组(P<0.01);试验1组显著高于4组(P<0.05)。试验2和3组粪能显著低于试验1和4组(P<0.05),GE表观消化率显著高于试验1和4组(P<0.05)。试验2和3组间、试验1和4组间粪能和GE表观消化率无显著差异(P>0.05)。试验2和3组羔羊NDF表观消化率显著高于试验1组(P<0.05),与试验4组无显著差异(P>0.05)。试验2和3组ADF表观消化率显著高于试验1和4组(P<0.05)。试验2与3组间、试验1与4组间ADF和NDF表观消化率无显著差异(P>0.05)。
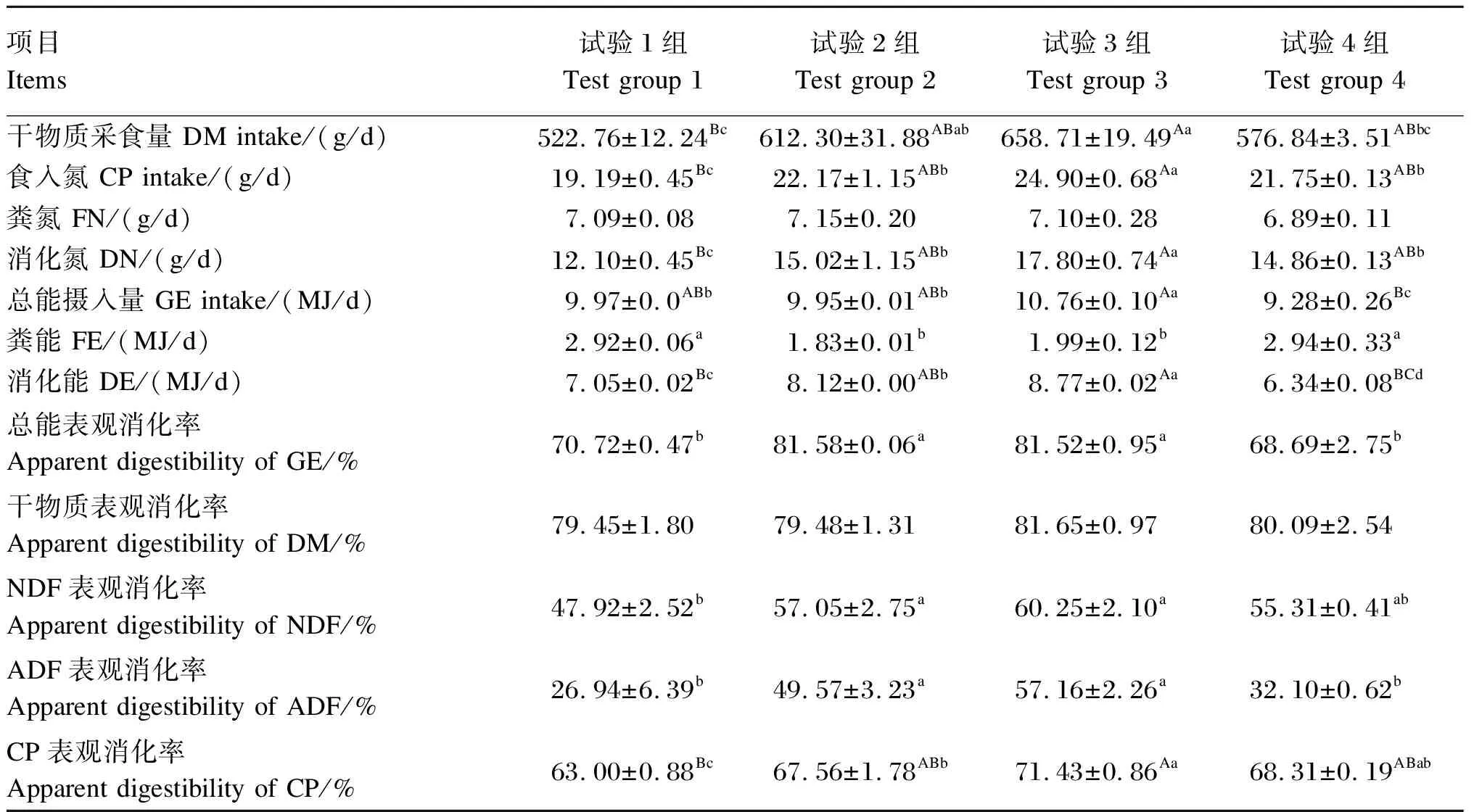
表3 复合益生菌发酵饲料对羔羊营养物质摄入量和表观消化率的影响
2.2 复合益生菌发酵饲料对羔羊血清中GH、IGF-Ⅰ和INS含量的影响
由表4可知,试验3组血清GH和IGF-Ⅰ含量显著高于试验1组(P<0.05),与试验2和4组无显著差异(P>0.05);试验1、2和4组间无显著差异(P>0.05)。试验2、3和4组间羔羊血清INS含量无显著差异(P>0.05),但均显著高于试验1组(P<0.05)。
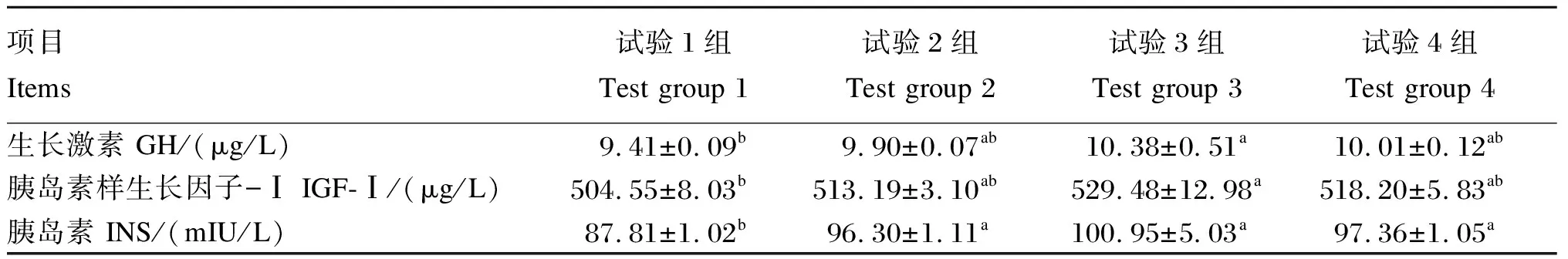
表4 复合益生菌发酵饲料对羔羊血清中GH、INS和IGF-Ⅰ含量的影响
2.3 复合益生菌发酵饲料对羔羊粪便中消化酶活性的影响
由表5可知,试验2、3和4组粪便CL活性显著高于试验1组(P<0.05)。试验3组粪便LPS和Try活性显著高于试验2和4组(P<0.05),极显著高于试验1组(P<0.01),试验2和4组显著高于试验1组(P<0.05),但试验2和4组间无显著差异(P>0.05)。试验3组粪便α-AL活性显著高于试验2和4组(P<0.05),极显著高于试验1组(P<0.01),试验4组显著高于试验1组(P<0.05),与试验2组无显著差异(P>0.05),试验1和2组间粪便α-AL活性无显著差异(P>0.05)。
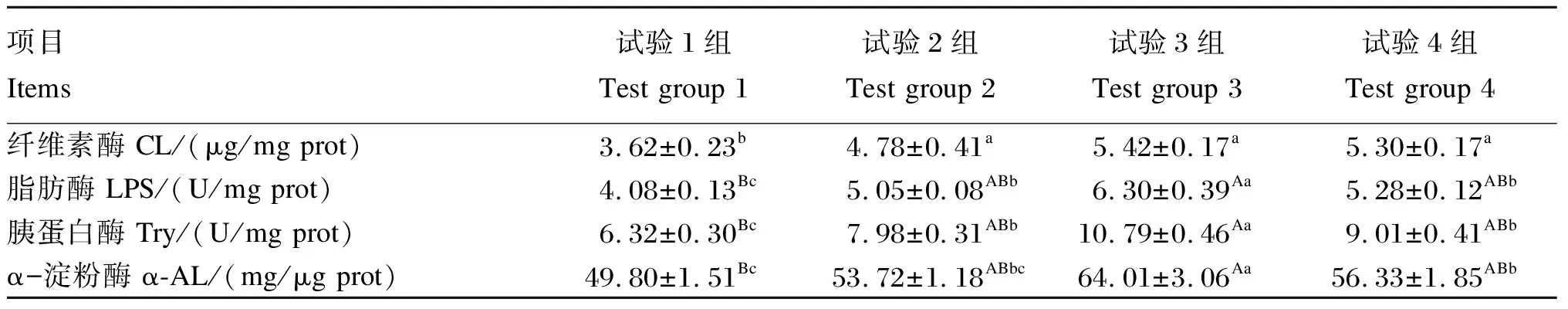
表5 复合益生菌发酵饲料对羔羊粪便中消化酶活性的影响
2.4 复合益生菌发酵饲料对羔羊粪便中氨气含量的影响
由表6可知,试验3和4组粪便氨气含量显著低于试验1组(P<0.05),与试验2组无显著差异(P>0.05),试验1和2组间氨气含量无显著差异(P>0.05)。

表6 复合益生菌发酵饲料对羔羊粪便氨气含量的影响
2.5 复合益生菌发酵饲料对羔羊粪便中微生物数量的影响
由表7可知,试验4组粪便乳酸杆菌数量显著高于试验1组(P<0.05),与试验2和3组无显著差异(P>0.05),试验1、2和3组间无显著差异(P>0.05)。试验3和4组粪便双歧杆菌数量显著高于试验1和2组(P<0.05),试验1与2组间、试验3与4组间无显著差异(P>0.05)。试验2、3和4组粪便大肠杆菌数量均显著低于试验1组(P<0.05)。试验3和4组粪便沙门氏菌数量均显著低于试验1组(P<0.05),与试验2组无显著差异(P>0.05),试验1和2组间无显著差异(P>0.05)。
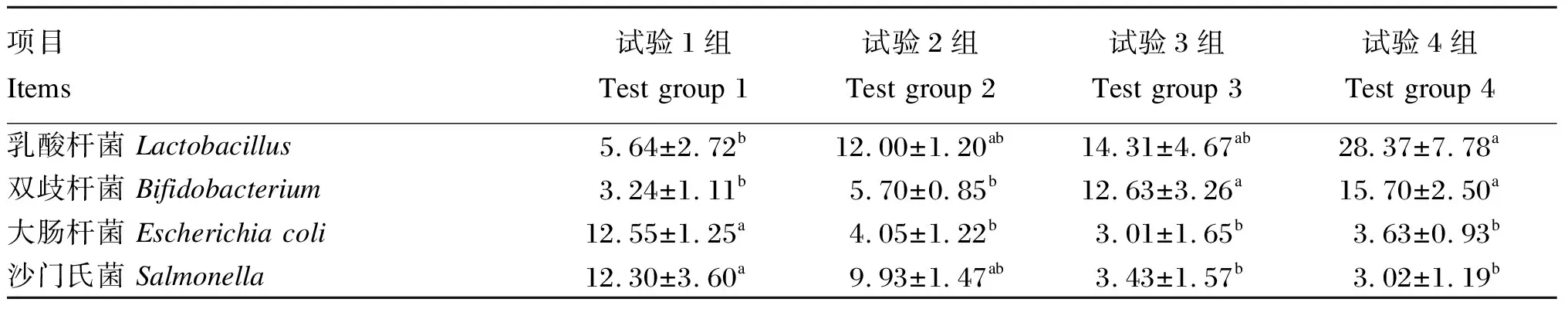
表7 复合益生菌发酵饲料对羔羊粪便中微生物数量的影响
3 讨 论
3.1 复合益生菌发酵饲料对羔羊采食量和营养物质表观消化率的影响
DM对动物的生长发育十分重要,采食更多的DM就意味着有更多的营养摄入[12]。张海涛[13]研究表明,哺乳犊牛饲粮中添加芽孢杆菌后采食量显著提高,分析原因可能是芽孢杆菌进入犊牛胃肠道定植,改变了相关酶的活性,进而提高了采食量,也可能是由于芽孢杆菌的特殊酸味提高了犊牛食欲,从而影响采食量。薛晨[14]研究表明,微生物发酵饲料中代谢产物为瘤胃微生物生长提供底物,促进乳酸利用菌增殖,降低pH,赋予饲料酸香味,刺激食欲,可显著提高0~2月龄哺乳犊牛的采食量。白培钿等[15]研究表明,添加0.2%益生菌复合制剂(乳酸菌、芽孢杆菌和酵母菌)显著提高了28日龄断奶仔猪的采食量和日增重,0.1%和0.3%益生菌剂未能使采食量和日增重达到预期结果,表明适宜剂量的益生菌可显著提高生长性能,添加量过高可能过度降低饲粮pH,肠道未能适应,影响适口性与采食量。本研究结果表明,5%、10%和15%组羔羊的DM采食量分别比对照组分别提高了14.62%、20.64%和9.38%,表明添加发酵饲料可影响羔羊的适口性和采食量。而10%组比5%组显著提高7.05%,比15%组显著提高12.43%,说明羔羊采食量不随发酵饲料添加比例增加而增加,可能是由于高比例发酵饲料中酸度大导致适口性降低,从而使采食量降低。因此,在本试验条件下哺乳羔羊开食料中添加发酵饲料的最佳添加量为10%。
饲粮中营养物质表观消化率既能反映动物的消化能力,也是评价动物生长性能的参考。益生菌发酵饲料可降解饲料中抗营养因子,其含有的消化酶等代谢产物可提高幼龄动物营养物质表观消化率[16-19]。反刍动物氮平衡是研究动物对蛋白质利用的指标,饲粮氮平衡可提高蛋白质消化利用率、减少氮的排放[20]。Higgins等[21]研究表明,乳酸菌通过益生作用把饲粮中蛋白质等大分子物质降解为可吸收利用的小分子肽和游离的氨基酸,提高机体食入氮含量,降低粪氮的排放,从而达到提高氮利用率的效果。本研究结果表明,各组食入氮的大小关系为10%组>5%组>15%组>0组(对照组),与羔羊DM采食量结果相一致。而5%、10%和15%组消化氮分别比对照组显著提高了19.44%、32.02%和18.57%,表明发酵饲料利于瘤胃微生物对氮的利用,促进微生物蛋白合成,这可能是因为益生菌在胃肠道定植后具有一定固氮能力,增加了含氮物质的吸收和利用,减少粪中氮排出[22];或是发酵饲料组的食入氮增加与粪氮的相对稳定提高氮的消化有关[23]。各组饲粮CP表观消化率的关系为10%组>15%组>5%组>对照组,与粪便Try活性增加规律一致,表明发酵饲料可通过影响羔羊肠道胰蛋白酶活性提高CP表观消化率,分析原因:一是发酵饲料本身由于微生物代谢可分泌多种蛋白酶[24],可促进CP的吸收率;二是发酵饲料含有益生菌和益生素,可调节动物胃肠道菌群平衡,促进胃肠道发育,从而提高CP表观消化率[25]。
曾钰等[26]研究表明,发酵杂粕中抗营养因子(单宁和棉酚)含量降低,蛋白酶等消化酶活性提高,可促进肉牛瘤胃中普雷沃氏菌属和拟杆菌属增殖,从而提高NDF和ADF的消化率,其中以75%替代比例最佳。Qiao等[27]研究发现,饲粮中添加100 g/d芽孢杆菌培养物可显著提高荷斯坦奶牛NDF和ADF消化率。本研究中,5%、10%和15%组中NDF表观消化率分别比对照组显著提高了16.00%、20.96%和3.36%,ADF表观消化率分别提高45.65%、52.87%和16.07%,可能与发酵饲料中微生物发酵产生的纤维降解酶可提高纤维吸收率有关[28]。张喆萍等[29]研究发现,饲喂15%发酵枣粉降低4~6月龄荷斯坦犊牛NDF和ADF消化率。以上研究说明,饲料中粗纤维(NDF和ADF)消化率不随发酵饲料添加比例的增高而增加。本研究也取得一致的结果,5%组比15%组NDF、ADF表观消化率分别提高了3.05%和35.24%,10%组比15%组分别提高了8.20%和43.84%,与本研究中DM采食量结果一致,原因可能是过量发酵饲料中益生菌可促进瘤胃内微生物大量增殖分泌乳酸,降低瘤胃内食糜酸度,过量乳酸会一定程度上抑制微生物增殖,加速食糜排空速率,降低饲料营养物质消化吸收[30],这与金立明等[31]研究表明,采食量与饲粮在瘤胃中降解率和食糜在小肠中排空的速度呈正相关结果一致。
动物消耗碳水化合物、蛋白质和脂肪三大能量源进行养分代谢,同时必然伴随着能量代谢[32]。严慧等[23]研究表明,羔羊的能量消化吸收率主要与瘤胃微生物促使酶的合成有关。高俊峰[32]研究表明,饲喂20%发酵木薯渣能调节黑山羊瘤胃微生物的健康繁殖,加快饲料中各种营养物质快速分解,产生足够多的挥发性脂肪酸,为山羊快速生长和发育提供足够的能量,从而提高GE消化率。本研究中,饲喂5%和10%发酵饲料后羔羊GE表观消化率显著高于对照组,主要是因为发酵饲料中益生菌和代谢产物的添加可调节胃肠道发育,从而促进羔羊对营养物质的吸收,提高能量利用率。研究发现,拟杆菌门和厚壁菌门比例可降低能量吸收利用率[33]。本研究中,15%组羔羊GE表观消化率比对照组降低了2.87%,推测可能是因为15%发酵饲料含有的活菌数量较多,影响了肠道菌群结构,过多的微生物在肠道增殖会额外消耗饲粮的营养物质[34],从而影响羔羊营养物质消化吸收。
3.2 复合益生菌发酵饲料对羔羊血清中GH、IGF-Ⅰ和INS含量的影响
GH是动物生长最重要的激素之一,可以促进蛋白质合成,加速蛋白质代谢,增强机体肌肉蛋白质沉积率[35]。IGF-Ⅰ主要由肝脏分泌,可以促进蛋白质合成,从而促进骨骼肌生长发育[36]。Fan等[37]研究表明,复合乳酸菌发酵玉米-豆粕饲粮可以提高肝脏IGF-Ⅰ的转录因子表达,从而显著提高育肥猪血清中IGF-Ⅰ含量。郑杰等[38]研究表明,50%发酵菜籽粕中多肽可促进3月龄断奶羔羊血清中GH合成,显著提高血清IGF-Ⅰ含量,促进肌肉蛋白质沉积,加速生长。占今舜等[39]研究发现,在2月龄断奶山羊饲粮中添加高水平乳酸菌会增加GH分泌,降低脂肪利用,山羊生长发育迟缓,添加低水平乳酸菌使血清总胆固醇含量提高,使机体脂代谢受阻,从而降低山羊生长发育,因此,适宜水平乳酸菌可促进激素分泌,提高营养物质的吸收利用,提高动物生长性能。本试验结果表明,饲粮中添加10%发酵饲料显著提高了羔羊血清中GH和IGF-Ⅰ含量,而5%和15%组血清GH和IGF-Ⅰ含量与对照组无显著差异,这与本研究中消化试验中饲喂发酵饲料后羔羊DM结果采食量结果一致,表明适宜水平益生菌发酵饲料可调节机体激素水平,提高采食以促进羔羊生长发育。
INS是胰岛B细胞分泌的一种可促进葡萄糖转运进入细胞加强糖元合成的蛋白质激素,可促进脂肪沉积和蛋白质、核酸的合成,有利于肌肉发育,促进动物生长。Jia等[40]研究表明,饲粮添加地衣芽孢杆菌和酿酒酵母替代莫能菌素可以显著提高育肥羔羊血清INS含量。白璐等[41]研究表明,利用雄性小鼠建立动物模型验证益生菌对胰岛素的作用,乳酸菌可调节小鼠肠道菌群变化,促进肠道短链脂肪酸产生,激活G蛋白耦联受体促进胰岛素分泌,显著提高小鼠血清INS含量。本试验结果表明,添加复合益生菌发酵饲料组与对照组相比均显著提高了羔羊血清中INS含量,说明发酵饲料中的益生菌可能通过改变羔羊肠道菌群平衡促进胰岛素分泌,有利于羔羊生长。而5%、10%和15%组间羔羊血清INS含量无显著差异,说明发酵饲料的添加水平对血清INS含量无显著影响,可能原因是羔羊在试验期内长期饲喂发酵饲料,益生菌已在羔羊肠道定植形成一个较高代谢水平的动态平衡,INS含量处在较高水平上的平衡状态内[42]。
3.3 复合益生菌发酵饲料对羔羊粪便消化酶活性的影响
动物消化道中的消化酶根据专一性可分为LPS、Try、CL和α-AL[43]。LPS又称三酰基甘油酰基水解酶,在碱性条件具有水解甘油三酯生成甘油和脂肪酸的能力,是动物脂质利用的标志[44-45]。CL是催化纤维素降解而生成葡萄糖的酶总称,可以提高动物对饲料粗纤维和抗性淀粉利用率,降低饲粮黏性促进反刍动物瘤胃发育[46]。Try是由胰腺分泌存在机体内的一种丝氨酸蛋白酶,可将蛋白分解为多肽[47]。α-AL可以反映碳水化合物在肠道中被消化成葡萄糖并被吸收利用的状态[48]。粪便消化酶活性可在一定程度上代表肠道消化酶活性。王长康等[49]研究表明,发酵豆粕中含有的乳酸等有机酸、益生菌和活性因子,通过降低pH、调节肠道菌群平衡刺激消化腺体及器官分泌消化酶,从而提高1~4周龄肉仔鸡十二指肠中AL和Try活性。研究表明,饲喂18%发酵刺梨渣可提高育肥肉牛小肠AL、糜蛋白酶、Try活性[50],具有影响粪便消化酶活性的潜力[51]。Wang等[52]和Sun等[53]研究表明,在肉仔鸡饲粮中添加外源菌(乳酸菌和酵母菌)可显著提高小肠Try和LPS活性,提高肉鸡生长性能。聂召龙等[54]研究表明,28日龄断奶公犊牛饲喂复合乳酸菌剂可改善肠道内环境,加强消化器官和消化腺功能的完善,显著提高空肠和回肠Try和LPS活性,提高营养物质消化率。霍姝伊等[55]研究表明,枯草芽孢杆菌剂作为外源菌种可分泌多种消化酶,可显著提高断奶仔猪粪便α-AL、LPS和CL活性,降低回盲肠内容物及粪便中CP、EE及粗纤维的含量,提高各营养物质消化吸收。李媛媛等[56]研究表明,7日龄哺乳仔猪口服乳酸菌后刺激仔猪小肠上皮发育,从而可显著提高空肠α-AL、Try和LPS活性。本研究结果表明,饲喂发酵饲料的羔羊粪便中α-AL、CL、Try和LPS活性均显著高于对照组,与上述结果一致,可能是因为发酵饲料中含有益生菌及其代谢产物,可以改善肠道微生物菌群,有利于维持肠道健康,从而提高消化酶活性,促进营养物质的消化吸收。5%、10%和15%组羔羊粪便中的CL活性无显著差异,推测原因可能是α-AL、Try和LPS由羔羊消化腺分泌[55],而CL受肠道共生微生物影响,当发酵饲料进入肠道后,机体会形成新的菌群平衡,因此发酵饲料剂量对粪便CL活性无显著影响。孟芳等[57]通过研究外源酶对羔羊瘤胃体外发酵液消化酶活性显示,中、低水平外源酶可提高饲粮在瘤胃中的降解率,而高剂量外源酶添加和消化道内源酶之间具有协同作用使部分内源酶的合成受到抑制[58]。饲喂发酵饲料组的羔羊粪便α-AL、Try和LPS活性大小关系为10%组>15%组>5%组,羔羊肠道中消化酶活性不随发酵饲料添加比例的增加而提高,这与营养物质表观消化率的结果一致,推测可能是由于高水平发酵饲料组益生菌数量较多,导致外源酶大量进入肠道,抑制了肠道内源酶的活性[34],从而降低营养物质吸收率。而10%组粪便α-AL、Try和LPS活性分别比5%组提高了16.07%、26.04%和19.84%,表明适宜比例发酵饲料可提高羔羊肠道中消化酶活性,促进营养物质吸收。综上所述,本试验条件下,哺乳羔羊开食料中复合益生菌发酵料的最佳添加量为10%。
3.4 复合益生菌发酵饲料对羔羊粪便NH3含量的影响
饲料搭配不合理或者蛋白质类物质消化不完全,会导致饲料中未消化的蛋白质在微生物的作用下产生大量NH3,不仅浪费饲料资源,而且会造成环境污染[59]。Seok等[60]研究表明,肉羊使用青贮饲料饲粮可改善粪便中氮的排放,主要与青贮饲料中CP含量和消化率相关[61]。也有报道,在断奶仔猪饲粮中添加乳酸杆菌[62]、枯草芽孢杆菌[63]和地衣芽孢杆菌[64]可分别使粪便NH3排放降低19.66%、17.85%和22.95%。廖云琼等[8]也证实,奶牛益生菌发酵饲料中细菌与肠道有益菌协同作用,增强胃肠功能,使含氮化合物向氨基酸方向转化,提高蛋白质利用率,同时肠道有益菌增殖通过竞争位点抑制大肠杆菌的活动,减少蛋白质向氨和胺的转化,从而降低牛粪NH3排放。本试验结果显示,添加5%、10%和15%发酵饲料使粪便氨气含量分别比对照组降低了40.68%、61.37%和71.56%,这与饲喂发酵饲料组中粪便Try活性显著增加,从而促进了饲粮氮消化结果一致,说明添加发酵料可以提高羔羊饲粮中蛋白质的利用率,降低氮排放,且添加比例越高氮排放越低,可能与发酵饲料中益生菌及其代谢产物的数量有关。
3.5 复合益生菌发酵饲料对羔羊粪便微生物数量的影响
动物肠道是由益生菌、致病菌群和宿主组成的动态平衡。肠道菌群失衡极易造成动物腹泻。乳酸杆菌和大肠杆菌是评价动物肠道平衡的主要指标。乳酸菌进入肠道后可与大肠杆菌等有害菌竞争肠道上皮的空间位点,争夺生长所需要的营养物质,从而降低有害菌数量[25],同时乳酸菌代谢可产生乳酸等有机酸,可将pH降低到3~4,抑制大肠杆菌等有害菌生长,改善羔羊肠道菌群[65]。刘辉等[3]研究表明,副干酪乳杆菌发酵饲料可显著提高生长猪粪便乳酸菌数量,降低大肠杆菌和金黄色葡萄球菌数量。Yuan等[66]利用乳酸菌、酵母菌和枯草芽孢杆菌发酵豆粕,显著降低断奶仔猪粪便大肠杆菌和沙门氏菌数量,显著提高乳酸菌数量。本试验中,随着发酵饲料添加比例增加粪便中有益乳酸菌、双歧杆菌数量逐步提高,大肠杆菌和沙门氏菌数量显著降低,与上述研究结果基本一致,说明哺乳羔羊饲喂复合益生菌发酵饲料后,由于微生物的摄入增加了肠道乳酸杆菌等有益菌数量,降低了大肠杆菌等有害菌数量,可调节肠道微生物菌群平衡,促进羔羊肠道健康。
4 结 论
复合益生菌发酵饲料可提高羔羊营养物质表观消化率、血清生长类激素含量和粪便消化酶活性,降低腹泻致病菌数量和NH3排放。本试验条件下,哺乳羔羊复合益生菌发酵饲料的最适添加量为10%。

