丹参素对糖尿病肾病大鼠Notch1/免疫球蛋白κJ区重组信号结合蛋白/Msh同源异型基因2信号通路及钙磷代谢的影响
陈霞,米爱红,秦丽
糖尿病肾病属糖尿病引起的慢性微血管并发症之一,临床上表现为尿蛋白和肾功能衰退[1];骨代谢、矿物质紊乱代谢综合征是终末期肾脏疾病的并发症之一,表现为钙、磷水平异常,而钙、磷水平异常可提高血管钙化率,是骨质疏松形成的途径之一,增加肾脏诱发骨病的风险,不利于治疗[2]。减少糖尿病肾病的并发症对于治疗疾病意义重大。丹参素对心血管具有保护作用,可作为一种钙拮抗剂有效抑制钙内流,从而抑制血管钙化[3],但具体作用机制尚不清楚。Notch1∕免疫球蛋白κJ区重组信号结合蛋白(RBP-Jκ)∕Msh同源异型基因2(Msx2)信号通路与血管钙化有明显的相关性[4],丹参素是否影响Notch1∕RBP-Jκ∕Msx2信号通路从而影响糖尿病肾病钙磷代谢而发挥对肾脏的保护作用尚未见报道。因此,本研究通过高糖高脂、链脲佐菌素(STZ)诱导建立糖尿病肾病大鼠模型,探究丹参素对糖尿病肾病大鼠钙磷代谢的影响,并探讨其初步机制。
1 材料与方法
1.1 实验动物2019年10月至2020年4月,健康SD大鼠购自北京维通利华实验动物科技有限公司[SPF级,许可证号SCXK(京)-2018-0017],体质量(210±10)g。河南省直第三人民医院动物饲养中心暂养,温度(24±1)℃、光照∕黑暗(12 h∕12 h)常规饲养。本研究符合一般动物实验伦理学原则。
1.2 试剂与仪器丹参素(西安清乐生物科技有限公司,批号090208,纯度≥98%);STZ(美国sigma公司,批号S0131);格列喹酮片(糖适平,北京万辉双鹤药业有限责任公司,批号H10940258);24 h尿微量白蛋白(microalbuminuria,mALB)试剂盒(南京森贝伽生物科技有限公司,批号SBJ-R0088);苏木精-伊红(HE)染色试剂盒(上海生工生物技术公司,批号E607318);Von Kossa染色试剂盒(北京索莱宝生物科技有限公司,批号G3282);一抗兔源Notch1、RBPJκ、Msx2、Jagged1、甘油醛-3-磷酸脱氢酶(GAPDH)、二抗辣根过氧化物酶(HRP)标记山羊抗兔(英国abcam公司);一抗兔源Notch1基因的胞内域(N1ICD,美国Bioworld公司)。血糖仪(强生医疗器材有限公司,型号UltraVue);全自动生化分析仪(日本Toshiba公司,型号TBA-40ER)。
1.3 动物分组及给药处理所有大鼠实验前检测尿蛋白、血糖水平。高糖高脂饲料各组分比例:胆酸钠0.1%、猪油10%、基础饲料61.9%、蔗糖20%、蛋黄粉8%。参照文献[5]构建糖尿病肾病大鼠模型,高糖高脂饲料连续饲养大鼠4周,禁食12 h后腹腔注射40 mg∕kg STZ,72 h后采集尾静脉血检测血糖水平,若空腹血糖(fasting blood glucose,FBG)≥16.70 mmol∕L,即为造模成功。选择造模成功大鼠50只,随机数字表法随机分为模型组、丹参素(低、中、高)剂量组、糖适平组,每组10只;对照组(n=10)基础饲料正常饲养相同时间,禁食12 h后腹腔注射等体积0.1 mol∕L柠檬酸盐缓冲液。丹参素(低、中、高)剂量组灌胃2.5 mL·kg-1·d-1、5.0 mL·kg-1·d-1、10.0 mL·kg-1·d-1丹参素,糖适平组灌胃9.45 mL·kg-1·d-1糖适平,对照组、模型组灌胃等体积蒸馏水,1次∕天,连续4周。
1.4 实验结束观察大鼠一般情况实验结束后观察各组大鼠精神状态,活动量情况,机体反应、饮食饮水、排尿量情况。
1.5 血糖仪检测FBG水平在给药前和实验结束后,动物禁食不禁水,尾静脉采血,血糖仪检测FBG水平。
1.6 24 h尿mALB试 剂 盒 检 测24 h尿mALB水平在给药前和实验结束后,动物禁食不禁水,收集24 h尿液,离心取上清,按照24 h尿mALB试剂盒说明书检测上清液中24 h尿mALB水平。
1.7 全自动生化分析仪检测血清中钙、磷水平给药后尾静脉取血,分离血清,全自动生化分析仪检测血清中钙、磷水平。钙×磷(mg2∕dL2)=钙(mmol∕L)×4×磷(mmol∕L)×3.1。
1.8 HE检测大鼠肾脏组织形态实验结束,尾静脉取血后立即处死大鼠,剖开腹腔取出肾脏,部分置于4%多聚甲醛固定后制备石蜡切片,苏木精染色、伊红复染,显微镜下观察肾脏组织形态。部分置于-80℃冰箱保存待检;同时剪取脊柱旁肾主动脉血管置于4%多聚甲醛固定。
1.9 Von Kossa染色检测大鼠肾主动脉钙盐沉积情况4%多聚甲醛中取出肾主动脉,制备石蜡切片,5%硝酸银浸染,5%硫代硫酸钠处理,0.5%伊红浸染,显微镜下观察肾主动脉钙盐沉积情况。黑色颗粒为钙盐沉积。
1.10 蛋白免疫印迹检测大鼠肾脏组织中Notch1、RBP-Jκ、Msx2、Jagged1、N1-ICD蛋白水平-80℃冰箱中取肾脏组织,添加蛋白裂解液冰上研磨,10 000g4℃离心20 min,上清即为总蛋白。相同蛋白量上样、凝胶电泳分离转至PVDF膜上,5%脱脂奶粉封闭;分别加入一抗Notch1、RBP-Jκ、Msx2、Jagged1、N1-ICD、GAPDH,4℃孵育过夜;加入对应二抗,室温孵育1 h。凝胶成像系统采集图像,Image J软件对条带进行灰度分析。
1.11 统计学方法采用SPSS 25.0软件进行统计学分析,计量数据均采用xˉ±s表示,多组间比较行单因素方差分析,两两比较行q检验。P<0.05为差异有统计学意义。
2 结果
2.1 丹参素对大鼠一般情况影响对照组大鼠正常饮食、饮水,精神状态良好;模型组大鼠精神萎靡、活动减少,反应迟钝、眼神无力,多饮多食、排尿量增加、垫料易潮湿;丹参素低剂量组症状稍优于模型组,但仍出现精神萎靡、活动减少、反应迟钝、双目无神,多饮多食、排尿量增加,垫料易潮湿;丹参素(中、高)剂量组、糖适平组情况缓解,活动基本正常,反应稍迟钝,但仍多饮多食、排尿量增加、垫料易潮湿。
2.2 丹参素对FBG、mALB的影响给药前,与对照组相比,模型组、丹参素(低、中、高)剂量组、糖适平组FBG、24 h尿mALB水平升高(P<0.05)。给药后,与对照组相比,模型组FBG、24 h尿mALB水平升高(P<0.05);与模型组相比,丹参素低剂量组24 h尿mALB水平,丹参素(中、高)剂量组、糖适平组FBG、24 h尿mALB水平降低(P<0.05)。见表1。
表1 大鼠空腹血糖(FBG)、24 h尿微量白蛋白(24 h尿mALB)水平比较
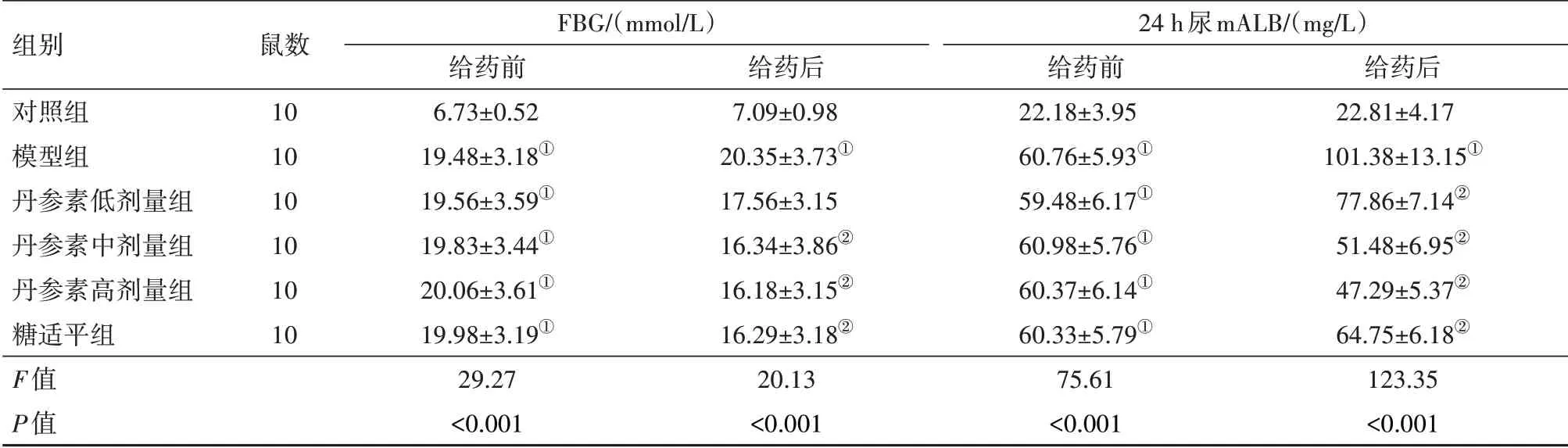
表1 大鼠空腹血糖(FBG)、24 h尿微量白蛋白(24 h尿mALB)水平比较
注:①与对照组相比,P<0.05。②与模型组相比,P<0.05。
组别对照组模型组丹参素低剂量组丹参素中剂量组丹参素高剂量组糖适平组F值P值鼠数10 10 10 10 10 10 FBG∕(mmol∕L)给药前6.73±0.52 19.48±3.18①19.56±3.59①19.83±3.44①20.06±3.61①19.98±3.19①29.27<0.001给药后7.09±0.98 20.35±3.73①17.56±3.15 16.34±3.86②16.18±3.15②16.29±3.18②20.13<0.001 24 h尿mALB∕(mg∕L)给药前22.18±3.95 60.76±5.93①59.48±6.17①60.98±5.76①60.37±6.14①60.33±5.79①75.61<0.001给药后22.81±4.17 101.38±13.15①77.86±7.14②51.48±6.95②47.29±5.37②64.75±6.18②123.35<0.001
2.3 丹参素对大鼠肾脏组织形态的影响对照组大鼠肾脏组织形态正常,结构清晰;模型组出现肾小球肥大、基膜增厚现象,组织纤维化、炎症浸润明显;丹参素低剂量组肾小球肥大、基膜增厚现象明显,组织纤维化、炎症现象明显;丹参素中剂量组肾小球肥大、基膜增厚缓解,组织纤维化消失、炎症缓解;丹参素高剂量组和糖适平组肾脏组织形态基本正常,无组织纤维化、炎症现象。见图1。
2.4 丹参素对大鼠肾主动脉血管钙化的影响对照组肾主动脉血管正常;模型组肾主动脉血管内膜、中膜弹性纤维间出现大量黑色颗粒,血管钙化严重;丹参素低剂量组肾动脉血管内膜、中膜弹性纤维间出现黑色颗粒,但相对模型组减少,血管钙化稍缓解;丹参素中剂量组肾主动脉血管内膜出现黑色颗粒,中膜弹性纤维间黑色颗粒减少,血管钙化缓解;丹参素高剂量组和糖适平组血管内膜、中膜弹性纤维间颗粒明显减少,血管钙化缓解。见图2。
2.5 丹参素对大鼠血清中钙、磷水平的影响与对照组相比,模型组血清中钙、磷、钙×磷升高(P<0.05);与模型组相比,丹参素(低、中、高)剂量组、糖适平 组 血 清 中 钙、磷、钙×磷 降低(P<0.05)。见表2。
表2 大鼠血清中钙、磷、钙×磷水平比较

表2 大鼠血清中钙、磷、钙×磷水平比较
注:①与对照组相比,P<0.05。②与模型组相比,P<0.05。
组别对照组模型组丹参素低剂量组丹参素中剂量组丹参素高剂量组糖适平组F值P值鼠数10 10 10 10 10 10钙∕(mmol∕L)2.24±0.09 2.89±0.14①2.74±0.11②2.63±0.08②2.46±0.09②2.64±0.07②51.77<0.001磷∕(mmol∕L)2.49±0.21 3.48±0.28①3.14±0.29②3.01±0.25②2.78±0.18②3.02±0.22②19.14<0.001钙×磷∕(mg2∕dL2)71.06±13.48 126.29±13.16①106.73±12.57②96.18±10.33②84.83±8.18②97.96±9.18②27.63<0.001
2.6 丹参素对大鼠肾脏组织Notch1、RBP-Jκ、Msx2、Jagged1、N1-ICD蛋白水平的影响与对照组相比,模型组肾脏组织中Notch1、RBP-Jκ、Msx2、Jagged1、N1-ICD蛋白水平升高(P<0.05);与模型组相比,丹参素低剂量组肾脏组织中Notch1,RBP-Jκ、N1-ICD蛋白水平降低,丹参素(中、高)剂量组、糖适平组肾脏组织中Notch1、RBP-Jκ、Msx2、Jagged1、N1-ICD蛋白水平降低(P<0.05)。见图3,表3。
表3 大鼠肾脏组织中Notch1,RBP-Jk,Msx2,Jagged1、N1-ICD蛋白水平比较

表3 大鼠肾脏组织中Notch1,RBP-Jk,Msx2,Jagged1、N1-ICD蛋白水平比较
注:RBP-Jκ为免疫球蛋白κJ区重组信号结合蛋白,Msx2为Msh同源异型基因2,N1-ICD为Notch1基因的胞内域。①与对照组相比,P<0.05。②与模型组相比,P<0.05。
组别对照组模型组丹参素低剂量组丹参素中剂量组丹参素高剂量组糖适平组F值P值鼠数10 10 10 10 10 10 Notch1 0.31±0.06 1.06±0.15①0.94±0.11②0.46±0.08②0.14±0.03②0.15±0.04②202.90<0.001 RBP-Jk 0.37±0.04 1.15±0.03①1.01±0.06②0.38±0.04②0.08±0.01②0.07±0.02②1 572.59<0.001 Msx2 0.23±0.04 0.69±0.05①0.64±0.05 0.42±0.04②0.13±0.03②0.14±0.04②345.14<0.001 Jagged1 0.18±0.04 0.89±0.08①0.83±0.11 0.43±0.08②0.17±0.02②0.23±0.04②226.51<0.001 N1-ICD 0.24±0.04 1.27±0.21①0.87±0.14②0.36±0.05②0.17±0.04②0.21±0.05②168.17<0.001

图3 大鼠肾脏组织中Notch1,RBP-Jκ,Msx2,Jagged1和N1-ICD蛋白水平
3 讨论
糖尿病肾病是糖尿病终末阶段,血管钙化率明显高于正常同龄人。血管钙化是钙磷沉积血管壁,可促进高血压、肾小球囊内压升高,加速肾脏微血管钙化,从而加速疾病发展[6];钙磷积累导致血管变窄变脆,与心血管事件死亡率相关,是心血管疾病的危险因素[7]。本研究首先构建糖尿病肾病大鼠模型,通过检测FBG、24 h尿mALB水平,观察肾脏组织病理学形态改变以验证模型构建是否成功。结果发现与正常对照组相比,模型组FBG、24 h尿mALB水平升高;大鼠出现精神萎靡、活动减少,反应迟钝、眼神无力,多饮多食、排尿量增加、垫料易潮湿;形态学观察发现肾小球肥大、基膜增厚现象,组织纤维化、炎症浸润明显,提示模型建立成功。Von Kossa染色发现模型组大鼠肾主动脉血管内膜、中膜弹性纤维间出现大量黑色颗粒,血清中钙、磷、钙×磷升高,提示糖尿病肾病大鼠血管钙化严重,沉积于肾主动脉血管处,导致肾小球肥大、基膜增厚,影响病情。
丹参素是从中药丹参中提取的水溶性酚酸类化合物,易溶于水,难溶于有机溶剂,具有广泛的药理作用,可预防动脉粥样硬化、抗氧化、减少纤维化、促进骨髓基质干细胞分化为成骨细胞等;同时可抑制钙离子内流;起抗炎作用,可清除自由基,保护因钙离子超载和氧化应激引起的细胞损伤[8-9]。冠心病中钙离子负荷是引起心肌细胞缺血及再灌注损伤的一个重要机制,丹参素可调节钙离子进出,减轻钙离子负荷,实现对心肌细胞的保护[10]。本研究发现,丹参素随着剂量的增加,大鼠活动逐渐恢复正常,反应迟钝减少;肾小球肥大、基膜增厚缓解,组织纤维化消失、炎症缓解;肾主动脉血管内膜、中膜弹性纤维间黑色颗粒减少,血管钙化缓解;血清中钙、磷、钙×磷升高。提示丹参素可缓解糖尿病肾病大鼠活动减少、精神萎靡、反应迟钝等临床症状,缓解肾脏组织损坏,减少肾主动脉血管钙化情况,从而实现对大鼠的保护。
Notch1信号通路属高度保守信号转导通路,可调节细胞增殖、凋亡、分化等过程,参与多种组织器官发育[11],同时参与血管钙化、骨骼异常改变、癌症发生发展等过程,其中血管钙化类似于骨形成的主动调节过程,与血管钙化关系密切[12]。转录因子RBP-Jκ属Notch信号通路调节因子,DNA结合蛋白在哺乳动物中成为RBP-Jκ,可识别并结合特定的DNA序列从而发挥功能[13]。Msx2属肌节同源框家族一员,存在于充质细胞与上皮细胞交界处,参与细胞增殖、分化过程,与心血管、骨骼等组织发育密切相关,编码的转录抑制蛋白可参与调控细胞增殖、凋亡过程,从而影响机体发育[14]。在肾结石中存在明显的钙化情况,肾脏组织中Msx2水平明显高于对照组,Msx2表达水平可显示肾结石的钙化情况[15]。Jagged1作为Notch1的配体,在血管生成中发挥重要作用[16]。受体Notch1与相邻的配体Jagged1结合可活化Notch信号通路,活化Notch信号通路可暴露出N1-ICD,活化的N1-ICD可与RBP-Jκ结合活化Notch靶基因,Msx2是其中的一个靶基因,可直接参与血管钙化过程[17-19]。本研究发现,与对照组相比,模型组大鼠肾脏组织中Notch1、RBP-Jκ、Msx2、Jagged1、N1-ICD蛋白水平升高,提示糖尿病肾病肾脏组织中Notch信号通路处于激活状态,Notch1与Jagged1结合后暴露出N1-ICD,N1-ICD结合RBPJκ促进Msx2表达,促进钙、磷水平升高,钙、磷过多在血管中累积,肾血管出现钙化,钙化的血管加重疾病进程。与模型组相比,丹参素低剂量组肾脏组织中Notch1,RBP-Jκ、N1-ICD蛋白水平降低,丹参素(中、高)剂量组、糖适平组肾脏组织中Notch1、RBP-Jκ、Msx2、Jagged1、N1-ICD蛋白水平降低,提示丹参素可抑制上述Notch信号通路从而降低钙、磷水平,实现对肾脏组织保护。
通过本研究认为丹参素可能通过Notch1∕RBPJκ∕Msx2信号通路发挥对糖尿病肾病大鼠钙磷异常的调控,从而实现肾脏的保护作用。
(本文图1,2见插图1-3)

图1 大鼠肾脏组织形态(HE染色×400) 图2 大鼠肾主动脉血管钙化情况(Von Kossa染色×200)

