荒漠植物柠条根际土壤nifH基因荧光定量及固氮菌多样性分析
刘爽 姚佳妮 沈聪 代金霞
(宁夏大学生命科学学院,银川 750021)
荒漠生态系统是陆地生态系统中最为脆弱的系统之一,其物种组成和分布格局具有独特性,且随着生物土壤结皮、植被的不断演变,微生物的群落结构和群落功能也会随之发生变化[1]。荒漠植物根系与土壤微生物关系密切,植物根系及其分泌物为土壤微生物在荒漠化土壤中的定殖提供了源源不断的植物源有机基质,而根际微生物为植物富集生长所必需的元素[2],在荒漠植物的生长和抗逆方面起到了重要的作用。生物固氮是荒漠生态系统中氮素补充的重要途径[3]。固氮微生物作为驱动氮循环的媒介,正受到越来越广泛的关注[4]。固氮菌通过体内固氮酶催化生物固氮过程,编码固氮酶的基因(包括nifH,nifK,nifD)在不同固氮生物中高度保守[5],其中nifH 基因是最保守的,并且在系统发育分析中所产生的拓扑结构与16S rRNA 基因非常相似[6-7],故被选为研究固氮微生物系统发育、多样性和丰度的首选标记基因,以nifH 基因为靶基因的分子技术在生态学中的应用也为研究氮循环微生物群落提供了新的途径。
目前对荒漠土壤中固氮菌多样性、丰度和群落组成的了解仍然有限,已有的研究主要采用克隆和PCR-DGGE 等方法,无法反映荒漠区不同地域固氮微生物群落的全貌。因此开展荒漠生境中土壤固氮微生物的群落组成和多样性研究,不仅有助于发掘新的功能类群或功能潜力,以从微观的角度理解生态环境的变化,而且对了解荒漠土壤中氮素循环调节具有重要意义。柠条(Caraganaspp.)是我国西北地区荒漠、半荒漠及干旱草原地带防风固沙的先锋植物之一[8],具备极强的抗旱性、抗寒性和耐盐碱性,在维护干旱荒漠区的生态平衡和改善沙区环境中发挥着十分重要的生态学作用。本研究以宁夏荒漠区5 个柠条群落根际土壤为研究材料,以nifH基因为靶基因,采用荧光定量PCR 和高通量测序技术,分析荒漠生境下柠条根际土壤中nifH 基因丰度信息和固氮菌群落结构组成,结合分离培养方法对柠条根际固氮菌进行分离筛选和多样性研究,旨在为进一步挖掘固氮菌资源、丰富荒漠区微生物资源库提供基础资料,也为深入探索荒漠化生境中植物根际微生物群落结构与功能之间的关系奠定基础。
1 材料与方法
1.1 材料
1.1.1 土壤样品 选取宁夏同心罗山(LS)、红寺堡石炭沟(HSP)、沙坡头固沙林场(SPT)、灵武枣泉煤矿(ZQ)和白芨滩甜水河林场(TSH)5 个荒漠柠条群落进行土壤样品采集,采样信息见图1。采用五点取样法,将柠条根周围的土挖开,待根暴露出来后,将根部附着的土壤用毛刷轻轻刷取到灭菌离心管中,混匀后编号放于冰盒中。每个样地采集3 份,共采集15 份土样,一部分用于土壤理化性质测定,另一部分用于DNA 的提取。

图1 柠条根际土壤采集地示意图(审图号:GS(2019)1822)Fig.1 Sampling sites of rhizosphere soil of Caragana spp.(Map inspection number:GS(2019)1822)
1.1.2 培养基 采用YMA 培养基(KH2PO40.25 g、K2HPO40.25 g、NaCl 0.1 g、酵母提取物3 g、MgSO4·7H2O 0.2 g、甘露醇10.0 g、Rh 微量元素液4 mL(Rh微量元素液:H3BO35 g/L,Na2MnO45 g/L、蒸馏水加至1 000 mL)、联合固氮类培养基(KH2PO40.4 g、K2HPO40.1 g、D-葡萄糖酸钠5.0 g、MgSO4·7H2O 0.2 g、NaCl 0.1 g、CaCl20.02 g、FeCl30.01 g、酵母提取物 0.8 g、钼酸钠0.002 g、蒸馏水1 000 mL)、固氮类芽孢杆菌培养基(蔗糖10.0 g、蛋白胨1.0 g、酵母提取物0.8 g、NaCl 0.1 g、CaCO35.0 g、KH2PO40.2 g、K2HPO40.08 g、MgSO4·7H2O 0.5 g、蒸馏水1 000 mL)和无氮培养基(甘露醇10.0 g、KH2PO40.2 g、MgSO4·7H2O 0.2 g、NaCl 0.2 g、CaSO4·2H2O 0.2 g、CaCO35.0 g、蒸馏水1 000 mL)进行固氮菌的分离。采用LB 培养基进行菌株的发酵。
1.2 方法
1.2.1nifH 基因实时荧光定量PCR
1.2.1.1 土壤样品总DNA 提取 使用试剂盒提取根际土壤基因组总DNA,经1%琼脂糖凝胶电泳检测基因组DNA 的抽提效果和完整性。
1.2.1.2 标准品制备 以提取的土壤DNA 为模板进行PCR 扩增,扩增引物采用nifH-F(5′-AAAGGYGG WATCGGYAARTCCACCAC-3′)和nifH-R(5′-TTGTTS GCSGCRTACATSGCCATCAT-3′),获得约458 bp 的基因片段。PCR 产物纯化后连接到 T 载体,筛选阳性克隆体提取质粒,10 倍梯度稀释构建好的质粒样本,选取标准品的10-3-10-8浓度梯度的标准质粒为模板进行荧光定量 PCR 扩增,用于制备标准曲线。
1.2.1.3nifH 基因荧光定量PCR 采用ABI7300 实时定量PCR 系统进行检测,通过SYBR Green I 染料法测定固氮菌nifH 基因的拷贝数。每个样品设3 次重复,以不加模板的反应管为阴性对照。扩增条件为:95℃预变性3 min;95℃变性30 s,60℃退火30 s,72℃延伸40 s,扩增35 个循环,最后于72℃延伸10 min。以荧光强度达阈值时的循环数(Ct 值)与浓度梯度构建标准曲线。将得到的样品 Ct 值代入标准曲线中,计算样品中nifH 基因的拷贝数。
1.2.2nifH 基因的高通量测序 将回收的nifH 基因PCR 产物委托上海美吉生物技术有限公司进行Illumina 高通量测序。将得到的序列根据PE reads 之间的overlap 关系,成对的reads 拼接成一条序列,同时对reads 的质量和拼接的效果进行质控过滤,根据序列首尾两端的barcode 和引物序列区分样品得到有效序列,并校正序列方向,即为优化数据。再将样本中的有效序列在97%水平上进行OTU 聚类,根据OTU 聚类结果,进行多样性指数分析及测序深度检测;根据分类学信息,在各个分类水平上对样本的群落组成进行统计分析。
1.2.3 可培养固氮菌的分离及鉴定
1.2.3.1 固氮菌富集和初步筛选 取土壤10 g 加入装有90 mL 分离培养基的三角瓶中,28℃、180 r/min振荡富集培养24 h,然后按照1%接种量转接到新的分离培养基中进一步富集培养,重复转接3-4 次,然后用无菌水进行梯度稀释(10-4-10-7),分别取200 μL 不同浓度梯度的土壤悬液涂布于对应的分离培养基中,28℃培养至菌落长出后,挑取单菌落分别在分离平板上划线纯化3-4 次,对菌落进行形态观察与记录,并在LB 培养基上对菌株进行去重复和保存。
1.2.3.2nifH 基因复筛 采用引物nifH-F/nifH-R 对菌株的nifH 基因进行PCR 扩增,阴性对照使用ddH2O 作为模板。挑选能够扩增出目的片段为458 bp 左右的阳性菌株,经测序验证后确定为固氮菌。
1.2.3.3 生理生化特性分析 对菌株进行革兰氏染色、淀粉水解、接触酶和硝酸盐还原等生理生化,参照《常见细菌系统鉴定手册》[9]和《伯杰细菌鉴定手册》(第8 版)对菌株进行鉴定[10]。
1.2.3.4 菌株16S rRNA 基因序列扩增和测序 使用通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)、1492R(5′-GGTTACCTTGTTACGACTT-3′)对菌株基因组DNA 的16S rRNA 基因全长序列进行PCR 扩增,产物经回收验证后送上海生工生物工程有限公司测序,将得到的序列在NCBI 网站比对,选取相似度高的菌株作为参考菌株,应用MEGA 11.0 软件构建系统发育树。
1.2.4 数据处理 采用Excel 2017 进行数据处理,SPSS 23.0 进行单因素方差分析和Pearson 相关性分析。
2 结果
2.1 不同样地柠条根际土壤固氮菌nifH基因的丰度分析
通过RT-qPCR 反应对5 个柠条群落根际土壤样品中的nifH 基因含量进行检测,结果表明(表1),各样地中nifH 的拷贝数表现为LS>TSH>ZQ>HSP>SPT,其中LS 样地的nifH 基因拷贝数显著高于其它4 个样地,而其它样地间nifH 的拷贝数没有显著差异,SPT 样地nifH 基因拷贝数最低,说明LS 样地柠条根际土壤固氮菌含量显著高于其他样地,而SPT 样地柠条根际土壤固氮菌含量最低。

表1 nifH 基因Ct 值和定量结果Table 1 Ct values and quantitative results of nifH gene
2.2 柠条根际土壤固氮菌多样性和群落结构分析
2.2.1 柠条根际土壤固氮菌群落OTU 聚类及Alpha多样性分析 本研究通过对5 个柠条样地根际土样固氮菌菌群进行Illumina Miseq 高通量测序,共获得264 763 条有效序列,将序列相似性大于97%的有效序列进行聚类,共获得5 871 个OTUs,各样地nifH 基因测序深度指数范围为98.39%-98.86%,说明测序深度能够反映柠条根际真实的固氮菌群落组成及多样性信息。不同样地柠条根际土壤中固氮菌群落丰富度和多样性存在差异,由表2中群落多样性指数结果可知,表征群落丰富度的Sobs、Chao1 和Ace 指数在各样地间的表现均为LS<TSH<HSP<SPT<ZQ,说明LS 样地柠条根际土壤固氮菌的丰富度最低,而ZQ 样地中固氮菌的丰富度最高;表征群落多样性的Shannon 指数在各样地中的表现为LS<TSH<HSP<ZQ<SPT,Simpson 指数为LS >HSP >ZQ >TSH >SPT,说明固氮菌菌群的多样性为LS 样地中最低,SPT 样地则高于其他样地。

表2 不同样地固氮菌OTUs 数目及 Alpha 多样性指数Table 2 Number of OTUs and Alpha diversity index of nitrogen-fixing bacteria at different sample sites
2.2.2 柠条根际土壤固氮菌的群落结构组成分析 测序结果通过物种注释,5 份柠条根际土壤共获得7 门12 纲26 科30 属固氮菌。从科水平的Venn 图可以看出(图2-A),5 个样地共有固氮菌11 个科,LS、SPT 各有1 个特有科,TSH 有4 个特有科。图2-B 显示,未分类的固氮菌在柠条根际占有较大比重,相对丰度为14.57%-56.51%。在可定义的科中,除SPT 样地外,其余4 个样地均以红螺菌科(Rhodospirillaceae)为优势菌群,相对丰度为23.71%-73.45%,在LS 样地丰度最高;产碱菌科(Alcaligenaceae)为次优势科,相对丰度在3.84%-13.68%之间。而SPT 的固氮菌群落与其它样地差别较大,以叶杆菌科(Phyllobacteriaceae)为优势科,相对丰度为22.77%,远高于其它样地,红螺菌科为次优势科,占17.43%;假单胞菌科(Pseudomonadaceae)、慢生根瘤菌科(Bradyrhizobiaceae)和类芽孢杆菌科(Paenibacillaceae)也是5 个样地的共有类群,它们的相对丰度在不同的样地中差别较大。
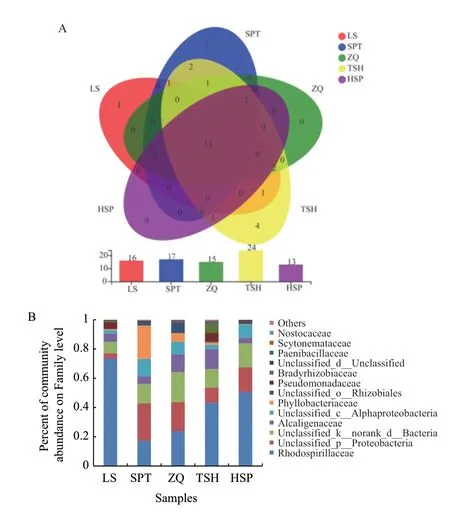
图2 柠条根际土壤固氮菌在科水平的Venn 图(A)及群落组成柱形图(B)Fig.2 Venn diagram(A)and column diagram(B)of community composition of nitrogen-fixing bacteria in the rhizosphere soil of Caragana spp.at family level
在属水平上,5 个样地共有属12 个,SPT、LS和TSH 分别有特有属1、2 和6 个。TSH 样地分布有27 个属,属水平的多样性显著高于其他样地(图3-A)。群落组成结果显示(图3-B),5 个样地中未分类的固氮菌相对丰度为16.89%-57.03%。在可定义的属中,斯科曼氏球菌属(Skermanella)是SPT以外4 个样地共有的优势属,相对丰度为23.19%-71.14%,在LS 样地中占绝对优势,相对丰度高达71.14%;广泛固氮氢自养单胞菌属(Azohydromonas)是次优势属,相对丰度3.84%-13.68%。SPT 样地中以中慢生根瘤菌属(Mesorhizobium)为优势属,相对丰度为22.77%,显著高于其它4 个样地(0.26%-5.83%),斯科曼氏球菌属为次优势属,占17.09%。固氮菌属(Azotobacter)虽是共有属,但其相对丰度在各样地间有较大差异,占0.41%-5.89%,在TSH中丰度最高。
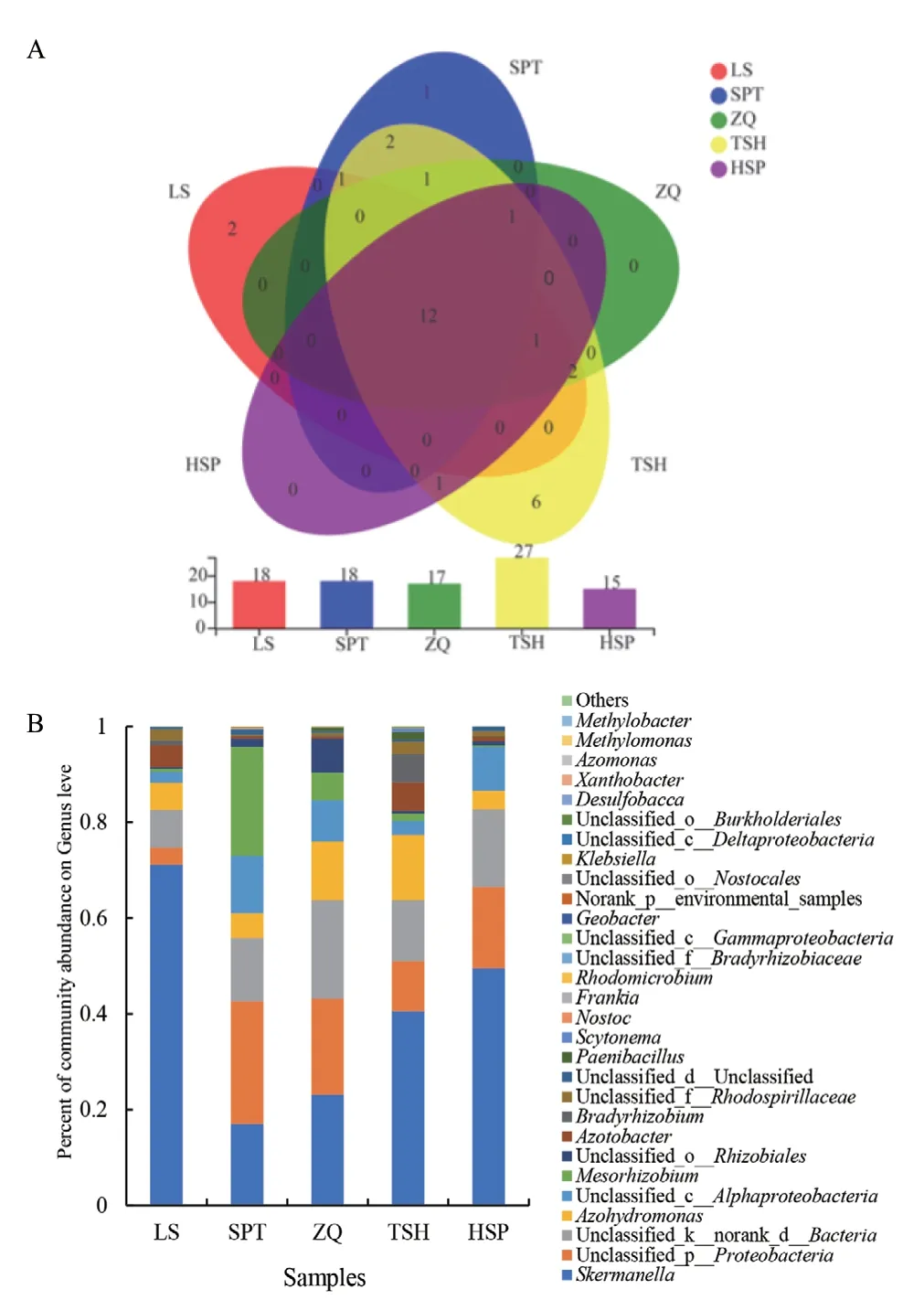
图3 柠条根际土壤固氮菌在属水平的Venn 图(A)及群落组成柱形图(B)Fig.3 Venn diagram(A)and column diagram(B)of community composition of nitrogen-fixing bacteria in rhizosphere soil of Caragana spp.at genus level
2.3 环境因子相关性分析
将柠条根际土壤nifH 基因拷贝数与土壤理化性质进行Pearson 相关性分析,结果表明(表3),nifH基因拷贝数与土壤速效磷、有机质和总氮(P<0.005)呈显著正相关,且相关性较强,相关系数分别为0.924、0.965 和0.977。

表3 nifH 基因拷贝数与土壤理化性质的Pearson 相关分析Table 3 Pearson correlation analysis between nifH gene copy number and soil physicochemical properties
相关性Heatmap 图通过相关性数值可视化展示样本中不同的物种与环境变量之间的关系,评估微生物分类与环境变量之间的相关性。将30 个固氮菌类群和土壤理化性质进行Spearman 相关性分析,结果如图4所示,土壤总氮(total nitrogen,TN)、速效氮(availliable nitrogen,AN)、总磷(total phosphorus,TP)和有机质(soil organic matter,SOM)显著影响固氮菌群落组成。一些未分类的固氮菌如Unclassified_o__Rhizobiales和Unclassified_p__Proteobacteria等与SOM 和TN 极显著负相关,而Unclassified_o_Burkholderiales与速效磷(availliable phosphorus,AP)、速效钾(availliable kalium,AK)、SOM 和TN 极显著正相关。慢生根瘤菌属和弗兰克氏菌属(Frankia)受多种土壤因子影响,与AN 和pH 极显著正相关,与SOM 和TN 显著正相关;类芽孢杆菌属(Paenibacillus)与AK 和TK 显著负相关,与AN 极显著正相关。固氮菌属与TN 和TP 显著正相关。
2.4 柠条根际土壤可培养固氮菌的多样性分析
2.4.1 固氮菌的生理生化特征测定结果 采用4 种分离培养基从5 个柠条群落根际土壤中分离出固氮菌株53 株,通过nifH 基因的扩增与测序,其中有26个菌株扩增出了450 bp 左右的目的片段(GenBank序列登录号为OL799110-OL799133)。菌株的生理生化特征测定结果表明,有19 株为革兰氏阴性菌,仅有7 株为革兰氏阳性菌。大部分菌株H2O2酶反应呈阳性,而只有一株菌株淀粉水解为阳性,且V.P、甲基红和吲哚反应中呈阳性的菌株也较少,分别为4 株、5 株和4 株,具体结果见表4。
2.4.2 菌株分子鉴定结果 对26 个菌株进行16S rRNA 基因序列分析,并与NCBI 数据库进行比对,同源性在 99%-100%之间,结合重建的系统发育树信息(图5),结果表明,这些菌株隶属于15 个属,在属水平上多样性丰富,有常见的假单胞菌属(Pseudomonas)、根瘤菌属(Rhizobium)和肠杆菌属(Enterobacter)等,分离的假单胞菌属占代表菌株的23.08%,是根际优势菌属。还包括一些不常见报道的固氮类群如微杆菌属(Microbacterium)、贪噬菌属(Variovorax)和短波单胞菌属(Brevundimonas)等。将所测菌株的16S rDNA 序列提交至GenBank,获得序列登陆号为OL757766-OL757791。

图5 基于 16S rRNA 基因序列构建的柠条根际固氮菌的系统发育树Fig.5 Phylogenetic tree of nitrogen-fixing bacteria in the rhizosphere soil of Caragana spp.based on the 16S rRNA gene sequences
3 讨论
实时荧光定量技术是检测环境样品中特定基因的有效手段,通常采用绝对定量对环境中的基因丰度进行测定[11-12]。nifH 基因作为衡量土壤氮循环的有效指标,其丰度的变化受到多个环境因子的调控[13]。已有研究表明,nifH 基因丰度与土壤磷和速效钾等土壤理化性质密切相关[14]。张萌等[4]的研究结果表明,在内蒙古3 种草原类型土壤中nifH 基因的丰度与土壤氨态氮和总氮含量显著正相关;类似地,Chen 等[15]分析了秸秆覆盖和施氮处理后固氮菌群落组成与环境因子的关系,结果显示nifH 基因丰度与SOM、AK、AP 和AN 含量呈正相关。在本研究中,5 个柠条群落根际土壤固氮基因nifH 的拷贝数与AP、SOM 和TN 呈显著正相关,与前人的结果一致,表明固氮菌丰度和分布受到不同生境中非生物和生物因素共同影响,其通过强大的适应能力来顺应环境的变化并发挥固氮功能。
基于nifH 扩增子测序对宁夏荒漠区5 个柠条群落根际土壤中固氮细菌的群落结构与多样性进行分析,结果表明:属水平上的斯科曼氏球菌属和未分类的Proteobacteria 是5 个样地的优势菌群,这与唐凯等[16]对浑善达克沙地下层土壤固氮细菌群落优势菌属的研究结果类似,同样郑超等[17]的研究结果表明戈壁荒漠土壤固氮菌优势类群也与本文一致。也有研究通过nifH 高通量测序发现斯科曼氏菌属是黄瓜间作所有样品中的优势菌属[18]。类似地,Zou等[19]的研究结果表明随着黑土中连续种植玉米的年数增加,斯科曼氏菌属的相对丰度增加,但土壤氮素并没有累积,因为该属含有nifH 基因但不能固定N2[20],有关斯科曼氏菌属的生态功能有待进一步验证。此外,还检测到中慢生根瘤菌属、慢生根瘤菌属、念珠藻属和弗兰克氏菌属等共生固氮菌类群,以及固氮菌属和类芽孢杆菌属等联合固氮菌,这些固氮菌多样性丰富具有多种促生及抗逆的生态功能,能与荒漠植物在逆境胁迫下相互选择、共同进化,形成了独特的抗逆抗旱系统,有效保障了物种生态系统功能的正常发挥[21]。已有的研究表明,pH、总氮、总碳、总钾和速效氮都会显著影响固氮微生物群落的多样性与结构[5,22]。本研究中,土壤总氮、速效氮、总磷和有机质显著影响固氮微生物群落,与刘璐等[23]的研究结果一致。蔡树美等[24]对滩涂土壤固氮菌群落的研究同样表明影响较大的主要环境因子为有机质和速效磷等,说明土壤理化性质是影响固氮微生物群落的重要因素之一。
从宁夏5 个不同荒漠区柠条群落根际土壤中分离出15 个固氮菌属,在属水平上多样性丰富,包括共生固氮菌如根瘤菌属和中华根瘤菌属,联合固氮菌如假单胞菌属和肠杆菌属。其中假单胞菌属为优势菌属,占代表菌株的23.08%,与杨鸿儒[25]和雷海英[26]的研究结果一致。基于假单胞菌繁殖快、定殖能力强、营养要求简单,且能够抑制多种植物病害和促进植物生长的特点,因而在环境中分布范围广且对环境的适应性强[27]。5 个荒漠土壤生境还分离出一些不常见的固氮类群如不动杆菌属(Acinetobacter)、勒克氏菌属(Leclercia)、金黄杆菌属(Chryseobacterium)、寡养单胞菌属(Stenotrophomonas)、微杆菌属、贪噬菌属和短波单胞菌属。已有研究发现,这些菌属都具有固氮和溶磷能力,有些还具有多种PGP(plant growth promoting)功能和拮抗病原菌活性[28-32]。此外还分离出布丘氏菌属和Pseudescherichia,目前还未见有这两个类群固氮功能的报道,但两者都能在筛选培养基上转接正常生长,也能扩增出nifH 基因并得到测序验证。由于环境、植物以及根系分泌物的不同会招募不同的固氮类群,而本研究样地也分离出了一些特异的固氮类群,充分反映了宁夏荒漠区柠条根际可培养固氮菌的多样性。
高通量测序结果分析表明5 个样地中并没有检测到可培养固氮菌如假单胞菌属、勒克氏菌属和根瘤菌属等,可能是由于引物对nifH-F/nifH-R 有一定的偏好性,无法全面覆盖nifH 基因的多样性[33];此外基于特征性分子标靶基因片段扩增子得到的OTU 不足以代表含有该特征片段的所有微生物,特别是稀有物种,其标靶基因序列可能与已知菌株具有较大差异而无法被现有方法检测[34]。而高通量测序中的一些优势菌属如斯科曼氏菌属没有被分离出来,可能由于培养基等培养条件的限制,缺少一些固氮菌需要的营养物质,如钴胺素、生物素等[35-37],而导致其无法生存。但本研究将高通量测序和纯培养的方法相结合,更全面地分析了柠条根际土壤固氮菌的结构组成和多样性特征,为深入了解荒漠生境中固氮微生物群落构成及固氮菌资源的开发利用奠定基础。
4 结论
宁夏荒漠柠条林地土壤固氮菌群落结构存在差异,其中LS 固氮菌含量高但多样性最低,而SPT固氮菌含量最低但多样性高。红螺菌科、产碱菌科、叶杆菌科等为主要固氮类群。土壤总氮、速效氮和有机质等显著影响固氮微生物的群落组成。柠条根际土壤中可培养固氮菌多样性十分丰富,对于荒漠生态系统的保护和恢复具有重要意义。

