石榴花发育相关基因PgSPL2的克隆及功能研究
甘诚燕 张心慧 王沙 樊瑶羽薇 招雪晴 苑兆和
(南京林业大学林学院 南方现代林业协同创新中心,南京 210037)
SQUAMOSA 启动子结合类蛋白(SQUAMOSA promoter binding protein-like,SPL)是一类特异存在于植物中的转录因子,在植物生长发育中起重要作用[1]。该蛋白含有76 个氨基酸组成的SBP 结构域,包含2 个锌指结构和1 个核定位信号[2],能够识别并结合SQUAMOSA 启动子,参与花发育的调控,能参与调控植物的开花时间、成花转变、花序及花柄的发育以及花器官发育等生物学过程[3]。
SPL 是多基因家族,在多种植物中被分离鉴定,AtSPL3、AtSPL2、AtSPL10、AtSPL11可激活花分生组织特异基因LFY、FRUITFULL(FUL)和APETALA1(AP1)的表达[4],促进花诱导或花分生组织同一性[5],调控开花时间和成花转化。如异源转化葡萄VvSBP11,促使拟南芥提早开花,表明VvSBP11可促进葡萄从营养生长向生殖生长转变[6];与拟南芥类似,当沉默金鱼草AmSBP1会延迟开花时间[7];在烟草中过量表达NtSPL3可以促进烟草早开花[8]。
石榴(Punica granatumL.) 是千屈菜科(Lythraceae)石榴属(Punica)的落叶小乔木[9],栽培范围广泛,是集生态、经济价值于一体的优良树种[10]。随着国家乡村振兴策略发展,石榴产业欣欣向荣,成为脱贫攻坚、特色小镇建设等的良好选择,因此,近年来我国石榴发展面积不断壮大。根据花器官构造的不同,Wetzstein 等[11]将石榴花分为两性花(完全花)和功能性雄花(不完全花)两种类型,完全花雌蕊正常发育,最后形成果实;不完全花不能受精结实,最后脱落[12]。石榴在生长发育过程中花期长、花量大,但因雌蕊败育、落果现象严重,自然坐果率低。研究发现影响石榴产量的因素主要是冬春季的冻害和花期连阴雨[13],仲春是石榴第三批花芽分化的高峰期[14],寒冷天气会使花芽内部组织发育不正常,影响花芽分化[15],对于已经开放的花,轻者花瓣、花药、花丝和雌蕊会变褐变黑,重者则子房变褐[16],严重影响石榴花的生长发育。且石榴花期正值春夏之交,大多年份都会出现10 d 左右的连阴雨,花粉容易受到雨水冲刷,加上光照不足,营养物质积累不足,花芽分化质量差,授粉不良[17],导致其经济效益得不到提高,影响生产发展。因此,通过喷施生长调节剂延迟花期避开自然灾害的措施,对石榴花发育的影响具有重要意义[18]。
前人研究已证实SPL 转录因子在调控开花时间和成花转变中有重要作用,但在石榴花发育中是否有作用还未被阐明。
本研究以‘突尼斯’软籽石榴为试材,采用同源克隆基因技术从石榴叶片、籽粒、花和果皮的混合样品中分离出PgSPL2,并对其进行生物信息学分析,通过过表达拟南芥验证PgSPL2对花发育的影响,对石榴花进行不同生长调节剂喷施处理后分析该基因的表达特性以探究,为进一步研究石榴花发育的机制奠定基础。
1 材料与方法
1.1 材料
供试验材料为种植于江苏省南京市六合区虎岗石榴园的‘突尼斯’软籽石榴。选择树势一致,生长状态良好的石榴树作为试验标准株。选取多效唑(PP333)、6-苄氨基嘌呤(6-BA)和吲哚丁酸(IBA)3 种植物生长调节剂以及清水作为对照组(CK)进行喷施至叶面滴水,每个处理喷施9 株,3 株用于采样,3 株用于统计。处理时保证各处理植株间的相对距离,以尽量排除相互之间的影响。分别于2021年4月20日(春季展叶期)、5月15日(始花期至盛花期)、5月30日(盛花期末)进行单株处理,自5月10日起每7 d 采集不同发育阶段的完全花与不完全花,参照陈利娜[19]对石榴花形态及胚胎学差异的研究,按照花蕾纵径的大小分为3 个阶段(图1),P1:花蕾纵径3.0-5.0 mm;P2:花蕾纵径5.1-13.0 mm;P3:花蕾纵径13.1-25.0 mm,以及完全花相对应的时期,以清水组(CK)为对照,液氮处理后-80℃保存备用。
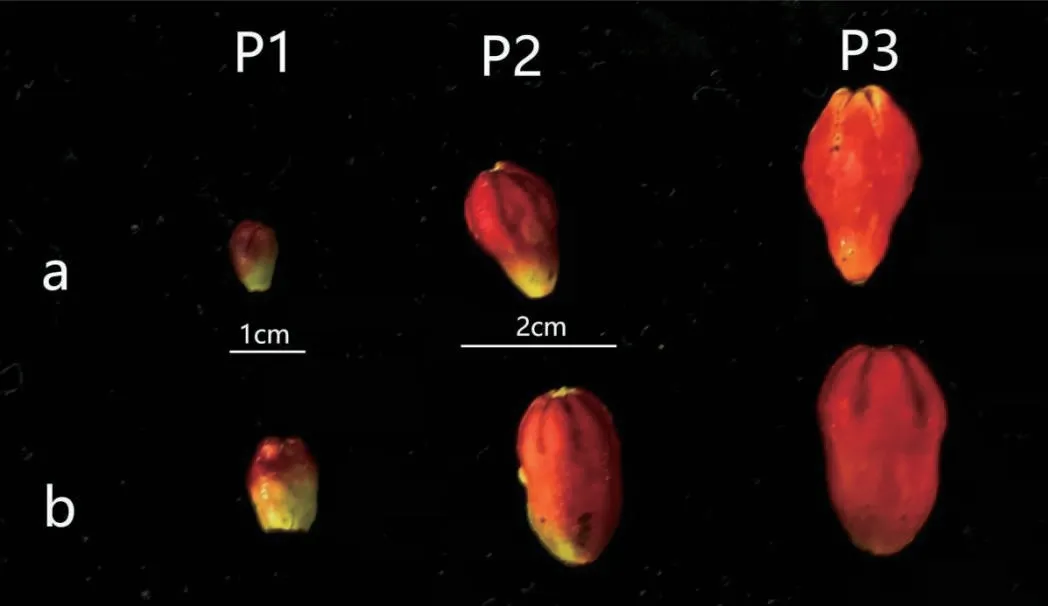
图1 石榴不同发育阶段的不完全花(a)与完全花(b)Fig.1 Incomplete(a)and complete(b)flowers at different developmental stages of pomegranate(Punica granatum L.)
1.2 方法
1.2.1 生物信息学分析 使用FGENESH 在线工具(http://www.softberry.com/)预测PgSPL2的基因结构与氨基酸序列。使用在线工具ProtParam(https://web.expasy.org/protparam/)分析序列基本特性。利用在线工具Plant-mPLoc(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)预测其亚细胞定位。利用Pfam 网站(http://Pfam.sanger.ac.uk/)分析其保守结构域。使用在线工具PlantTFDB(http://planttfdb.gao-lab.org/)下载石榴、拟南芥、葡萄、番茄的基因组序列与gff 文件,使用TBtools 软件将其翻译为蛋白序列;使用Pfam 数据库在线工具(http://pfam.xfam.org/)下载SBP(PF03110)保守结构域隐马可夫模型文件(SBP.hmm)。基于SBP.hmm 文件,利用HMMER3.0 软件分别在石榴、拟南芥、葡萄和番茄的蛋白质序列文件中搜索包含SBP 结构域的成员;运用MEGA7.0 软件对序列进行进化分析并采用最大似然法(maximum likelihood,ML)构建系统进化发育树,参数设置:Bootstrap method 1 000,其余采用默认值;利用Fig tree 软件美化系统发育树;使用DNAMAN 和WebLogo 分别对氨基酸序列进行多序列比对和可视化。
1.2.2 石榴PgSPL2的克隆 利用总RNA 提取试剂盒提取石榴叶片、籽粒、花和果皮的混合样品中的总RNA,并合成cDNA 第一链,采用Oligo 7.0 软件设计PgSPL2引物(表1)。使用高保真酶扩增目的基因,1%琼脂糖凝胶电泳检测,回收并送至上海生工测序,获得石榴PgSPL2的CDS 序列,利用ExPaSy-Translate 在线工具(https://web.expasy.org/translate/)将其翻译为氨基酸序列。
1.2.3 生长调节剂对石榴完全花成花率及花期的影响 采用人工统计方法,挂牌编号标记的处理植株,记录花期;于石榴盛花期记录单株开花数和完全花数,计算完全花比率:
完全花成花率(%)=完全花数/单株开花数×100%。
1.2.4 石榴PgSPL2在不同组织中及不同处理条件下的表达分析 依据克隆的PgSPL2核酸序列,设计实时荧光定量PCR 引物,并以石榴PgAction为内参(表1)。采用实时荧光定量PCR(RT-qPCR)检测不同生长调节剂处理下石榴完全花、不完全花在不同时期PgSPL2的表达量,以P1 阶段的表达量为标准;以未处理的石榴新叶、花蕾、嫩茎、果肉的cDNA 为模板,利用RT-qPCR 检测PgSPL2在石榴不同组织中的表达模式,荧光染料为The BioEasy Master Mix Plus(SYBR Green),反应程序为95℃ 3 min;95℃ 30 s;60℃ 15 s;72℃ 20 s,40 个循环。3 次生物学重复,使用2-ΔΔCt法进行数据分析。
1.2.5 农杆菌介导的拟南芥转化 构建带有GUS 标签的pBI121-GUS-PgSPL2表达载体(表1),转入农杆菌GV3101,按1∶100 的比例将活化后的农杆菌接种于50 mL 的LB 液体培养基中,28℃ 210 r/min振荡培养16 h,然后4 000 r/min 离心10 min,收菌,采用渗透液(0.05% sliwet77+5%蔗糖+1/2 MS 培养基)重悬菌体后,沾花法转化拟南芥。侵染后的拟南芥植株用保鲜袋罩住,每隔一周侵染1 次,共3 次,待收获时,收集成熟的拟南芥种子。将第一次侵染后收获的拟南芥种子消毒后种在1/2 MS 固体培养基上,当第一对真叶展开且生根后进行移栽(泥炭土∶蛭石∶珍珠岩=3∶2∶1),置于培养箱中培养鉴定,待T1拟南芥植株成熟后进行DNA 鉴定,重复上述步骤,选取T2幼苗种植2-3 周后选择成活的拟南芥幼苗观察表型,采集T2种子培养基筛选后选取部分幼苗进行GUS 染色,待植株成熟后采集野生型与T3转基因拟南芥的花序与叶片提取RNA、反转录,进行RT-qPCR 荧光定量分析。

表1 基因克隆、功能验证以及特异性表达分析引物表Table 1 Primers for the gene cloning,functional verification and specific expressions
2 结果
2.1 石榴PgSPL2生物信息学分析
对PgSPL2进行理化特性分析,编码产物分子式为C915H1486N308O301S10,分子量为21 938.35 kD,脂溶指数为44.85,总平均亲水指数为-1.176,理论等电点(pI)为9.16,不稳定系数为70.9。PlantmPLoc 预测其定位于细胞核上。Pfam 数据库检索发现该蛋白具有SBP 保守结构域。系统进化树结果(图2)显示,石榴PgSPL2 与拟南芥AtSPL3、AtSPL4、AtSPL5 聚在同一分支上,表明其亲缘关系较近。将与PgSPL2 同一分支的蛋白进行多重比对,结果显示(图3),PgSPL2 具有高度保守的SBP 结构域,该结构域由76 个氨基酸构成,包含2 个锌指结构Cys-Cys-Cys-His(C3H)、Cys-Cys-His-Cys(C2HC)和1 个核定位信号(NLS)。

图2 石榴、拟南芥、番茄和葡萄SPL 系统进化分析Fig.2 Phylogenetic analysis of SPL proteins in Pomegranate,Arabidopsis,Solanum lycopersicum and Vitis vinifera

图3 蛋白多重序列比对Fig.3 Multiple sequence alignment of protein
2.2 石榴PgSPL2的克隆
提取石榴叶片、籽粒、花和果皮混样组织中的总RNA,反转录成cDNA,使用PgSPL2的特异引物(表1)进行扩增,获得与预期目标片段一致的单一条带(图4)。测序获得PgSPL2的编码区序列,长度为591 bp,编码196 个氨基酸,该基因含有完整的SBP 保守结构域(图5)。

图4 石榴PgSPL2 的PCR 扩增Fig.4 PCR amplification of PgSPL2 in pomegranate
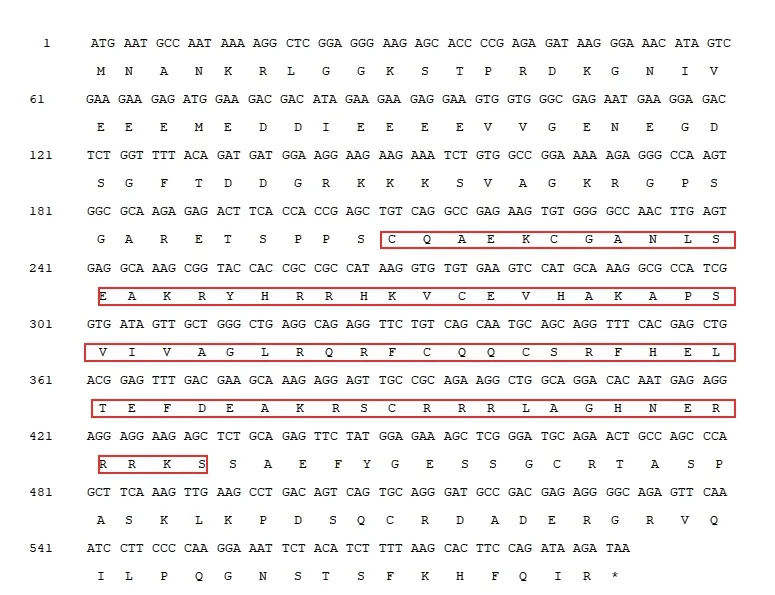
图5 PgSPL2 的CDS 序列及其编码氨基酸序列Fig.5 CDS sequence and deduced amino acid sequence of PgSPL2 gene
2.3 生长调节剂对石榴完全花成花率及花期的影响
分析不同生长调节剂对石榴花期的影响(表2),结果显示,喷施生长调节剂后初花期延迟3-5 d,盛花期延迟2-4 d,花末期提前3-5 d。

表2 生长调节剂对石榴花期的影响Table 2 Effects of growth regulators on pomegranate flower stage
分析不同生长调节剂对石榴完全花成花率的影响(表3),结果显示,喷施生长调节剂后能显著增加石榴完全花比率。与CK 相比,喷施PP333 后,完全花成花率增加了7.53%;喷施6-BA 后,完全花成花率增加了4.79%;喷施IBA 后,完全花成花率增加了4.40%。

表3 生长调节剂对石榴完全花成花率的影响Table 3 Effects of growth regulators on complete flowering rate of pomegranate
2.4 石榴不同组织中及不同处理后PgSPL2的表达分析
采集石榴不同组织进行qPCR 检测(图6-A),发现PgSPL2在各个组织中均有表达,在果肉中表达量最高,其次是花蕾,在叶片和嫩茎中表达量最低。
PP333 处理后,与对照CK 相比,不完全花中PgSPL2在P2、P3 阶段均上调,完全花中PgSPL2表达量均显著下调(图6-B);6-BA 处理后,不完全花中PgSPL2在P2、P3 阶段表达量差异不大,完全花中,PgSPL2在P2 阶段表达量显著上调,P3 阶段表达量显著下调(图6-C);IBA 处理后,不完全花中PgSPL2在P2、P3 阶段均有所上调,完全花中PgSPL2表达量均显著下调(图6-D)。
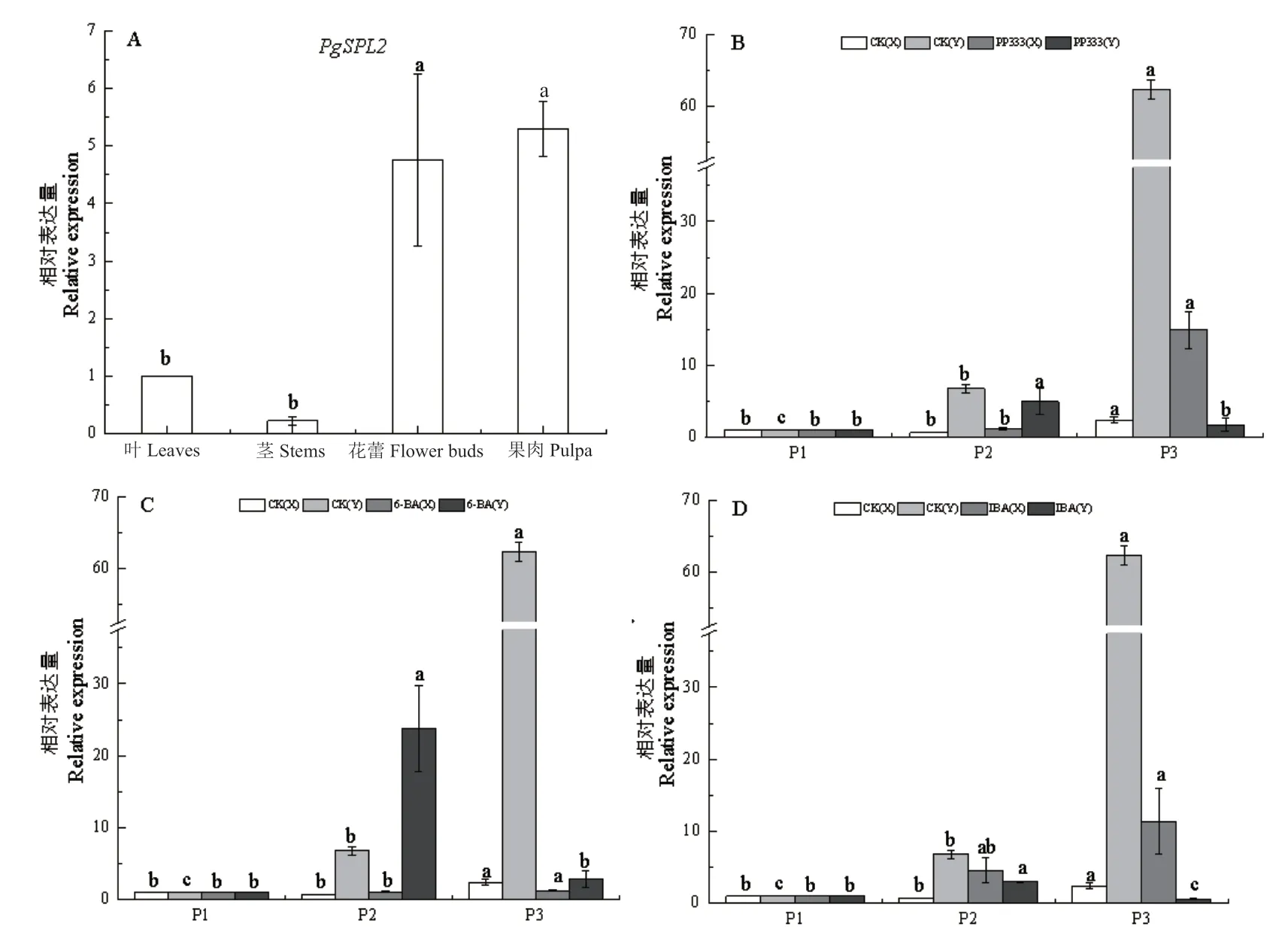
图6 PgSPL2 在石榴不同组织及不同处理后不同发育阶段的相对表达量Fig.6 Relative expressions of PgSPL2 gene in different tissues of pomegranate and at different developmental stages after different treatments
2.5 转基因拟南芥的鉴定
将T0转基因拟南芥种子种植在含卡那霉素的培养基中,能够正常生根和展出真叶,初步筛出转基因植株(图7-A)。移栽,待植株成熟后,分别提取T1转基因植株DNA 进行检测,得到与预期结果一致的目的片段(图7-B),鉴定为阳性单株。继续重复上述步骤,筛选出T2植株(图7-C),开花期选择长势一致的野生型对照及转基因植株(图7-D)进行观察,与野生型植株相比,发现过量表达PgSPL2拟南芥植株莲座数、叶片数和茎粗明显较弱,并出现早花现象。收集T2转基因拟南芥种子,种植后,进行GUS 染色拍照(图7-E),发现转基因拟南芥的根和茎上均出现蓝色。为了进一步增强基因转化在花中的遗传稳定性,获得转基因纯合株系,继续筛选下一代,采取T3转基因拟南芥花序进行GUS 染色拍照(图7-F),发现PgSPL2转基因拟南芥的花瓣和雄蕊上均出现蓝色。

图7 PgSPL2 转基因植株的检测与表型Fig.7 Detection and performance observation of the PgSPL2 transgenic plants
为进一步研究PgSPL2对花发育的作用,通过RT-qPCR 分析PgSPL2与其下游相关基因AtFUL、AtLFY及AtSOC1之间的关系。结果(图8)表明,过表达转基因植株中,PgSPL2的表达量在花序、叶中均显著高于野生型(图8-A),其下游基因AtFUL、AtLFY及AtSOC1在花序、叶中的表达量均显著高于野生型。

图8 PgSPL2 转基因植株与下游相关基因的表达量Fig.8 PgSPL2 transgenic plants and downstream associated gene expressions
3 讨论
在植物生长发育过程中,越来越多的SPL 转录因子被挖掘,其在开花时间调控过程中是一个重要的枢纽,SPL 通过激活下游花分生特异组织LFY、FUL和AP1,促进开花诱导,促进植物营养生长向生殖生长过程的转变[20]。本研究从石榴中分离出一个与花发育相关的SPL 基因PgSPL2。生物信息学分析表明,PgSPL2 编码196 个氨基酸,亚细胞定位在细胞核,含有2 个锌指结构和1 个核定位信号的SBP 高度保守结构域,第二个锌指结构和核定位信号有部分重叠区域,可以引导SBP-box进入细胞核调控下游基因的转录表达[21]。系统发育树表明,PgSPL2和拟南芥AtSPL3、AtSPL4、AtSPL5聚成一簇,AtSPL3/AtSPL4/AtSPL5在拟南芥幼年期向成年期的转变中起重要作用,能促进花分生组织特异基因的表达,促使拟南芥提前开花[22],暗示着PgSPL2与其同源基因可能具有相似的功能。
通过组织特异表达分析发现,PgSPL2在石榴不同组织均有表达,且在花和果肉中表达量远高于叶片与嫩茎,说明其在花果发育中可能起到非常重要的作用[23]。为了进一步说明PgSPL2在成花过程中的作用,本研究分析了石榴不完全花、完全花在不同发育阶段PgSPL2的表达情况,并用生长调节剂PP333[24]、6-BA[25]、IBA[26]进行处理。结果表明,与对照相比,石榴初花期、盛花期均有所推迟且完全花比率提高;喷施生长调节剂后,不完全花中PgSPL2含量高于完全花中的含量。这可能是因为作为拟南芥AtSPL3/AtSPL4/AtSPL5的同源基因,PgSPL2可能同样具有促进早花这一作用,石榴花芽分化时营养物质积累不足,不能及时供给花芽分化[27],因此,不完全花中该基因表达量较高;当喷施生长调剂后石榴花期延迟,有利于营养物质积累,提供给花的生长发育,促进雌花的形成[28],PgSPL2表达量在完全花生长后期降低,完全花比率显著提高。各处理完全花各时期PgSPL2表达量都有所降低,除了6-BA 处理下,PgSPL2在完全花败育关键期含量高于不完全花,这可能由于PgSPL2功能冗余,也可能因为SPL 基因家族成员较多,有其他基因进一步参与调节6-BA 信号来响应花器官发育。
通过沾花法转化PgSPL2拟南芥植株出现早花现象,表明PgSPL2可能起着调节开花时间的作用。GUS 染色转基因拟南芥幼苗后,在其茎和叶上出现不同程度及范围的蓝色,转基因拟南芥长大后,采集花序进行GUS 染色,在其花序及雄蕊上出现不同程度及范围的蓝色,表明PgSPL2在茎、叶和花上具有活性。通过RT-qPCR 分析发现,转基因PgSPL2拟南芥后其花序、叶中基因表达量显著高于野生型拟南芥,下游相关基因AtFUL、AtLFY及AtSOC1表达量都显著提高,这可能是因为PgSPL2与拟南芥AtSPL3/AtSPL4/AtSPL5是同源基因,LFY是AtSPL3的直接下游靶基因,过量表达AtSPL3可以显著提高LFY的表达水平,AtSPL3/AtSPL4/AtSPL5会识别下游的花分生组织关键基因AtAP1、AtFUL、AtLFY启动子区,调控这些基因的表达,从而促进拟南芥开花[29]。因此,在石榴生产中可通过喷施生长调剂或其他措施,降低PgSPL2的表达量,延迟花期,使花期避过春季倒春寒和连阴雨,使花芽正常分化,提高石榴的经济效益。
4 结论
从‘突尼斯’软籽石榴中克隆得到了PgSPL2基因,其具有高度保守的SBP 结构域。该基因转化拟南芥后发现其花序下游调控基因表达量显著提高,使拟南芥提前开花。生长调节剂喷施处理石榴后,花期延迟,花组织中PgSPL2基因表达量显著下调,因此该基因在石榴中参与开花时间的调控。

