共价有机框架材料TpBD-(NH2)2-D-(-)-α-苯甘氨酸用作高效液相色谱手性固定相的研究
赖亚琳,禹紫云,秦该照,袁黎明
(云南师范大学 化学化工学院,云南 昆明 650500)
高效液相色谱法(HPLC)是在经典色谱法的基础上发展而来的分离分析方法,具有柱效性高、灵敏度高、选择性多、解析速度快、使用范围广等优点[1-3],能够用于分析分离大部分有机物,在定性定量分析的众多领域中被广泛应用。手性固定相(CSP)能够提供手性识别位点,对不同的对映体表现出立体定向的相互作用,直接影响手性识别和分离的效果,在HPLC手性分离中,CSP的选择具有至关重要的作用[4]。共价有机框架材料(COFs)是一类由C、N、H等简单原子构成,具有高度共价孔隙率和周期性的二维或三维有机多孔聚合物[5-7]。与其他聚合物不同,COFs的显著特征是其结构可预先设计且长程有序,并具有比表面积大、超低密度、孔道均一可调、结构易于调控和化学稳定性高等特点[8-10]。
手性是自然界的基本属性之一,也广泛存在于化学领域。手性化合物的对映异构体具有不同的生化和药理活性,在进入生命体后,一种对映体能够显示出活性,而另一种对映体往往活性较低甚至会产生生理毒性从而危害生命健康。因此,有关手性的检测和分离成为人类生命健康的重要课题。随着手性科学的不断发展,手性共价有机框架化合物(CCOFs)材料由于其优异的性质得到了研究人员的广泛关注,也使其在手性识别[11]、手性分离[12]、生物医学[13]和不对称催化[14]等领域得以迅速发展。然而,在CCOFs的合成过程中仍然存在一个主要挑战:平衡手性单体的不对称性和材料结晶度。因此,精确控制手性、功能性和结晶性是一项关键任务[15]。2018年,崔勇课题组[16]首次将CCOFs材料CCOF-6用于HPLC,实现了1-苯基-1-戊醇、1-苯基-1-丙醇、1-苯基-2-丙醇、1-(4-溴苯)-乙醇的基线分离。2022年,本课题组与崔勇课题组[17]合作将CCOFs材料CCOF-17和CCOF-18用于HPLC和气相色谱(GC),证明两种CCOFs材料在温和及苛刻的色谱条件下均能分离大量外消旋分子和药物,且手性柱的选择性和耐用性与相关的商用手性柱相当,通用性优于相关的商用手性柱,是一种极具潜力的新型手性柱。由此可见,CCOFs材料在手性分离领域具有广阔前景。
本文采用溶剂热法合成了非手性COFs(TpBD-(NO2)2),再将TpBD-(NO2)2还原为TpBD-(NH2)2,然后用D-(-)-α-苯甘氨酸对其进行手性修饰,最终得到了具有高孔隙率和结晶度以及热稳定性高的CCOFs材料TpBD-(NH2)2-D-(-)-α-苯甘氨酸。对上述3种COFs材料进行表征,采用“网包法”制备TpBD-(NH2)2-D-(-)-α-苯甘氨酸手性固定相,用于高效液相色谱柱的制备,并采用TpBD-(NH2)2-D-(-)-α-苯甘氨酸色谱柱成功拆分了13种手性化合物和5种苯系位置异构体,且该色谱柱具有良好的重现性。以上结果表明CCOFs材料作为固定相在高效液相色谱领域具有广阔的发展前景。
1 实验部分
1.1 试剂与仪器
手性化合物(99%)购于美国Sigma-Aldrich有限公司;苯系位置异构体、六亚甲基四胺(99.5%)、无水间苯三酚(99%)、三氟乙酸(TFA,99.5%)、1,4-二氧六环(99%)、无水氯化亚锡(98%)、苯甲醚(99%)、1,3,5-苯三甲酰氯(98%)均购于阿拉丁试剂(上海)有限公司;四氢呋喃(THF,99%)、甲醇(99.5%)均购于成都科隆化学品有限公司;无水硫酸钠(99%)、乙酸(99.5%)、二氯甲烷(DCM,99.5%)、异丙醇(99.7%)、正己烷(98%)均购于天津市风船化学试剂科技有限公司;丙酮(99.5%)、盐酸(HCl,36.0%~38.0%)均购于云南杨林工业开发区汕滇药业有限公司;1,3,5-三甲苯(99%)、三吡咯烷基溴化鏻六氟磷酸盐(PyBrOP,98%)、哌嗪(99%)均购于Adamas试剂有限公司;D-(-)-α-苯甘氨酸(99%)、3,3′-二硝基对二氨基联苯(DNB,96%)均购于北京伊诺凯科技有限公司;4-二甲氨基吡啶(DMAP,99%)购于美仑生物。
采用配有EC 2006型色谱工作站的230Ⅱ高效液相色谱仪(大连依利特分析仪器有限公司)进行色谱分离实验;高压匀浆装柱机(深圳市正大流体机电设备有限公司);SHZ-D(Ⅲ)循环水式真空泵(巩义市予华有限责任公司);利用D-max-3B X射线粉末衍射仪(PXRD,日本Rigaku公司)、Nicolet iS 10傅里叶红外光谱仪(FT-IR,美国赛默飞世尔科技公司)、AVANCEIIIHD 400核磁共振波谱仪(德国Bruker公司)、Nova NanoSEM 450扫描电子显微镜(SEM,美国FEI公司)、Chirascan圆二色谱仪(CD,英国Applied Photophysics公司)对合成材料进行表征。
1.2 1,3,5-三甲醛间苯三酚(Tp)的制备
根据文献合成Tp[18]。分别称取6.014 g(49 mmol)无水间苯三酚(C6H6O3)、15.098 g(108 mmol)六亚甲基四胺(C6H12N4),将两者充分混匀后加入到500 mL的三颈圆底烧瓶中,在N2保护下加入90 mL TFA,于100℃下回流加热反应3.5 h,直至溶液由黄色变为红褐色;随后加入150 mL(0.3 mol/L)HCl反应3 h,用适量DCM进行少量多次萃取,加入适量无水Na2SO4除水,旋干;最后用适量甲醇多次洗涤,干燥后得到粉红色粉末产品。
1.3 TpBD-(NO2)2的制备
根据 文 献[19]合成TpBD-(NO2)2。分别 称取31.5 mg(0.3 mmol)Tp、61.7 mg(0.45 mmol)DNB、0.25 mL 1,3,5-三甲苯、0.25 mL 1,4-二氧六环和0.25 mL(3 mol/L)的乙酸水溶液于耐热玻璃管中,混合超声处理30 min后,将耐热玻璃管在77 K液态N2浴中迅速冷冻,并连续3次通过冷冻-泵-解冻循环脱气,将耐热玻璃管密封,随后将其在120℃温度条件下加热3 d。将得到的混合物过滤,收集得到暗红色沉淀,以适量的丙酮、THF、DCM依次洗涤3次后,于180℃下真空干燥12 h,获得TpBD-(NO2)2。
1.4 TpBD-(NO2)2还原为TpBD-(NH2)2
实验前先将THF溶液除水。根据文献[20]将称取的2.52 g无水氯化亚锡置于5 mL THF中使其充分溶解,随后加入150 mg TpBD-(NO2)2,并将三者的混合物于50℃下回流加热搅拌3 h。反应期间配制1 mol/L的HCl溶液备用,待反应结束后将得到的产物离心并悬浮在10 mL配制好的HCl中。依次用70 mL HCl洗涤10次,一定量的去离子水洗涤3次,100 mL丙酮洗涤1次。将得到的红棕色粉末重新悬浮于5 mL苯甲醚中后将其置于25 mL三颈圆底烧瓶中,将悬浮液在120℃下加热24 h。最后,用100 mL丙酮洗涤、过滤,得到产物TpBD-(NH2)2。
1.5 TpBD-(NH2)2-D-(-)-α-苯甘氨酸的制备
实验前先将DCM除水。再分别称取91 mgD-(-)-α-苯甘氨酸、300 mg PyBrOP,并量取5 mL DCM,将三者混合超声2 min,混合均匀后在室温下反应约2 h,再加入50 mg TpBD-(NH2)2和156 mg DMAP反应4 d。将得到的产物用100 mL水离心,洗去多余的D-(-)-α-苯甘氨酸后得到TpBD-(NH2)2-D-(-)-α-苯甘氨酸手性产物。其合成路线如图1所示。

图1 TpBD-(NH2)2-D-(-)-α-苯甘氨酸的合成路线图Fig.1 TpBD-(NH2)2-D-(-)-α-phenylglycine synthesis roadmap
1.6 “网包法”制备高效液相色谱TpBD-(NH2)2-D-(-)-α-苯甘氨酸固定相[21]
由于合成的TpBD-(NH2)2-D-(-)-α-苯甘氨酸的粒径过大且不均匀,不适合直接用来制备填充柱。故先将TpBD-(NH2)2-D-(-)-α-苯甘氨酸粉末置于研钵中研磨14 d左右,再借助溶剂使其悬浮获得较为合适的粒径。实验前备好除过水的三乙胺、正己烷、异丙醇3种溶液,称取4.0 g硅胶并浸入含有100 mg TpBD-(NH2)2-D-(-)-α-苯甘氨酸的50 mL(0.05 mol/L)1,3,5-苯三甲酰氯的正己烷溶液中,将混合物搅拌30 min,再除去过量的正己烷溶液。5 min后,将50 mL(0.46 mol/L)哌嗪的异丙醇水溶液(滴加2 mL无水三乙胺)轻轻倒在硅胶上,静置30 min后排出水溶液,再将其置于110℃烘箱中热处理15 min,得到TpBD-(NH2)2-D-(-)-α-苯甘氨酸固定相。
1.7 TpBD-(NH2)2-D-(-)-α-苯甘氨酸液相色谱柱的制备
准确称取4.0 g已过筛(250目)的TpBD-(NH2)2-D-(-)-α-苯甘氨酸于50 mL烧杯中,将其分散于40 mL正己烷-异丙醇(体积比9∶1)的混合液中,待悬浮均匀后快速倒入匀浆罐中,且以正己烷-异丙醇(体积比9∶1)混合液为顶替液,在35 MPa压力下将悬浮液填充至一个空的色谱柱(250 mm×4.6 mm)中保持5 min,然后将压力调至25 MPa,保持30 min,缓慢减至常压后将其取下,得到TpBD-(NH2)2-D-(-)-α-苯甘氨酸液相色谱柱。
2 结果与讨论
2.1 TpBD-(NO2)2、TpBD-(NH2)2及TpBD-(NH2)2-D-(-)-α-苯甘氨酸的表征
采用核磁共振氢谱(1H NMR)对合成的单体Tp进行表征:1H NMR(500 MHz,CDCl3):10.18(s,3H),14.15(s,3H)。
由图2A可知,TpBD-(NO2)2在3.5°和26°处显示出主要衍射峰,分别对应于(100)面和(001)面,该结果与AA堆叠排列的理论预测一致[11]。对比TpBD-(NO2)2、TpBD-(NH2)2以及衍生后所得的TpBD-(NH2)2-D-(-)-α-苯甘氨酸3个COFs材料的XRD图发现,经D-(-)-α-苯甘氨酸衍生后,CCOFs的衍射峰强度略有减弱(图2A曲线c),原因可能是修饰上去的D-(-)-α-苯甘氨酸手性基团对该多孔材料产生了影响。

图2 TpBD-(NO2)2(a)、TpBD-(NH2)2(b)及TpBD-(NH2)2-D-(-)-α-苯甘氨酸(c)的XRD图(A)和FT-IR图(B)Fig.2 XRD patterns(A)and FT-IR spectra(B)of TpBD-(NO2)2(a),TpBD-(NH2)2(b)and TpBD-(NH2)2-D-(-)-α-phenylglycine(c)
考察了TpBD-(NO2)2、TpBD-(NH2)2以及TpBD-(NH2)2-D-(-)-α-苯甘氨酸的FT-IR图谱。可以明显看出TpBD(NO2)2还原为TpBD-(NH2)2后,其硝基(—NO2)在1 511 cm-1处的特征伸缩振动吸收峰减弱,并在1 295 cm-1处出现了对应于伯胺的C—N伸缩振动吸收峰,证明硝基已被成功还原为氨基。通过图2B曲线c可知,经D-(-)-α-苯甘氨酸手性修饰后的COFs在770 cm-1处的苯环伸缩振动吸收峰显著增强,表明TpBD-(NH2)2-D-(-)-α-苯甘氨酸成功合成。
考察了TpBD-(NH2)2-D-(-)-α-苯甘氨酸的热稳定性,将其从25℃匀速升温至800℃,所得热重曲线见图3。从图3中可以看出,该材料在约300℃时方开始大量分解,说明TpBD-(NH2)2-D-(-)-α-苯甘氨酸的热稳定性较好。
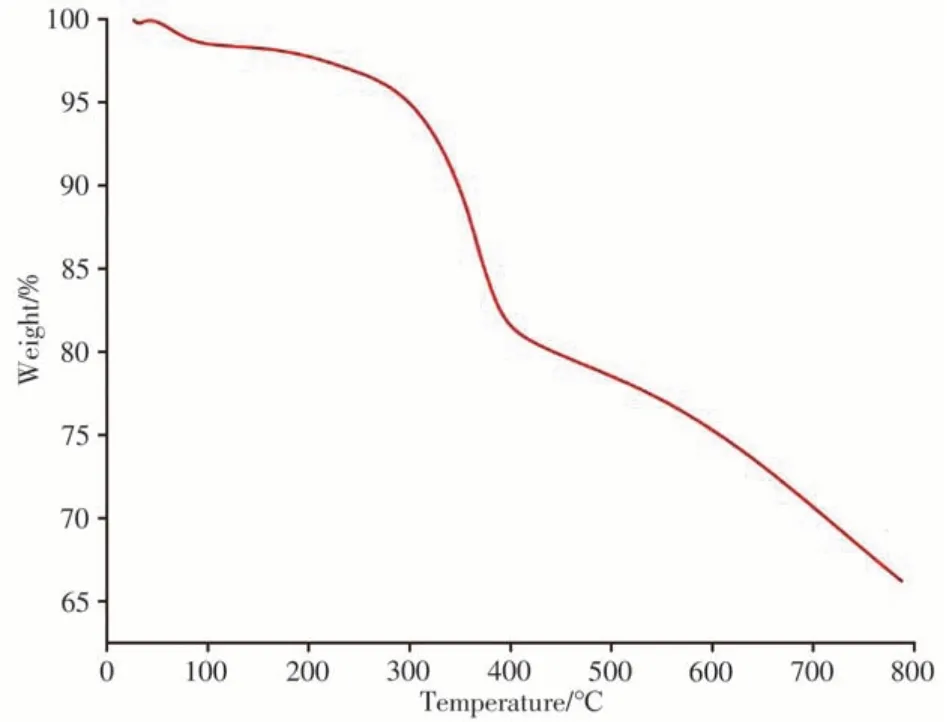
图3 TpBD-(NH2)2-D-(-)-α-苯甘氨酸的热重曲线图Fig.3 Thermogravimetric curve of TpBD-(NH2)2-D-(-)-αphenylglycine
由图4可知,TpBD-(NH2)2-D-(-)-α-苯甘氨酸具有明显的科顿(Cotton)效应,说明该物质具有手性。

图4 TpBD-(NH2)2-D-(-)-α-苯甘氨酸的CD图Fig.4 CD diagram of TpBD-(NH2)2-D-(-)-α-phenylglycine
此外,通过观察硅胶和“网包法”制备的TpBD-(NH2)2-D-(-)-α-苯甘氨酸固定相的SEM图(图5),发现TpBD-(NH2)2-D-(-)-α-苯甘氨酸包裹在硅胶表面,表明TpBD-(NH2)2-D-(-)-α-苯甘氨酸材料通过“网包法”成功固载在硅胶表面。

图5 硅胶(A)和“网包法”制备的TpBD-(NH2)2-D-(-)-α-苯甘氨酸固定相(B)的SEM图Fig.5 SEM images of silica gel(A)and TpBD-(NH2)2-D-(-)-α-phenylglycine stationary phase prepared by“net-wrap”method(B)
为了测试TpBD-(NH2)2-D-(-)-α-苯甘氨酸的孔径和比表面积大小,对其进行氮气吸附测试(图6),得到TpBD-(NH2)2-D-(-)-α-苯甘氨酸的比表面积为270 m2/g,孔体积为1.423 cm3/g;通过BJH分析得到该材料的孔径大小为1.88 nm。

图6 TpBD-(NH2)2-D-(-)-α-苯甘氨酸的N2吸附-解吸附等温曲线(A)及BJH孔尺寸分布曲线(B)Fig.6 N2 adsorption-desorption isothermal curve(A)and BJH hole size distribution(B)of TpBD-(NH2)2-D-(-)-α-phenylglycine
2.2 TpBD-(NH2)2-D-(-)-α-苯甘氨酸色谱柱拆分手性化合物
为了检测TpBD-(NH2)2-D-(-)-α-苯甘氨酸色谱柱对手性化合物的拆分性能。首先以正己烷-异丙醇(体积比9∶1)为流动相,在流速0.6 mL/min,检测波长230、210 nm,柱温25℃的条件下,用TpBD-(NH2)2-D-(-)-α-苯甘氨酸色谱柱对手性化合物进行拆分,其在检测波长为230 nm时拆分得到1-(9-蒽基)-2,2,2-三氟乙醇、反-1,2-二苯环氧乙烷、1-苯乙醇;在检测波长为210 nm时拆分得到2-戊醇、3-丁炔-2-醇、γ-戊内酯、2-氯丙酸、氧化苯乙烯、2-氯环己酮、异丙基缩水甘油醚。其次,以甲醇-水(体积比9∶1)为流动相,在流速0.6 mL/min,检测波长205 nm,柱温25℃条件下,用TpBD-(NH2)2-D-(-)-α-苯甘氨酸色谱柱对手性化合物进行拆分,得到DL-丝氨酸、DL-苏氨酸、DL-缬氨酸。拆分结果如表1所示。
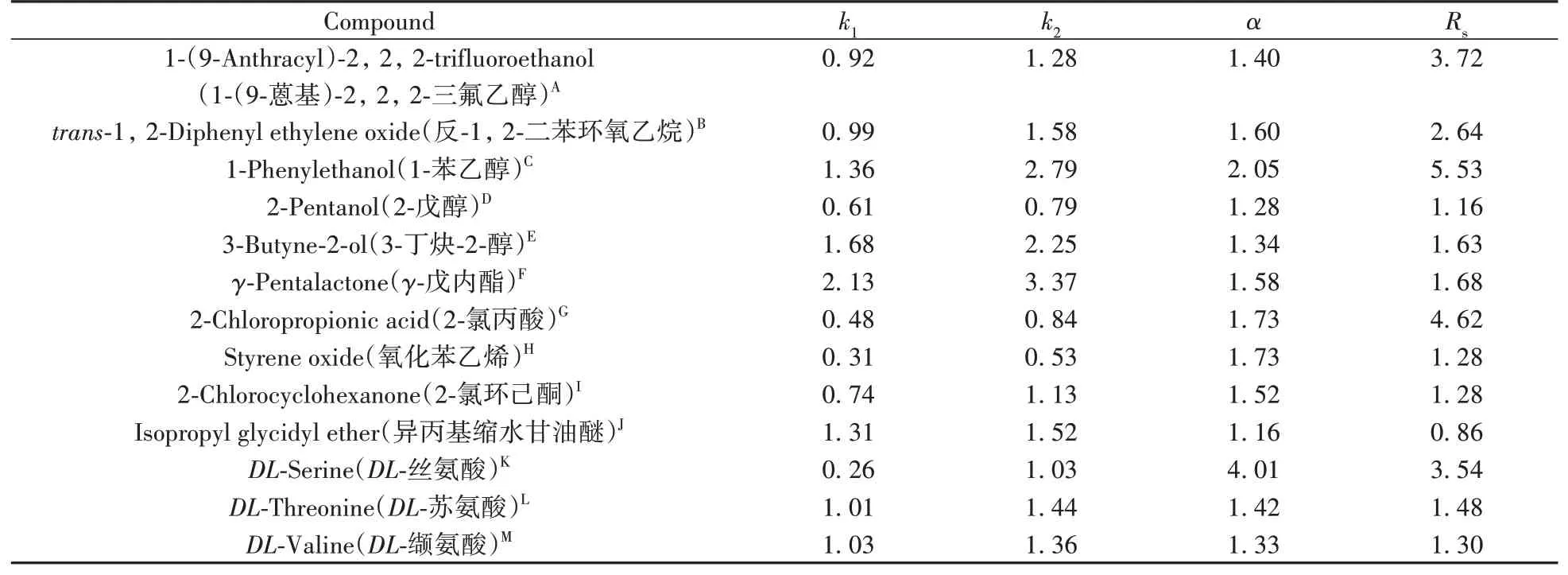
表1 TpBD-(NH2)2-D-(-)-α-苯甘氨酸色谱柱对13种手性化合物的拆分结果Table 1 Separation results of 13 chiral compounds on TpBD-(NH2)2-D-(-)-α-phenylglycine column
从分离结果可以看出,TpBD-(NH2)2-D-(-)-α-苯甘氨酸色谱柱对1-(9-蒽基)-2,2,2-三氟乙醇、反-1,2-二苯环氧乙烷、1-苯乙醇、3-丁炔-2-醇、γ-戊内酯、2-氯丙酸、DL-丝氨酸7种手性化合物达到了基线分离。而2-戊醇、氧化苯乙烯、2-氯环己酮、异丙基缩水甘油醚、DL-苏氨酸、DL-缬氨酸6种手性化合物得到了不同程度的分离。图7为TpBD-(NH2)2-D-(-)-α-苯甘氨酸色谱柱对上述13种手性化合物的拆分谱图。

图7 TpBD-(NH2)2-D-(-)-α-苯甘氨酸色谱柱对13种手性化合物的拆分谱图Fig.7 HPLC chromatograms on TpBD-(NH2)2-D-(-)-α-phenylglycine column for the separation of 13 chiral compounds A-M were the same as those in Table 1
TpBD-(NH2)2-D-(-)-α-苯甘氨酸手性填充柱对手性化合物的拆分能力可能来自COFs材料中规整的手性通道[22]。由于每个COFs分子都是手性的,且有一个可通达的空腔,使得分析物可以进入空腔并进行主客体包合,这在手性分离中起着重要作用。此外,CSP和手性物质之间的其他相互作用力也可能对分离过程产生一定的影响。
2.3 TpBD-(NH2)2-D-(-)-α-苯甘氨酸色谱柱拆分苯系位置异构体
为了检测TpBD-(NH2)2-D-(-)-α-苯甘氨酸色谱柱对苯系位置异构体的拆分性能,以正己烷-异丙醇(体积比9∶1)为流动相,在流速0.6 mL/min,检测波长254 nm,柱温为25℃的条件下,用TpBD-(NH2)2-D-(-)-α-苯甘氨酸色谱柱成功拆分了o,m,p-碘苯胺、o,m,p-氯苯胺、o,m,p-硝基苯酚、o,m,p-溴苯胺、o,m,p-溴硝基苯5种苯系位置异构体。以上各苯系位置异构体的拆分结果见表2,图8为其拆分谱图。

图8 TpBD-(NH2)2-D-(-)-α-苯甘氨酸色谱柱对5种苯系位置异构体的拆分谱图Fig.8 HPLC chromatograms on TpBD-(NH2)2-D-(-)-α-phenylglycine column for the separation of 5 benzene positional isomers
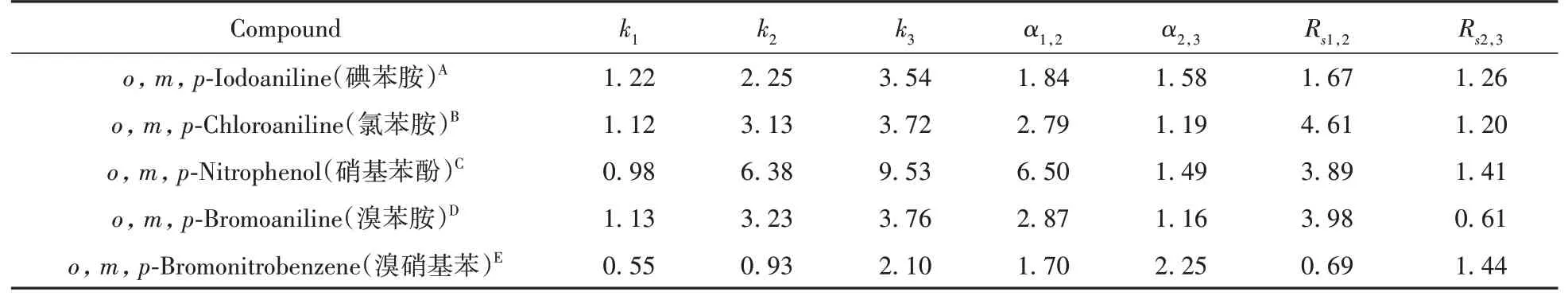
表2 TpBD-(NH2)2-D-(-)-α-苯甘氨酸色谱柱对5种苯系位置异构体的拆分结果Table 2 Separation results of 5 benzene positional isomers on TpBD-(NH2)2-D-(-)-α-phenylglycine column
TpBD-(NH2)2-D-(-)-α-苯甘氨酸色谱柱对苯系位置异构体的拆分,可能是由于诱导力、色散力、偶极之间的相互作用,以及包结作用等的共同作用,而对于某一系列的位置异构体拆分来说,起决定作用的可能是其中的某种作用力。此外,苯系位置异构体由于各个基团所处的位置不同,且邻位、间位和对位分子之间的体积与长宽比也不一样,因此在TpBD-(NH2)2-D-(-)-α-苯甘氨酸固定相上的受力有所差别,导致其在TpBD-(NH2)2-D-(-)-α-苯甘氨酸色谱柱上的保留时间各不相同,从而可得到一定程度的分离。
2.4 TpBD-(NH2)2-D-(-)-α-苯甘氨酸色谱柱的重复性评价
为探究TpBD-(NH2)2-D-(-)-α-苯甘氨酸色谱柱的重复性,以正己烷-异丙醇(体积比9∶1)为流动相,选用2-氯环己酮作为测试物,连续5次进样,其保留时间的相对标准偏差(RSD)为0.53%,峰面积的RSD为1.1%。结果表明TpBD-(NH2)2-D-(-)-α-苯甘氨酸色谱柱具有较好的重复性。
3 结论
本文采用溶剂热法合成了一种热稳定性较高的功能化CCOFs材料—TpBD-(NH2)2-D-(-)-α-苯甘氨酸,并采用“网包法”制备了TpBD-(NH2)2-D-(-)-α-苯甘氨酸手性固定相,将其用于制备HPLC手性柱,并对其手性拆分能力进行了考察。实验结果表明,TpBD-(NH2)2-D-(-)-α-苯甘氨酸色谱柱可拆分13种手性化合物和5种苯系位置异构体,其中对反-1,2-二苯环氧乙烷、1-(9-蒽基)-2,2,2-三氟乙醇、1-苯乙醇、3-丁炔-2-醇、γ-戊内酯、2-氯丙酸、DL-丝氨酸7种手性化合物达到了基线分离。因此,TpBD-(NH2)2-D-(-)-α-苯甘氨酸作为新型CSP具有较大的应用潜力。

