GS1标准UDI在广西应用状况分析及实施
广西壮族自治区标准技术研究院 王浩宇
自2019 年,国家药品监督管理局(以下简称国家药监局)发布《医疗器械唯一标识系统规则》公告以来,医疗器械唯一标识(Unique Device Identifier,以下简称UDI)成为了医疗器械生产企业、医院、患者共同认可的医疗器械产品“身份证”。众所周知,医疗器械产品关乎人们生命健康,不良事件、医疗错误都会给社会带来极其负面的影响。因此,世界各国都在全力推进UDI医疗器械产品管理体系,强化对医疗器械产品的管理与追溯。基于GS1标准的医疗器械唯一标识由产品标识(DI)和生产标识(PI)组成,产品标识是识别注册人∕备案人、医疗器械型号规格和包装的唯一代码,是从国家药监局数据库中检索医疗器械产品的关键字,是医疗器械唯一标识必须的部分;生产标识包含了生产流程中的诸多动态信息,包括生产日期、失效日期、批号、序列号等。正是这些精确的生产标识和产品标识数据,不仅极大地提高了医疗器械企业对产品生产、运输环节的管理效率,也满足了监管部门对医疗器械产品的追溯与监督。如今,基于GS1标准的UDI在美国、中国、欧盟、日本等国家发展迅速,各国都相继推出UDI相关政策。
广西区内医疗器械企业数量虽然不多,但一些规模较大的医疗器械企业在乳胶、医用防护产品的生产上占领了庞大的市场。2019 年以后,广西壮族自治区药品监督管理局开展了医疗器械唯一标识试点工作,通知生产医疗器械的企业向国家药监局数据库备案产品标识DI 信息,并对产品进行UDI 赋码。同时,广西壮族自治区标准技术研究院,中国物品编码中心广西分中心(以下简称广西分中心)也为企业开展了一系列线上线下相结合的UDI 编码培训,向企业提供UDI 标签检测服务,推动基于GS1标准UDI编码体系的实施。
医疗器械企业UDI编码实施情况
UDI备案情况
广西省内共有338 家医疗器械企业已向国家药监局备案,生产Ⅰ类医疗器械产品的企业有209家,Ⅱ类218 家,Ⅲ类10 家,可以看出,大部分医疗器械生产集中在Ⅰ、Ⅱ类,如图1所示(见下页)。
经过走访调查和数据统计,自2019 年底新冠肺炎疫情爆发后,医疗器械企业数量显著增长,2020年4-6月份生产许可证注册数量突破30家,其中大部分新注册的医疗器械生产企业仅仅生产医用口罩这一种产品。2020 年中旬,广西的疫情基本得到控制,医疗器械生产企业注册数量大幅减少,到了2021 年末,医疗器械生产企业数量甚至出现了负增长(注销企业数量大于注册企业数量),如图2所示。
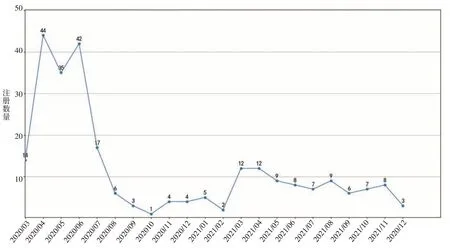
图2 广西医疗器械企业生产许可证注册数量折线图
2021 年底,国家药监局发布了《关于做好第二批实施医疗器械唯一标识工作的公告》,公告要求除《关于做好第一批实施医疗器械唯一标识工作的公告》内定义的第一批Ⅲ类医疗器械产品以外的其他Ⅲ类医疗器械产品必须在2022年6月以前全部完成医疗器械唯一标识赋码工作与DI 备案工作。2022 年初国家药监局数据显示,已有23 家医疗器械生产企业采用基于GS1 体系的编码规则为其产品赋UDI 码,企业在国家药监局数据库备案GS1 标准的DI 数据总计有1300余条。
UDI的推广
广西分中心与企业不断沟通,了解到UDI 推行阻力主要来源于UDI 编码本身和外部实施因素两方面。首先,UDI 规则复杂,不同医疗器械管理类别、包装层级都有对应的编码规则和信息填报要求,企业未经培训之前,很难精准把握UDI编码、载体和标签的设计规范,并且企业需要重新整理编码管理体系,增设内部UDI 管理规则;其次,UDI 的推行需要批发商、零售商、物流提供商、信息系统开发商、医院、监管部门共同参与,只有各个环节提高对UDI认可的共识,才能给予源头生产企业执行的动力。
与企业沟通中发现,对GS1 标准的UDI 编码有所了解的企业大多集中在生产Ⅱ类Ⅲ类医疗器械和拥有进出口贸易的医疗器械企业,且生产Ⅰ类和Ⅱ类医疗器械的企业实施UDI 的意愿较低,原因是许多中小型企业还没有感受到使用UDI 是大趋势,没有仔细了解UDI 编码规则与其为企业内部管理、外部销售所带来的长远影响,同时,许多生产Ⅱ类医疗器械的企业只生产医用口罩这一种产品,不想消耗人力、物力建立UDI管理体系。广西分中心工作人员不断地联系区内医疗器械企业,开展线上线下培训,提供远程指导服务后,情况有所好转,不少企业已经开始着手构建基于GS1标准建立企业UDI 管理系统,并积极与广西分中心工作人员讨论UDI 应用场景,分享企业实施情况。然而广西医疗器械生产企业总量少,实施案例也较为有限,UDI 在许多场景下的应用方式困扰了不少企业。UDI的推广任重而道远。
广西分中心将继续保持与全省医疗器械企业的联系,做好线上线下一对一的指导工作,与开展UDI编码工作的企业保持信息互通,紧跟企业实施进程,从企业角度出发,商讨具体实施策略。以成功构建UDI 管理体系并运行的企业为基础,慢慢拓展到全省生产Ⅱ类乃至Ⅰ类的企业中去。对企业的培训指导过程中,从GS1 体系入手讲解,逐渐深入到UDI 编码、UDI 载体、UDI 标签等内容,层层递进,让企业听得明白、懂得操作。
UDI的实施步骤
注册GS1系统成员
GS1为每位系统成员企业分配独有的厂商识别代码,系统成员即可为自己的商品分配商品项目代码,厂商识别代码和商品项目代码组合在一起,添加一位校验位,就形成了企业商品的“身份证”,也就是商品条码。商品条码的编制是采取GTIN-13 的形式(厂商识别代码和商品项目代码共12 位,校验位1 位),对于医疗器械企业是产品标识符DI,因此,医疗器械生产企业更需要为每个产品赋予“身份证”,这不仅保证了物流链中各个环节,从车间工人到医院、患者,能通过扫码确认产品样貌及信息,满足了药监局对医疗器械的监管要求。
不同包装层级的DI分配
在GS1 的数据库中,会以14 位的字符长度存储GTIN,除了由厂商识别代码和商品项目代码组成的13位数字以外,存储时还有一位数字,并且是首位数字,用来表示包装指示符。包装指示符的取值为0-9,其中,0-8用于表示定量包装,9表示变量包装。
根据国家药监局2019 年发布的《医疗器械唯一标识系统规则公告》中的第十二条,要求注册人∕备案人需要对以其名义上市的医疗器械最小销售单元和更高级别的包装或者医疗器械产品上赋予唯一标识数据载体(UDI),并确保这些数据载体在医疗器械经营使用期间牢固、清晰、可读。对于具有多种包装层级的产品,首先需要为其各个包装层级确定DI。在供应链环节中,企业可以根据生产、装箱、托盘运输等工作的需求,为不同包装层级的贸易单元分配DI,如图3所示:

图3 包装层级图
图中为单品、外箱、托盘三个层级分配了不同的DI,三个DI 仅变换其首位包装指示符和末尾校验码。在同一个产品不同包装层级上采用包装指示符不同而商品项目代码相同的DI分配方式,不仅减少了企业商品项目代码码段的消耗,同时让工作人员、客户能通过外箱或托盘的DI码,分辨出其内部包装的商品。
UDI编码
UDI 是由 DI 和 PI 组成的 ,DI 是产品标识静态信息,PI 是生产标识动态信息。DI 等同于GTIN-13、GTIN-14(根据产品是销售单元(单品)还是物流单元而定)。 PI 基于GS1 标准中的AI(应用标识符),由企业选择其需要使用的 PI(《GB∕T 16986-2018 商品条码应用标识符》中有汇总),以下是四个常见的PI见表1:

表1
在了解DI 和PI 的结构后,便能将其组合成为UDI编码,如图4所示:

图4 UDI公式实例图
上面的例子选取了生产日期(11)、失效日期(17)、生产批号(10)这三个PI与产品DI进行组合。DI部分的(01)表示后方紧跟着的14 位数字是GS1 标准的GTIN,而之所以是14位数字,是因为在全球GTIN数据库中都是采取14 位数字存储结构,对于销售单元的DI,只需在原本的GTIN-13 前补零即可,补零后它是一个14 位的GTIN-13;物流单元则在前面添加包装指示符1-8,并重新计算校验码作为GTIN-14。 PI 部分需将预定义长度的PI放在前面,非预定义长度的PI放在后面,从上述的常见PI 中可见,如生产日期(11)和失效日期(17)的长度是固定6 位数字不变的,则他们是预定义长度的PI,放在例如生产批号(10)、序列号(21)这样的非预定义长度PI 之前。在编码时,应用标识符括号内的信息不写入数据载体。
UDI载体与标签
企业对产品进行相应的UDI 编码后,需要利用载体将编码表示出来,以便物流环节中的机器识读。企业可根据自身需求来确定使用一维条码或者二维码作为UDI 数据载体,如图5 所示(见下页)。在UDI 的实施中,使用GS1-128 和GS1 Data Matrix 分别作为一维条码、二维码的载体。

图5 UDI载体实例图
GS1-128 可以表示DI 和多个PI 信息,如果产品体积和标签或外包装较小,无法将GS1-128 条码印刷在包装上,可以采取GS1 Data Matrix 二维码,此二维码面积小,存储数据容量大,但也要求识读设备必修拥有GS1 Data Matrix 的解析能力,才可以达到精确分离DI、PI 并重新提取呈现的效果,让识读设备使用者能更直观的看到产品信息,企业在识读设备的选择上,需要注意其是否具备翻译GS1 Data Matrix 的功能。GS1 Data Matrix 和普通的Data Matrix 是两个不一样的二维码,其译码算法也是不相同的,在生成二维码时需要注意。
企业决定使用何种形式作为UDI 载体后,便开始生成标签。在标签制作时,需要确保人工识读字符(HRI)和非人工识读字符(Non-HRI)的位置合理,内容清晰。人工识读字符位于条码或标签的上、下、左或右侧,与条码或标签携带的字符相同的文本,相对的,非人工识读字符就是包装、标签或产品上所有其他文本。
GS1 体系推荐所有信息采用HRI格式,但在标签、包装、产品面积有限,无法打印所有HRI 的时候,可以在法规允许的情况下使用HRI 结合Non-HRI 的方式。生成标签后,可以利用微信小程序“UDI 数据解析”进行测试,若能成功译码,则会显示的信息如图6 所示,说明标签印刷可以投入使用。

图6 供人识读字符与非供人识读字符
从测试结果可以看到,具备GS1 Data Matrix 二维码解析能力的程序可以准确将DI与各个PI进行分离,并以使用者一目了然的方式表示出来,使得每一位拥有手机的非专业技术人员、客户都能对该产品进行查询、追溯、解读,如图7所示。

图7 手机使用“UDI数据解析”扫码显示效果图
UDI信息上报
现阶段的UDI 实施中,医疗器械生产企业需要了解国内的政策、国家药监局数据库上报流程,如企业有出口贸易,还需仔细研究所属出口国食品药品监督管理局的法律法规和UDI数据库。以国内药监局UDI上报为例,对于医疗器械企业来说,生产一个新产品、并为其编码后,需要到中国商品信息服务平台上报此产品信息,并使用药监局账号登陆药监局数据库,上报产品DI数据。同时,也可以通过中国物品编码中心开发的一站式“UDI 专区”服务,一个平台就能完成商品信息服务平台和国家药监局数据库的信息上报工作,UDI专区向企业提供了不限量的DI、PI存储管理服务、标签制作服务、专员远程指导服务,为企业带来了极大的便利。UDI专区借助中国物品编码中心供应链数据应用优势,还为医疗器械企业物流、医院采购、科室应用、患者查询等场景提供了追溯、防伪、防窜等远程升级服务。

