丁苯酞联合脑蛋白水解物治疗中晚期帕金森病的临床研究
谷伟,冯英慧,杨继雷,赵宝民
(河北北方学院附属第一医院全科医学科,河北 张家口 075000))
帕金森病(Parkinson’s disease,PD)是临床常见的中枢神经系统退行性疾病,病理变化主要是黑质多巴胺(dopamine,DA)能神经元变性坏死[1-2],目前PD以药物综合治疗为主[3]。脑蛋白水解物为活性肽类水解物,有营养及保护神经元的作用[4];丁苯酞是一种常用的脑保护剂,有抗氧化应激、抗炎症反应、保护线粒体、抑制细胞凋亡等神经保护作用[5]。目前两种药物在PD患者中均有使用,但二者联合使用的报道较少。本研究旨在探讨丁苯酞联合脑蛋白水解物治疗中晚期PD的疗效。
1 资料与方法
1.1 一般资料
选取2020年1月至2022年1月河北北方学院附属第一医院收治的120例中晚期PD患者为研究对象,按照治疗方案不同分为观察组与对照组,每组各60例。观察组中,男性34例,女性26例;年龄(64.22±7.48)岁;病程(6.85±1.34)年;Hoehn-Yahr分级:3级39例,4级21例;症状分型:肌强直型28例,震颤型17例,混合型15例。对照组中,男性37例,女性23例;年龄(63.57±8.22)岁;病程(6.44±1.48)年;Hoehn-Yahr分级:3级42例,4级18例;症状分型:肌强直型27例,震颤型19例,混合型14例。本研究经院伦理委员会审核批准,患者及家属知情同意。两组患者一般资料比较,差异无统计学意义(P>0.05)。纳入标准:(1)根据症状、影像学等确诊为PD[6];(2)口服多巴胺能药物>3年,目前疗效不佳;(3)年龄40~80岁;(4)Hoehn-Yahr分级3~4级(即病情处于中晚期);(5)无脑蛋白水解物使用禁忌证。排除标准:(1)帕金森综合征;(2)帕金森叠加综合征;(3)存在精神分裂症等严重精神类疾病;(4)伴有严重认知障碍;(5)患有严重心脑血管疾病;(6)既往有药物或酒精滥用史;(7)对丁苯酞氯化钠注射液中任何成分过敏;(8)既往有癫痫病史、脑出血或脑部手术史。
1.2 方法
所有患者均常规给予多巴丝肼片(上海罗氏制药)口服,0.125 g/次,3次/d,根据症状适当调整剂量。在此基础上,对照组采用脑蛋白水解物(河北智同生物制药)30 mg+0.9%生理盐水100 mL静脉滴注,1次/d。观察组在对照组基础上采用丁苯酞氯化钠注射液(石药集团恩必普药业)100 mL静脉滴注,2 次/d。疗程均为6周。
1.3 观察指标
(1)临床疗效:参照Webster量表评分减分情况进行疗效评估[7],包括肌强直、姿势、步态、起坐障碍、震颤、生活自理能力等10个项目,每个项目计0~3分,总分30分。其中1~10分为轻度障碍,11~20分为中度障碍,21~30分为重度障碍。显效:Webster量表评分降低>60%;有效:30% 观察组患者治疗总有效率高于对照组,差异有统计学意义(P<0.05)。见表1。 表1 两组患者临床疗效比较 [n(%)] 治疗前,两组患者UPDRS Ⅰ、Ⅱ、Ⅲ部分评分比较,差异无统计学意义(P>0.05)。治疗后,两组两组患者评分UPDRS Ⅰ、Ⅱ、Ⅲ部分评分均降低(P<0.05),且观察组低于对照组(P<0.05)。见表2。 表2 两组患者精神活动、情感障碍、日常生活能力及运动功能比较分) 治疗前,两组患者Th17百分比、Treg百分比及Th17/Treg比值比较,差异无统计学意义(P>0.05)。治疗后,两组患者外周血Treg百分比均升高(P<0.05),且观察组高于对照组(P<0.05);外周血Th17百分比和Th17/Treg比值降低(P<0.05),且观察组低于对照组(P<0.05)。见表3。 表3 两组患者免疫功能指标比较 治疗前,两组患者MDA、8-OHdG、GSH-Px及SOD水平比较,差异无统计学意义(P>0.05)。治疗后,两组患者血清MDA、8-OHdG水平均降低(P<0.05),且观察组低于对照组(P<0.05);血清GSH-Px、SOD水平均升高(P<0.05),且观察组高于对照组(P<0.05)。见表4。 表4 两组患者血清氧化应激指标比较 两组患者不良反应总发生率比较,差异无统计学意义(P>0.05)。见表5。 表5 两组不良反应比较[例,n(%)] 本研究显示,观察组患者在联合采用丁苯酞氯化钠注射液与脑蛋白水解物治疗后总有效率达到了95.00%,明显高于单纯给予脑蛋白水解物治疗(P<0.05)。脑蛋白水解物是用猪脑白蛋白经酶水解后得到的肽制剂,可促进脑蛋白质合成,降低脑内乳酸水平,调节神经元代谢,改善认知功能,对神经细胞可发挥有效保护作用,使其免于遭受神经毒性损害[9]。刘文萍等[10]报道显示,脑蛋白水解物能有效提高老年帕金森的临床疗效,并能有效改善患者的生活质量。丁苯酞是人工合成的消旋体,结构和左旋芹菜甲素相同,可促进脑细胞钙离子浓度下降,减少自由基释放,改善线粒体功能,保护神经细胞[11]。本研究还显示,治疗后观察组UPDRS中各部分(Ⅰ、Ⅱ、Ⅲ)评分均较对照组改善更明显(P<0.05),表明丁苯酞氯化钠注射液联合脑蛋白水解物治疗中晚期PD能有效改善患者的精神活动和情感障碍,恢复运动功能,增强日常生活活动能力,进而提高治疗效果,原因与丁苯酞联合脑蛋白水解物具有的调节神经元代谢、保护神经细胞等作用密切相关。赵晓阳等[12]研究表明,丁苯酞可能通过上调沉默信息调节因子1蛋白表达,抑制帕金森模型小鼠神经元凋亡与氧化应激。此外,周海艳等[13]对收治的PD患者在初始药物治疗方案基础上联合丁苯酞治疗后能有效改善患者的运动和非运动症状。 研究[14]发现,免疫炎症反应在中脑黑质DA能神经元变性、坏死中起着重要作用,可能介导了PD的发病及病情进展过程。大量研究[15]证实,Th17、Treg细胞可通过多途径参与机体免疫功能的调节,Th17细胞及其分泌的细胞因子IL-6、IL-17等可活化中性粒细胞,从而介导机体免疫炎症反应,而Treg细胞发挥的是免疫抑制作用。研究[16]表明,PD患者机体内存在Th17/Treg免疫失衡,表现为外周血Treg细胞表达下调,而Th17细胞表达增多,Th17/Treg比值升高,原因可能与神经炎症等有关。PD患者外周血Treg细胞表达降低可能与以下因素有关:(1)PD患者DA能神经元变性坏死过程中可释放出α-突触核蛋白,有激活小胶质细胞的作用,胶质细胞激活后可分泌多种炎性介质,诱导一氧化氮、前列腺素、自由基等致病介质生成,进而影响Treg细胞活性;(2)PD进展过程中,黑质DA能神经元大量丢失后可造成黑质纹状体D1样受体功能上调,使Treg细胞活性下降,数目减少,神经保护功能减弱。一项研究[17]表明,PD可致血脑屏障功能障碍,Th17细胞可透过血脑屏障进入到脑实质内,诱发神经毒性作用,参与PD病情进展。Th17细胞可介导神经炎症反应,导致脑组织吞噬细胞激活,引发炎症应激反应,炎性因子大量释放,抗氧化酶大量消耗,进而造成神经元损伤[18]。本研究中,治疗后两组患者外周血Treg百分比均升高(P<0.05),且观察组高于对照组(P<0.05),外周血Th17百分比和Th17/Treg比值均降低(P<0.05),且观察组低于对照组(P<0.05),提示在脑蛋白水解物基础上联合丁苯酞氯化钠注射液治疗中晚期PD能更有效地调节患者外周血Th17/Treg免疫平衡,从而有利于保护DA能神经元,抑制其变性、坏死,延缓病程进展。研究[19]证实,氧化应激反应与PD关系密切。PD发病过程中可生成大量的氧自由基,从而引发神经元氧化应激损伤,导致中脑黑质内DA能神经元损伤及凋亡。动物实验研究[20]表明,PD小鼠模型黑质区与纹状体区有大量脂质过氧化产物堆积。PD患者机体内过度的氧化应激反应可能与线粒体功能障碍有关,氧化应激与线粒体功能障碍是引起衰老与神经退行性变性疾病的重要原因。正常情况下,人体内的抗氧化酶足以清除氧自由基,然而当线粒体功能出现障碍后,可导致大量氧自由基生成,抗氧化酶合成不足,从而引发氧化应激反应。黑质DA能神经元容易受到氧自由基攻击进而发生氧化应激损伤,造成线粒体脱氧核糖核酸突变,而线粒体功能障碍反过来会增加PD的患病风险,二者间形成恶性循环。MDA、8-OHdG、GSH-Px、SOD均是重要的氧化应激指标。其中MDA是脂质过氧化的分解产物,8-OHdG是DNA氧化损伤的修饰产物,二者均可间接反映组织氧化损伤程度。GSH-Px与SOD均是重要的抗氧化酶,具有清除氧自由基的作用,其水平降低表明体内清除氧自由基的能力下降,组织细胞更易受到氧化应激损伤。本研究结果显示,治疗后两组患者血清MDA、8-OHdG浓度均降低(P<0.05),且观察组低于对照(P<0.05);血清GSH-Px、SOD水平均升高(P<0.05),且观察组高于对照组(P<0.05),表明丁苯酞与脑蛋白水解物联合使用治疗中晚期PD能有效减轻患者机体内氧化应激反应,进而减少DA能神经元损伤,促进DA能神经元修复,延缓病情进展,可能是丁苯酞联合脑蛋白水解物治疗中晚期PD的重要机制之一。 综上,在脑蛋白水解物基础上联合丁苯酞治疗中晚期PD可安全有效地提高临床疗效,调节外周血Th17/Treg免疫平衡,缓解体内氧化应激水平,保护DA能神经元,值得临床推广应用。1.4 统计学分析
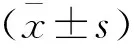
2 结果
2.1 两组临床疗效比较

2.2 两组患者精神活动、情感障碍、日常生活能力及运动功能比较
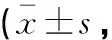
2.3 两组患者免疫功能指标比较

2.4 两组患者血清氧化应激指标比较

2.5 两组患者不良反应发生情况比较

3 讨论

