益气活血方对脑缺血再灌注大鼠学习记忆能力及海马突触可塑性的影响*
李佩佩,时 潇,王 瑞,王又闻,王丽娜,胡建鹏△
(1安徽中医药大学新安医学教育部重点实验室,安微 合肥 230012;2安徽中医药大学中医学院,安微 合肥 230012;3上海中医药大学药学院,上海 201203)
缺血性脑卒中(ischemic stroke,IS)是致死率、致残率极高的脑血管疾病,据统计,有接近65%左右幸存的患者伴有不同程度的神经功能障碍,严重影响到患者的生存质量[1-3]。目前,最有效的治疗方法是快速恢复血液供应,但血管再通引起的脑缺血再灌注损伤(reperfusion injury,RI)可进一步加重脑损伤和神经功能障碍[4]。研究证实[5],脑缺血后引起学习和记忆等神经功能障碍与神经元丢失、突触数量及结构完整性密切相关,如何激活并诱导神经元突触可塑性的修复机制,是当前神经功能恢复研究的重点问题。
中医药对于脑卒中有良好的治疗和预防作用,可通过改善神经元微环境,诱导突触的结构和功能再建,发挥神经功能保护的作用[6-7]。益气活血方(Yiqi-Huoxue decoction,YQHXD;脑络欣通)是基于“气血-脑髓”相关理论对缺血性中风进行辨证施治的特色方剂,我们的前期研究证实该方具有抗炎、抗氧化、保护血脑屏障和促进血管新生等多种药理作用[8-11],但对改善学习记忆功能以及突触可塑性变化的研究较少。突触可塑性相关蛋白是突触可塑性的物质基础[12],突触小泡蛋白(synaptophysin,SYN)和突触后致密物95(postsynaptic density 95,PSD95)分别参与了突触前和突触后的重塑、传递过程,是突触重建的重要标志物[13]。脑源性神经营养因子(brainderived neurotrophic factor,BDNF)是神经系统中分布最多的神经营养因子,可通过调节下游不同信号级联分子调控大脑不同区域的突触结构和功能,并认为与学习和记忆有关,对脑缺血损伤组织发挥着内源性保护作用[14]。本研究通过益气活血方干预大脑中动脉阻塞再灌注(middle cerebral artery occlusion/reperfusion,MCAO/R)模型大鼠,观察海马区突触数目、形态结构和突触可塑性相关蛋白BDNF、SYN和PSD95的变化,旨在探讨益气活血方对脑缺血RI大鼠学习记忆功能和突触可塑性的影响,以期为临床益气活血方治疗IS提供实验依据。
材料和方法
1 实验材料
1.1 动物SPF级雄性SD大鼠60只,9~10周龄,体质量280~320 g,购自安徽医科大学,动物许可证号为SCXK(皖)2017-001。饲养于安徽中医药大学新安医学教育部重点实验室,康为IR60独立送风隔离饲养笼中饲养,室内温度(22±1)℃、相对湿度(45±5)%,光暗周期12 h。大鼠分笼喂养,自由摄食饮水。实验环节均严格遵守实验动物管理规定及实验动物伦理规范(动物伦理编号:AHUCM-rats-2022028)。
1.2 药物脑络欣通浓缩液由黄芪、川芎、三七、当归、红花、天麻和蜈蚣组成,饮片购自安徽中医药大学第一附属医院,经安徽中医药大学中药学专家鉴定。煎煮方式[15]:将所有药材放入砂罐中,量筒量取8倍纯净水(640 mL),浸泡约30 min;然后加热煮沸10 min,转小火熬煮1 h,过滤得到药渣与煎出液;继续向砂罐中加入6.4倍纯净水(512 mL),加热煮沸后保持小火微沸1 h,过滤合并两次煎煮液,经布氏漏斗过滤,再用旋转蒸发仪将滤液浓缩至1 mL(含生药1.08 g),于4℃冰箱贮存备用。
1.3 主要试剂与仪器主要试剂:戊巴比妥钠盐(Sigma);戊二醛(Ted Pella);环氧丙烷(上海迈瑞尔化学技术有限公司);抗PSD95、SYN和BDNF抗体(Affinity);GAPDH抗体(杭州贤至生物有限公司);辣根过氧化物酶标记的羊抗兔Ⅱ抗(武汉博士德生物工程有限公司);RIPA裂解液和BCA试剂盒(碧云天生物科技有限公司)。主要仪器:激光多普勒仪(PeriFlux5001);Morris水迷宫和图像自动采集分析系统(Videomot2,TSE systems GmbH Bad Homburg);BT100-2J型蠕动泵驱动器(保定兰格恒流泵有限公司);TB-718生物组织自动包埋机(泰维电子设备有限 公 司);CM1900超薄切片机(Leica);JEM-1400Flash透射电镜(日本电子株式会社);BX-51光学显微镜(Olympus)。
2 方法
2.1 大鼠MCAO/R模型的制备及判定大鼠适应性喂养1周后禁食12 h,自由饮水。0.3%戊巴比妥钠溶液(10 mL/kg)腹腔注射麻醉动物,参照Longa法[16]并加以改良制备大鼠右侧MCAO/R模型。手术过程中全程采用激光多普勒仪监测大鼠缺血区(颅骨冠状线后方1 mm,矢状线右侧5 mm交汇处)血流量,见图1。插入线栓后血流量下降约70%以上,阻断2 h后,缓慢拔出线栓约5 mm,恢复至初始血流量的60%~70%,视为模型制备成功[17]。假手术组大鼠仅分离血管,不插入线栓。术中室温保持在24~25℃,并用保温垫保持大鼠体温恒定在37℃。
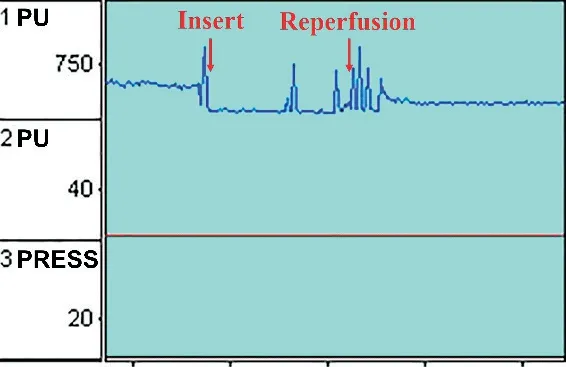
Figure 1.The regional cerebral blood flow(rCBF)traces were recorded by laser Doppler flowmetry during the MCAO/R procedure.图1大鼠手术过程激光多普勒仪监测缺血侧血流量
2.2 动物分组及给药实验大鼠编号、称重、随机分为假手术(sham)组、缺血再灌注(ischemia/reperfusion,I/R)组和YQHXD低、中、高剂量组(low-,medium-and high-dose YQHXD,YQHXD-low,-medium and-high)组,每组12只。YQHXD生药共80 g,参照《药理实验方法学》[18]中人与大鼠体表面积折算值计算等效剂量,低、中、高剂量分别为4.2、8.4和16.8 g·kg-1·d-1,分别于造模后每天上午9:00及下午4:00各灌胃1次。sham组和I/R组以等体积生理盐水采用相同方法、时间灌胃,治疗持续14 d。
2.3 神经功能缺损评分参照Zea Longa标准评分法[16]对术后3、7和14 d模型大鼠进行神经功能缺损评分,具体内容:0分:无神经系统功能缺失症状;1分:不能完全伸展对侧前肢;2分:爬行时向损伤对侧转圈;3分:爬行时身体向损伤对侧倾倒;4分:意识丧失,不能自主行走者。得分越高,神经功能损伤越严重。
2.4 Morris水迷宫实验治疗结束后采用Morris水迷宫评估大鼠学习与记忆功能,整个实验分为定位航行实验和空间探索实验。(1)定位航行实验:进行连续5 d的训练,每天于同一时间接受4次训练,每次训练间隔15 min。由工作人员将大鼠依次顺时针从水池4个象限面向池壁轻轻放入水中,测试时间设为60 s,观察并记录大鼠在测试规定时间内找到目标平台所需的时间,即逃避潜伏期(escape latency)。训练过程中,若大鼠在60 s内未能找到平台,则用棒将其牵引至目标平台,使其停留15 s,则将此次潜伏期记录为60 s,再进行下一次实验。大鼠学习能力用第5天大鼠4次潜伏期均值判定。(2)空间探索实验:空间探索实验在实验最后1 d进行。撤除安全平台,将平台对角象限设为入水点,通过自由摄像系统记录大鼠60 s内游泳轨迹以及大鼠在60 s内穿越原平台所在区域的次数等作为测定大鼠空间定位能力的评判标准。实验人员进行双盲操作。
2.5 HE染色及光镜观察灌胃两周结束后各组随机取4只大鼠,0.3%戊巴比妥钠溶液麻醉后,剪开大鼠胸腔暴露心脏,将灌注针经心脏左心室插入主动脉并固定,快速注入0.9%生理盐水,同时用眼科剪剪破右心耳,待右心房流出清亮液体,换成预冷的4%多聚甲醛溶液缓缓灌注200~250 mL,直至肝脏和肺脏均变为白色,开颅取脑组织用甲醛固定液浸泡2~3 d后进行包埋、切片、脱腊,常规HE染色,封片后置于光学显微镜下观察缺血侧海马CA1区及齿状回(dentate gyrus,DG)病理改变。
2.6 电镜观察突触超微结构的变化治疗结束后,各组随机选取5只大鼠进行心脏灌注,步骤方法2.5,灌注结束后取大鼠脑缺血区海马组织约1 mm×1 mm×1 mm放入2.5%戊二醛进行固定,再经PBS清洗、锇酸固定、梯度脱水、包埋、加热聚合、切片、醋酸铀及硝酸铅染色等过程制得样本,用透射电镜观察照相,每张铜网由左上角至右下角斜线上下移动,连续拍摄10张图片,底片放大5万倍印相。参照Bertoni-Freddari等[19]方格点计数法、Güldner等[20]多点平均法以及Nano Measurer图片分析软件计算突触的数密度(numerical density)和突触后致密物(postsynaptic density,PSD)厚度(nm)。
2.7 Western blot检测SYN、PSD95和BDNF的蛋白表达治疗结束后,各组剩余大鼠行深度麻醉后迅速于冰上断头取脑,立即剥离出病灶侧海马组织置于2 mL EP管中裂解并进行蛋白浓度定量,水浴蛋白变性后制备12%分离胶及5%浓缩胶,取等量20 μg(10 μL)蛋白上样,先后采用恒压80 V、120 V进行电泳,此过程需1.5 h,电泳分离后PVDF转膜(200 mA稳流转移2 h);5%脱脂奶粉室温摇床封闭2 h,然后分别与Ⅰ抗[SYN(1∶1 000),PSD95(1∶1 000),BDNF(1∶1 000)和GAPDH(1∶1 000)]在4℃下孵育过夜;次日TBST充分洗膜后加入HRP标记的山羊抗兔IgG(1∶50 000),室温摇床孵育2 h;用ECL化学发光液显影后观察,用IPP软件定量分析胶片灰度值,以与GAPDH灰度值比值作为蛋白的相对表达量。
3 统计学处理
采用GraphPad Prism 8.0软件进行分析处理。计量资料采用均数±标准差(mean±SD)表示。组间均数比较采用单因素方差分析(one-way ANOVA),方差不齐采用非参数检验。以P<0.05为差异有统计学意义。
结 果
1 各组大鼠神经功能缺损评分比较
与sham组比较,I/R组大鼠神经功能缺损评分显著升高(P<0.01),YQHXD各组神经功能缺损评分均较I/R组大鼠降低,以YQHXD-medium组在给药3和14 d后改善神经功能最为显著(P<0.05),其他组无显著差异;给药3、7和14 d各组大鼠神经功能缺损评分逐渐降低,且不同剂量组用药14 d行为学评分均显著优于3 d(P<0.05),但用药7 d与14 d的差异无显著性,见表1。

表1 YQHXD对各组大鼠不同时间神经功能缺损的影响Table 1.Effects of YQHXD on neurological deficits in different groups of rats at different time points(Mean±SD.n=12)
2 水迷宫测试结果
2.1 各组大鼠逃避潜伏期结果由图2B可知,随着训练时间的延长,每组大鼠的逃避潜伏期时间均缩短,提示各组大鼠均有一定的学习能力。由表2可知,第5天时,与sham组相比,I/R组的平均潜伏期显著延长(P<0.01);与I/R组相比,YQHXD不同剂量组的平均潜伏期时间均显著降低(P<0.01),但各剂量组之间差异不显著(P>0.05),结果未呈现明显的剂量依赖性。
2.2 各组大鼠定位巡航实验结果由表2可知,与sham组比较,I/R组穿越平台次数显著减少(P<0.05);与I/R组比较,YQHXD不同剂量组的穿越平台次数显著增加,其中YQHXD-high和YQHXD-medium组差异有统计学意义(P<0.05),各剂量组之间差异不显著。

表2 YQHXD对各组大鼠水迷宫行为学的影响Table 2.Effects of YQHXD on the behavior of water maze of rats in each group(Mean±SD.n=5)
3 各组大鼠缺血侧海马组织病理学改变
如图3可见各组大鼠脑组织海马CA1区及DG区病理情况改变,结果显示sham组海马CA1区锥体细胞层及DG区颗粒细胞层结构致密,排列整齐,细胞形态正常,细胞数量多,染色正常,分布均匀,未见明显坏死或变性的神经元;I/R组CA1区及DG区可见明显坏死部分,细胞形态异常,细胞体积缩小,结构疏松、排列紊乱,同时存在细胞核固缩深染;与I/R组相比,YQHXD-low组大鼠海马病理损伤有所改善,以CA1区改善较为明显,但DG区细胞排列较紊乱、部分细胞核仍存在固缩深染;与I/R组及YQHXD-low组相比,YQHXD-medium和YQHXD-high组可见缺血区海马组织CA1区及DG区病理程度明显减轻,细胞形态明显改善,结构排列较为整齐,细胞深染和皱缩情况也较少。
4 各组大鼠缺血侧海马突触超微结构变化

Figure 2.YQHXD attenuated the cognitive learning dysfunction induced by I/R in rats.A:rat swimming track map in water maze;B:escape latency of all rats for 5 consecutive days.Mean±SD.n=5.*P<0.05,**P<0.01 vs sham group;#P<0.05,##P<0.01 vs I/R group.图2各组大鼠水迷宫行为学实验结果
通过电镜观察可见sham组突触数量较多,突触前后膜结构清晰、轮廓完整,突触前区可见分布均匀圆形大小的突触小泡、数目较多,突触后膜致密带丰富,在突触前后区可见丰富的线粒体;与sham组相比,I/R组突触前后膜模糊不清,细胞骨架结构散乱,前膜小泡分布散乱稀疏,线粒体肿胀、嵴变短、部分崩解,伴有巨大空泡样,突触数密度显著减少(P<0.01),PSD厚度也显著变薄(P<0.01);与I/R组相比,YQHXD-medium和YQHXD-high组治疗14 d后,突触形态结构改善明显,突触间隙变宽、前后膜结构较清晰完整,前膜内囊泡数量增多,突触数密度显著增多(P<0.05或P<0.01),PSD厚度显著增厚(P<0.05或P<0.01);YQHXD-low组突触超微结构较I/R组有所改善,突触数密度增多,PSD厚度增厚,但与I/R组相比差异无统计学差异(P>0.05);与sham组相比,治疗组仍伴有少量突触结构不清晰和少量空泡样。见图4、5。
5 YQHXD对大鼠缺血侧海马组织SYN、PSD95和BDNF蛋白表达的影响
Western blot结果见图6。与sham组比较,I/R组大鼠海马组织中SYN、PSD95和BDNF蛋白的表达量均显著下降(P<0.01);与I/R组比较,给药14 d后,YQHXD-high组海马中SYN和PSD95蛋白表达量显著上升(P<0.01),BDNF蛋白表达量升高,但差异无统计学意义(P>0.05);YQHXD-low和YQHXD-medium组各蛋白表达量上升,但差异无统计学意义(P>0.05)。
讨 论
随着世界老龄化进程的不断加快,缺血性脑卒中的发病率越来越高,已成为人们致死致残的主要因素,并常伴发不同程度的学习和记忆等神经功能障碍,给患者带来巨大的痛苦。目前认为,脑缺血引起皮层、海马和纹状体等缺血敏感区域的神经元变性坏死,影响到神经环路之间的信息传递,是脑缺血大鼠记忆和学习等能力下降的主要原因[21]。突触是神经元与效应细胞之间接触并传导信息的结构基础,突触数量及结构的完整性对保证神经元获得、加工、贮存及传递信息起着关键的作用[22]。在环境受损时,突触具有发生形态结构与传递效能变化的能力,即突触可塑性,是学习记忆的生物学基础。研究证实,增强脑缺血大鼠神经元的突触可塑性可以促进神经功能重建,减轻学习记忆障碍及肢体运动障碍[23-24]。
中医认为脑为髓海、为元神之府,气血是脑髓充足、脑神充养的物质基础;中风诱导神经元死亡以及神经回路破坏,导致感觉、运动或高级脑功能受损,出现一系列神机失用的病理变化,其修复依赖于气血的充足。基于“脑髓-气血”理论创制的益气活血方(脑络欣通)在临床广泛应用于中风的辨治,方中黄芪功专补气,使气旺活血生血;当归补血活血,使祛瘀而不伤正;川芎、三七、红花共奏行气活血通络之功;天麻、蜈蚣熄风通经活络,使血行脉通则药达脑髓。前期研究结果表明,YQHXD对缺血性脑损伤的恢复起着积极的作用,对减轻神经功能缺损也有良好的疗效[25-26]。在本实验研究结果中,模型大鼠均呈现明显的神经功能缺损和学习记忆功能障碍,经过不同剂量YQHXD的治疗后,MCAO/R大鼠神经功能缺损情况得到改善,模型大鼠在水迷宫实验中的逃避潜伏期显著缩短,穿越平台次数增加,证实了YQHXD对脑缺血/IR大鼠神经功能损伤的治疗作用,亦能提高模型大鼠的空间记忆与学习能力。
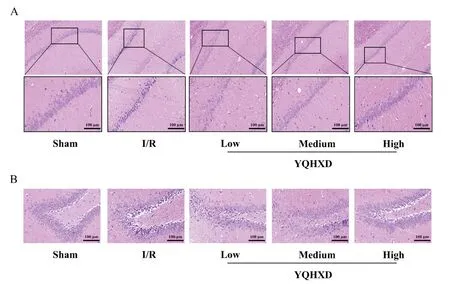
Figure 3.The changes of hippocampal structure in rats on day 14 after MCAO/R.A:CA1 area;B:DG area.The scale bar=100 μm.图3 HE染色比较各组大鼠海马组织CA1区和DG区病理形态

Figure 4.Transmission electron microscopy results of rat hippocampal synapse morphology and structure in each group 14 d after MCAO/R.The scale bars=200 nm.图4各组突触形态结构电镜结果

Figure 5.The results of quantitative analysis of synapses in the hippocampus of rats in each group.A:numerical density of synapses in rats cerebral ischemic hippocampus area in different groups;B:the thickness of postsynaptic density(PSD)in the rats of each group.Mean±SD.n=5.**P<0.01 vs sham group;#P<0.05,##P<0.01 vs I/R group.图5各组大鼠海马突触数密度及突触后致密物厚度分析结果

Figure 6.Relative protein levels of SYN,PSD95 and BDNF in the hippocampus of rats 14 d after MCAO/R.Mean±SD.n=3.*P<0.05,**P<0.01 vs sham group;##P<0.01 vs I/R group.图6各组大鼠海马组织SYN、PSD95和BDNF蛋白水平
海马是参与学习记忆等神经活动的重要脑区,缺血损伤大鼠海马区会发生神经元迟发型变性坏死、数量减少和胞体萎缩等病理改变,以及突触结构完整性破坏与数量密度减少等反应[27-29]。我们在HE染色实验结果观察到缺血后海马CA1区及DG区均出现不同程度的病理损伤,包括锥体细胞及颗粒细胞数量减少、结构排列紊乱、水肿及细胞核固缩深染等;YQHXD不同剂量治疗14 d后,海马CA1区及DG区细胞排列逐渐整齐,核皱缩深染等组织病理改变有所减轻,提示YQHXD可以减轻海马区病理改变,促进神经功能恢复。
突触形态结构的可塑性是功能可塑性的物质基础,其表现包括新突触形成,突触前后膜、PSD厚度及突触囊泡的变化等[13]。突触数密度表示单位体积内突触的数量,单位体积内数密度越大,突触数量越多;PSD是突触后膜胞质面的一层均匀致密物,包含有多种蛋白质,二者均是突触可塑性形态学定量资料的可靠参数[30]。电镜结果显示,与sham组相比,I/R组突触结构破坏,前后膜模糊不清,突触小泡数量稀疏,突触数密度和PSD厚度显著减少;用药14 d后,YQHXD-medium、high组明显改善突触形态结构,突触前后膜结构较清晰完整,前膜内囊泡分布较密集均匀,突触数密度和PSD厚度也显著增多;YQHXD-low组突触超微结构有所改善,突触数密度增多,PSD厚度增厚,但与I/R组及YQHXD-medium、high组无统计学差异。此结果说明YQHXD可修复脑组织海马区突触形态结构,增加突触数目和PSD厚度,从而提高大脑神经元的突触可塑性。
SYN是分布在突触前囊泡膜上主要的钙结合酸性糖蛋白,与神经递质的包装、储存、调节及释放密切联系,其密度和分布可间接反映突触数量和分布情况;PSD95是PSD上的脚手架蛋白,可以通过不同结构域募集NMDA受体及其下游多种特异的信号分子维系突触的连接状态,同时对突触后兴奋性信号进行整合,与突触重塑密切相关[13]。大量研究发现[31-32],脑缺血导致SYN和PSD95蛋白表达显著下降,通过药物及针刺等干预,可上调SYN和PSD95水平,促进脑缺血后突触可塑性。脑源性神经营养因子可以调控学习记忆以及神经元生存的相关蛋白表达,参与到中枢神经系统突触可塑性的调节[33]。有实验研究结果表明BDNF-/-小鼠海马CA1区突触数量大量减少,对学习和记忆功能产生影响[34-35]。此外,还有研究表明海马BDNF的水平提高可以促进SYN和PSD95表达,从而调节突触可塑性。我们的研究结果显示,I/R组大鼠缺血缺氧再灌注14 d后BDNF、SYN和PSD95蛋白表达较sham组显著降低;经YQHXD不同剂量组治疗后,BDNF、SYN和PSD95蛋白水平呈现上升趋势;与I/R组相比,YQHXD-high组海马中SYN和PSD95蛋白表达量显著增多;BDNF蛋白表达量升高,无显著差异。同时,突触相关蛋白SYN和PSD95的表达与BDNF保持一致的变化,结合既往研究结果推测YQHXD可能通过上调BDNF的表达,促进SYN和PSD95的表达。虽然研究结果表明YQHXD-medium和YQHXD-high组BDNF蛋 白 水平高于低剂量组,但三组均低于sham组,说明YQHXD干预14 d能增加模型大鼠内源性营养因子表达,但恢复不到正常水平。
综上所述,益气活血方可提高MCAO/R模型大鼠空间学习与记忆能力,减轻海马区神经元病理损伤,修复突触超微结构,提高突触数密度和PSD厚度,降低神经功能缺损评分,其机制可能与促进海马区BDNF、SYN和PSD95突触蛋白表达、提高神经元突触可塑性有关。本研究通过动物模型为YQHXD从内源性保护途径治疗IS提供实验依据,未来可从神经可塑性调控通路方面做进一步探索。

