两例Blau综合征患者的临床表现及致病基因突变分析
杨友均 李诗雨 周 洋 刘 凡 丁 艳
1 病例资料
患者1,女性,4岁3个月,因“反复关节肿痛1年余”入院。患儿10月龄起出现全身红色皮疹,无瘙痒,外用药物治疗后可部分缓解,易反复,2岁半起逐渐出现双腕、双膝、双踝关节肿痛、活动受限;伴不规则发热, 热峰为38.5℃,予布洛芬退热处理可降至正常。查体:体温 36.7℃,心率103次/分,呼吸24次/分,血压 92/58 mmHg(1 mmHg≈0.133 kPa),全身皮肤散在红色粟粒样皮疹,高出皮面,压之褪色,双腕、双膝及双踝关节明显肿胀,触之囊性感。见图1。辅助检查:白细胞计数 9.85×109/L,血红蛋白95 g/L,超敏C反应蛋白 9.94 mg/L,红细胞沉降速率25 mm/h;类风湿因子阴性,抗核抗体阴性。磁共振:双膝关节、双踝关节以及左掌指关节绒毛结节性滑膜炎。见图2。眼部检查未见异常。父母非近亲,既往史、家族史无特殊。完善家系全外显基因检测:患儿NOD2基因(NM_022162)存在c.1538T>C杂合突变导致该基因编码的蛋白513位由甲硫氨酸突变为苏氨酸(p.M513T),其父母未见异常。见图3。入院诊断:Blau综合征。给予强的松、甲氨蝶呤口服、肿瘤坏死因子-α拮抗剂皮下注射治疗,后强的松逐渐减停,继续甲氨蝶呤、肿瘤坏死因子-α拮抗剂维持治疗,病情控制良好。
患者2,女性,7岁2个月,因“反复皮疹5年,多关节肿痛4年”入院。5年前无明显诱因全身出现红色栗粒样皮疹,伴皮肤干燥,天凉皮疹减轻。4年前出现多关节肿胀,以双腕、双膝及双踝关节为主,无发热。查体:体温36.4℃,心率98次/分,呼吸21次/分,血压95/61 mmHg,全身可见红色皮疹;心肺腹查体无异常;双腕、双膝、双踝及双手指间关节有囊性肿胀,伴双膝关节压痛、双腕关节活动受限。见图1。辅检:白细胞计数9.17×109/L,血红蛋白101 g/L。类风湿因子阴性。肿瘤坏死因子-α 87.3 pg/mL(较正常值升高)。眼部检查:双眼角膜下浑浊。磁共振:手关节绒毛结节性滑膜炎,双膝关节积液且周围肌肉软组织肿胀。见图4。其父亲幼时有类似症状,表型较轻。父母非近亲,既往史无特殊。完善家系全外显子基因检测:患儿NOD2基因存在c.1000C>T杂合突变,该变异使编码的334位氨基酸由精氨酸突变为色氨酸(p.R334W),患者突变遗传自有轻微表型的父亲。见图3。入院诊断为:Blau综合征。给予甲氨蝶呤口服、肿瘤坏死因子-α拮抗剂皮下注射治疗,病情控制良好。为验证患者2相应突变基因NOD2对基因功能的影响进行检测:取患者及健康对照儿童外周血RNA,体外反转录为cDNA,NOD2基因为目的基因,ACTIN为内参基因进行荧光定量PCR检测,分析患者NOD2及NF-κB通路相关基因表达水平。结果显示NF-κB通路相关基因 NFKB1、BCL10、 MALT1表达水平显著升高,NFKB2无差异。见图5。
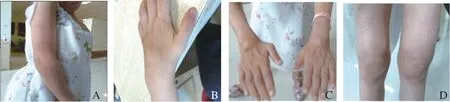
注: A为患者1手臂粟粒样皮疹,B为患者1肿胀的(左)腕关节,C、D为患者2肿胀的手关节及膝关节。
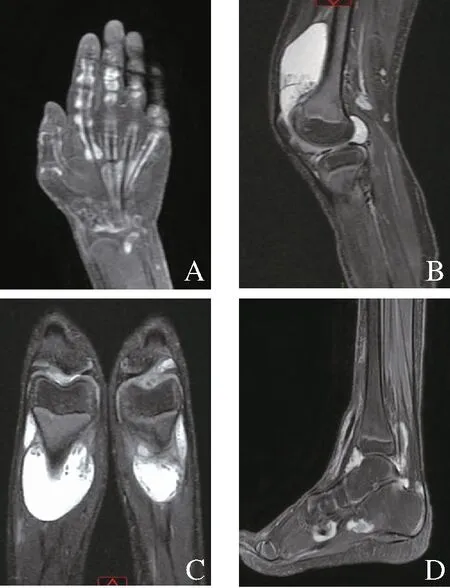
注:A为患者1手关节影像,B、C为患者1膝关节影像,D为患者1踝关节影像。
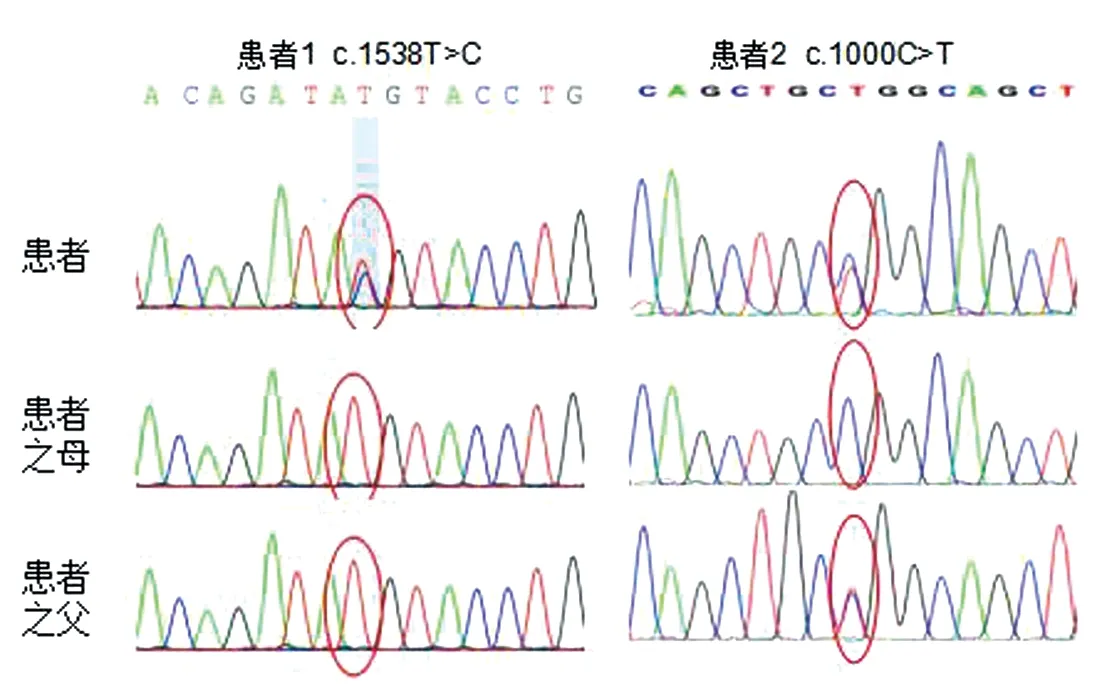
图3 两例患者及其父母NOD2基因突变检测结果
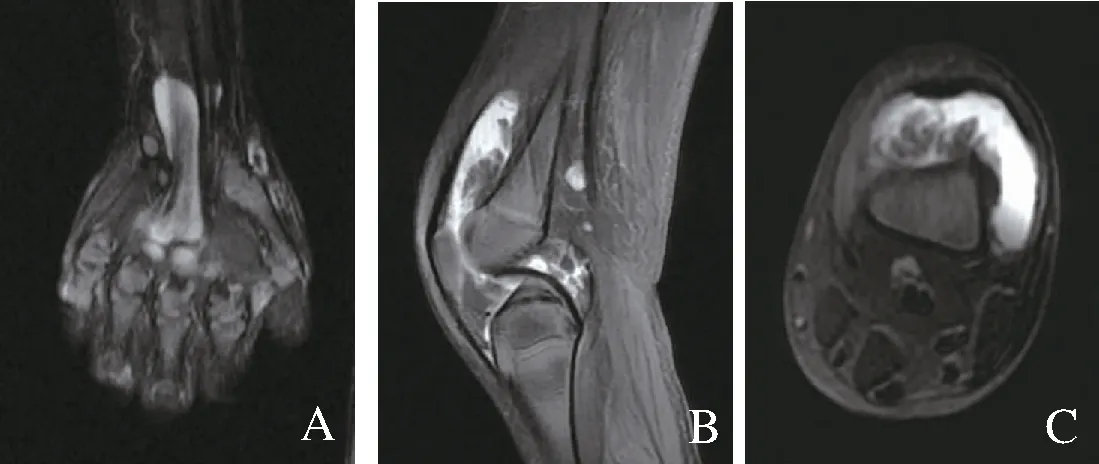
注:A为患者2手关节影像,B、C为患者2膝关节影像。
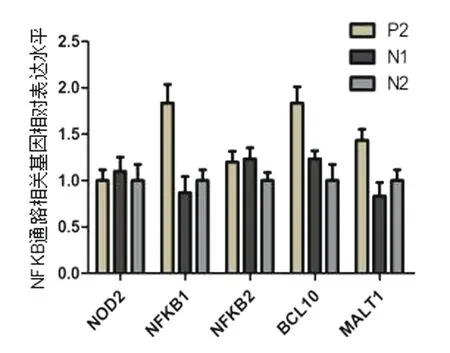
图5 患者2外周血NOD2以及NF-KB信号通路相关基因表达分析
2 讨论
Blau综合征(Blau syndrome,BS)是一种少见的常染色体显性遗传病,多于婴儿期或儿童期起病,典型的症状为慢性对称性关节炎、鳞屑样皮疹、葡萄膜炎三联征[1-2],此外还可出现间断发热、中枢神经系统损害、肝肾和肺部病变等系统损害,其中皮肤受累多为首发症状,多表现为斑丘疹,后融合成片对称出现,由于皮疹形态缺乏特异性,且患儿多有关节肿胀表现,因此就诊早期极易被误诊为幼年特发性关节炎(juvenile idiopathic arthritis,JIA)[3]。本文中的病例1最初误诊为JIA。BS关节炎的特征包括肥厚性滑膜炎和腱鞘炎,急性期表现为特征性“囊样”增生,该囊肿疼痛不明显,局部皮温不高、质软、可活动,可对称性累及大小关节,但一般不累及中轴关节及颞下颌关节[4],而JIA的关节病变表现为关节肿痛及活动受限,影像学上以关节积液、滑膜增厚及骨质破坏、关节腔狭窄为特征,缺乏特征性“囊样”增生,此有助于早期疑诊BS,但确诊需要基因检测。目前认为BS眼部受累与预后相关,其特征是眼痛、视力模糊和畏光等为主要表现的葡萄膜炎,多为双侧,易反复发作,严重者可导致青光眼、白内障、周围虹膜粘连、眼压增高等[5]。本文报道的2例患者起病年龄小,以皮肤病变为首发症状,后出现典型的关节炎囊状表现,病例1早期诊断为JIA,后因反复皮疹、关节囊样肿胀更为明显而疑诊BS通过进一步完善基因检测明确诊断。病例2早期因明显皮疹在当地医院诊断为“湿疹”予外用药物治疗,后逐渐出现对称性关节囊样肿胀,来本院就诊时由于对病例1诊治的经验积累,医生对BS的认识加深,临床考虑BS可能性大,及时基因检测即确诊。
NOD2基因定位于染色体16q21区域[6],且多位于NACHT区,一般认为该区域突变是一种功能获得性突变,会导致NOD2蛋白持续活化,从而激活下游信号通路,释放炎性因子[7]。本研究检测了患者外周血中NFKB1, BCL10及MALT1转录水平,发现与正常对照组比较,患者上述基因的表达水平均升高,提示存在NF-kB信号通路激活,病例2血清中TNF-a水平显著升高也证实了这一点。文献[8]报道,BS患者中约90%以上NOD2基因为错义突变,也有剪切、缺失及插入突变等报道。本文报道的2例患者NOD2基因均为错义突变,病例2基因突变来源于父亲,但父亲表型轻微,可能与环境、其他修饰基因对致病基因影响、蛋白表达翻译等环节异常有关。
BS尚无特异的治疗药物,目前主要采用非甾体抗炎药联合糖皮质激素缓解关节、眼部症状,对于病情迁延、反复以及器官损害严重的患儿,需加免疫抑制剂治疗。此外生物制剂能快速缓解病情,尤其合并葡萄膜炎时,临床常用肿瘤坏死因子-α拮抗剂治疗。通过早期规范治疗可缓解大部分患儿的临床症状,提高生活质量,明显降低致残率。
综上所述,对早期出现皮疹、多关节囊样肿胀、葡萄膜炎的患儿注意警惕是否为BLAU综合征,及时基因检测早期确诊,尽早治疗,改善预后。

