不同采收期虫草参多酚对羟基自由基介导的DNA氧化损伤保护作用的研究
高春燕,郭 琦,李媛丽,李 望,卢跃红,
(1.北方民族大学生物科学与工程学院,宁夏银川 750021;2.大理大学公共卫生学院,云南大理 671000)
自由基是人体内产生的正常代谢的中间产物[1]。外部因素,如环境污染物、压力、农药、辐射、水源污染、各种医疗处理也会促进自由基的形成[2]。自由基具有高反应活性,可以与糖类、蛋白质、脂类、DNA等生物分子发生氧化反应,启动自由基链式反应,破坏生物机体的结构,从而损害机体[3-5]。其中,自由基攻击DNA,可引起细胞内DNA的氢链断裂、碱基降解和主链解旋,可造成细胞生物学活性改变,甚至导致基因突变、肿瘤与细胞死亡。此外,自由基被认为是引起衰老和各种慢性疾病,如神经系统疾病、心血管疾病、癌症和糖尿病的重要因素[6-9]。多酚,广泛存在于植物的花、茎、叶及果实中[10]。大量的研究表明,多酚是良好的抗氧化剂,具有显著的自由基清除活性[11-14]。
虫草参(Lycopus lucidusTurcz.),系唇形科地笋属多年生草本植物的地下根茎[15]。在我国,主要分布在山东、四川、重庆、广西等地区。其中,在云南主要分布在丽江、大理、昆明[16]。大理剑川沙溪镇是云南省境内野生虫草参的原产地,现已建成大规模的人工引种栽培基地。虫草参富含酚酸[17]、黄酮[18]、三萜类[19]、多糖等植物化学物[20-21],具有抗氧化[22]、抗衰老[23]、降血糖[24]、降血脂[25-26]、增强免疫[27]、抗肿瘤等功能活性[28-29]。虫草参作为云南高原特色食品资源[19],在民间传统中以炒制、炖煮、油炸和腌渍食用等为主。
自当年种植的11月份至次年的1月份,可陆续进行虫草参的采挖。先前,郭琦等[30]已经报道了四联村三个采收期虫草参对ROO·介导的DNA损伤的保护作用,但对·OH介导的DNA损伤的保护作用尚未见报道。为了进一步明确虫草参对不同自由基介导的DNA损伤保护作用,本文以两个采收地三个采收期的虫草参为原料,采用分步提取法,提取了虫草参中的游离酚和结合酚,测定了提取物的多酚含量,并采用HPLC法检测了没食子酸、绿原酸、咖啡酸和迷迭香酸在提取物中的含量。同时采用体外·OH介导的DNA氧化损伤体系,评价了虫草参多酚提取物对DNA氧化损伤的保护作用,以期为虫草参功能活性的开发提供理论依据,同时为DNA损伤的预防与治疗提供借鉴。
1 材料与方法
1.1 材料与仪器
虫草参 采自云南省剑川县沙溪镇江尾村(S1)和鳌凤村(S2)三个采收期(T1:2016/11/28;T2:2016/12/27;T3:2017/01/27)的新鲜样品,清洗,冻干,粉碎,过60目筛,-20 ℃冷藏备用;pBR322质粒DNA(0.5 μg/μL)、咖啡酸、绿原酸、迷迭香酸、没食子酸、Folin-酚试剂、Trolox 标品纯度≥99%,Sigma-Aldrich公司;色谱甲醇 美国Fisher公司;其它试剂均为国产分析纯。
Scientz-18ND型真空冷冻干燥机 宁波新芝生物科技股份有限公司;V-T3可见分光光度计 屹谱仪器制造(上海)有限公司;Agilent 1200高效液相色谱仪和Agilent ZORBAX SB-C18色谱柱 美国Agilent公司;DYY-6C型双稳定时电泳仪和WD-9413C型凝胶成像分析系统 北京六一科技生物有限公司。
1.2 实验方法
1.2.1 多酚的提取 参考文献[31]的方法进行游离酚和结合酚的提取。游离酚的提取步骤:5.0 g虫草参粉,80%甲醇超声波辅助(37 ℃、500 W)提取3次(10 min/次),合并滤液,旋蒸,剩余水相调pH至1~2,乙酸乙酯萃取3次,合并乙酸乙酯相,旋蒸,剩余残留物冻干,得游离酚提取物。
结合酚的提取步骤:提取完游离酚后所得虫草参残渣,NaOH(2 mol/L,含乙二胺四乙酸和维生素C),室温避光震荡水解4 h,调pH至1~2,抽滤,滤液乙酸乙酯萃取3次,合并乙酸乙酯相,旋蒸,剩余残留物冻干,得结合酚提取物。
1.2.2 多酚含量的测定 采用Folin-酚法测定[32],分别吸取0.00、0.08、0.12、0.16、0.20、0.24、0.28 mL 100 μg/mL没食子酸标准溶液于10 mL具塞试管中,加入100 μL Folin-酚试剂,混匀,3 min后,加入2 mL 7.5%(w/v)Na2CO3,蒸馏水定容至5 mL刻度处,混匀,置暗室反应40 min。待反应结束后于760 nm处测定吸光值。以没食子酸浓度为横坐标,以吸光度为纵坐标,绘制标准曲线。得没食子酸标准曲线方程为y=0.0965x+0.0974(0~6.4 μg/mL),相关系数R2=0.9917。配制一定浓度的地参游离酚和结合酚提取物待测液,分别吸取0.1 mL,按上述步骤,测定其多酚含量。多酚含量测定结果以没食子酸等量每毫克提取物干重表示(μg GAE/mg)。
1.2.3 HPLC分析条件 色谱柱:Agilent ZORBAX SB-C18色谱柱(5 μm,250 mm×4.6 mm);流速:1 mL/min;柱温:30 ℃;进样量:10 μL;检测波长:320 nm。流动相A:100%色谱甲醇;流动相B:色谱甲醇:冰乙酸:H2O,10:1:89。
虫草参游离酚和结合酚梯度洗脱条件见表1。以峰面积(Y)为纵坐标,以浓度(C)为横坐标,在游离酚洗脱条件下,没食子酸、绿原酸、迷迭香酸和咖啡酸的回归方程分别为Y=1.915C-2.19(R2=0.9929,10~50 μg/mL)、Y=31.786C-154.62(R2=0.9936,10~50 μg/mL)、Y=20.75C-335.16(R2=0.9985,40~200 μg/mL)和Y=65.704C-989.22(R2=0.9925,40~200 μg/mL);在结合酚洗脱条件下,没食子酸、绿原酸、迷迭香酸和咖啡酸的回归方程分别为Y=1.975C+1.01(R2=0.9964,10~50 μg/mL)、Y=30.683C-136.23(R2=0.9982,10~50 μg/mL)、Y=14.186C-54.828(R2=0.9914,5~40 μg/mL)和 Y=53.679C-166.8(R2=0.9934,5~40 μg/mL)。样品中含量的测定结果以微克每毫克提取物表示(μg/mg)。
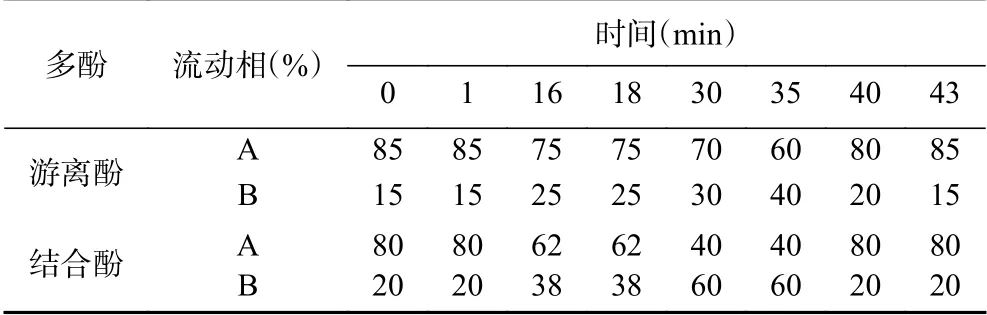
表 1 HPLC梯度洗脱条件Table 1 Gradient elution conditions of HPLC
1.2.4 多酚提取物DNA氧化损伤保护作用的测定参考Jeong等[33]的方法进行测定。具体操作流程为:1 μL质粒DNA、10 μL 10 mmol/L pH7.4 PBS、分别加入5 μL游离酚溶液(25、50、100、200、300 μg/mL)、结合酚溶液(3.125、6.25、12.5、25、50 μg/mL)(正常组和损伤组为5 μL PBS),充分混匀,加入2 μL 1 mmol/L FeSO4和2 μL 1 mmol/L H2O2(正常组为4 μL PBS),37 ℃水浴30 min,取出4 μL,加入2 μL loading buffer,混匀,吸取4 μL,加入1.0%的琼脂糖凝胶Tris/Acetate/EDTA缓冲液中电泳50 min,凝胶成像系统测定灰度值。按下式计算双螺旋百分比:双螺旋百分比(%)=G1/(G1+G2+G3)×100。式中:G1、G2和G3分别为双螺旋、开环和线性DNA的灰度值;以Trolox(25、50、100、200、300 μg/mL)作为阳性对照。
1.3 数据处理
2 结果与分析
2.1 虫草参多酚提取物的多酚含量
两个采收地三个采收期的虫草参多酚提取物的多酚含量见表2。虫草参游离酚和结合酚提取物的多酚含量范围分别为86.53~181.40和89.70~193.58 μg GAE/mg,且S2采收地的高于S1。不同采收地的虫草参游离酚和结合酚在采收过程中多酚含量变化趋势存在差异。就游离酚而言,S1采收地的虫草参呈现T1<T2<T3的趋势,而S2采收地的呈现T3<T2<T1的趋势;就结合酚而言,S1采收地的虫草参呈现T1<T3<T2的趋势,而S2采收地的呈现T2<T3<T1的趋势。采用析因分析检验了采收地和采收期对多酚提取物多酚含量的影响以及两因素的交互作用,结果见表3和表4。就游离酚而言,其多酚含量不仅受到采收地和采收期的影响,同时还受到两因素的共同交互作用;就结合酚而言,其多酚含量受到采收地的影响和两因素的共同交互作用。与植物多酚的合成与代谢有关的酶有苯丙氨酸解氨酶(PAL)、酪氨酸氨基转移酶(TAT)、肉桂酸-4-羟基化酶(C4H)、多酚氧化酶(PPO)等。不同采收地虫草参在采收过程中酶的合成或者酶的活性发生的变化不同,从而影响了虫草参中游离酚和结合酚的合成与代谢,致使其在不同采收期多酚含量存在差异[34]。
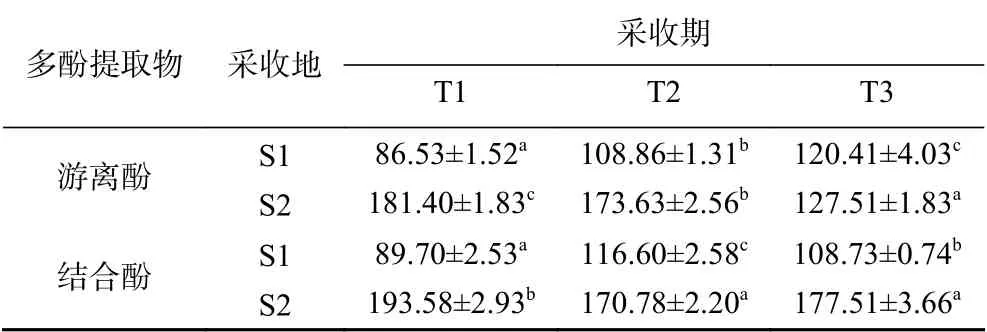
表 2 虫草参多酚提取物的多酚含量(μg GAE/mg)Table 2 Polyphenolic content of extracts from Lycopus lucidus Turcz. (μg GAE/mg)

表 3 采收地和采收期对虫草参游离酚提取物多酚含量的主体间效应检验Table 3 The test of between-subjects effects of collect sites and harvest times on the polyphenolic content of free phenolic extract from Lycopus lucidus Turcz.

表 4 采收地和采收期对虫草参结合酚提取物多酚含量的主体间效应检验Table 4 The test of between-subjects effects of collect sites and harvest times on the phenolic content of bound phenolic extract from Lycopus lucidus Turcz.
2.2 虫草参多酚提取物中多酚组成的HPLC分析结果
根据前期研究结果[17,30],采用HPLC检测了虫草参多酚提取物中四种酚酸的含量,代表性的色谱图见图1。可以看出,结合酚中分离出的色谱峰多于游离酚,且没食子酸和绿原酸在所有样品中均未检出。咖啡酸在游离酚中含量较低甚至未检出,在结合酚中的含量范围为6.53~44.29 μg/mg,迷迭香酸在游离酚和结合酚中的含量范围分别为40.43~77.64和1.93~5.32 μg/mg(表5),表明咖啡酸在结合酚中含量较高,而迷迭香酸在游离酚中含量较高。此外,不同采收地同一采收期游离酚和结合酚提取物中咖啡酸和迷迭香酸的含量水平不同,S2采收地虫草参中的咖啡酸含量高于S1;而迷迭香酸在游离酚中,T1和T3采收期,S2采收地的高于S1,相反在T2采收期,S2采收地的低于S1,在结合酚中,三个采收期均为S2采收地的高于S1。这种含量的差异可归因于采收地对咖啡酸和迷迭香酸在虫草参生长过程中合成代谢的影响不同。

图 1 代表性的 HPLC 色谱图Fig.1 Representative HPLC chromatograms
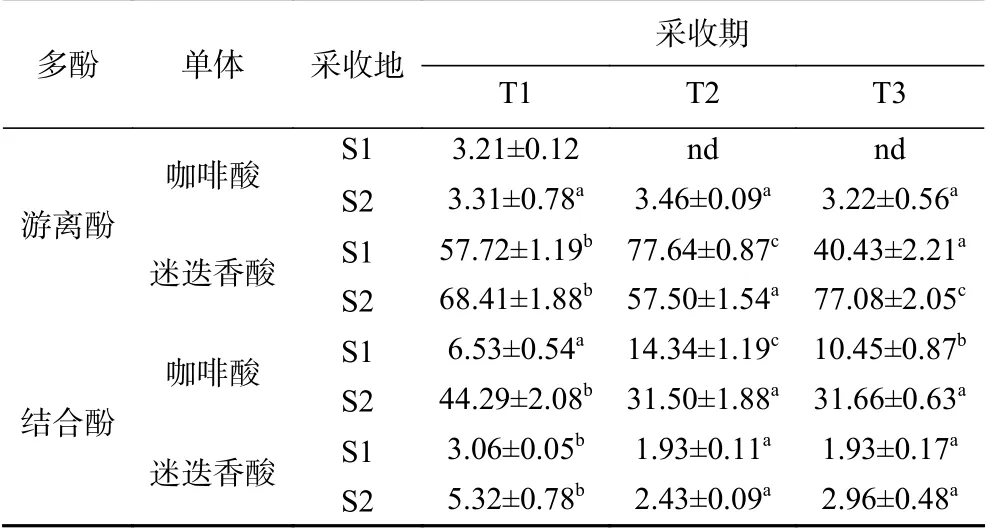
表 5 虫草参多酚提取物中迷迭香酸和咖啡酸的含量(μg/mg)Table 5 The content of rosmarinic acid and caffeic acid in phenolic extracts from Lycopus lucidus Turcz. (μg/mg)
2.3 虫草参多酚提取物对DNA氧化损伤的保护作用
虫草参游离酚和结合酚提取物对DNA氧化损伤的保护作用分别见图2和图3。正常的pBR322质粒DNA主要为双螺旋结构(泳道1),被·OH氧化损伤的DNA,主要为开环和线性结构(泳道2)。与损伤的DNA相比,添加了虫草参多酚提取物后,DNA双链被损伤的程度明显减弱(泳道3~7)。保护作用的定量分析结果以双螺旋百分比(%)进行表征,值越大,表明保护效果越好。
在25~300 μg/mL浓度范围内,虫草参游离酚提取物对DNA氧化损伤保护作用的双螺旋百分比范围为1.81%%~55.04%(图2),且不同采收地保护作用不同。就S1而言,其双螺旋百分比范围为3.99%~49.15%,且不同采收期保护作用存在差异;T1采收期的双螺旋百分比范围为8.29%~49.15%,且呈现先升高后降低而后又上升的趋势,当浓度从25 μg/mL提高至50 μg/mL时,保护作用也提高,当提高至100 μg/mL时反而又降低,进一步从100提高至300 μg/mL时,保护作用也逐渐提高;T2采收期的双螺旋百分比在3.99%~32.33%范围内,且在50 μg/mL时,保护作用最强;T3采收期的双螺旋百分比范围为8.66%~44.78%,当 浓 度 从25 μg/mL提 高 至50 μg/mL时,保护作用逐渐减小,当浓度提高至100~200 μg/mL时,保护作用显著增强,且达到最大,但当浓度进一步提高至300 μg/mL时,保护作用反而又减弱。就S2而言,其双螺旋百分比范围为1.81%~55.04%,且不同采收期保护作用同样存在差异;T1采收期的双螺旋百分比范围为6.84%~50.19%,当浓度从25 μg/mL提高至50 μg/mL时,保护作用无显著变化,当浓度提高至100 μg/mL时,保护作用显著升高,而后随着浓度的增加呈波浪性变化;T2采收期双螺旋百分比范围为30.14%~55.04%,保护作用随着浓度的增加呈现先降低后升高,而后再降低的变化趋势;T3采收期双螺旋百分比范围为1.81%~50.10%,保护作用随着浓度的提高呈现先升高后降低的变化趋势,在50 μg/mL时,保护作用最强。
在3.125~50 μg/mL浓度范围内,虫草参结合酚提取物对DNA氧化损伤保护作用的双螺旋百分比范围为1.67%~70.83%(图3),与游离酚相似,不同采收地保护作用不同。就S1而言,其双螺旋百分比范围为1.67%~45.36%,且不同采收期保护作用存在差异;T1采收期的双螺旋百分比在4.68%~45.36%范围内,且随着浓度的增加呈现先升高后降低而后又升高的趋势,在6.25 μg/mL时,保护作用达到最大;T2采收期的双螺旋百分比在1.67%~5.94%之间,几乎无保护作用;T3采收期的双螺旋百分比在2.56%~39.99%范围内,且呈现先降低后升高而后又降低的趋势,在25 μg/mL时保护作用达到最大。就S2而言,其双螺旋百分比范围为3.03%~70.83%,且不同采收期保护作用同样存在差异;T1采收期的双螺旋百分比在3.03%~51.87%范围内,随着浓度的提高保护作用呈现先降低后升高而后又降低的趋势,在25 μg/mL时,保护作用最大;T2采收期的双螺旋百分比在17.71%~55.94%范围内,当浓度由3.125 μg/mL提高至6.25 μg/mL时,保护作用显著下降,继续提高至25 μg/mL时,保护作用无显著性差异,进一步增加至50 μg/mL时,保护作用显著提高且达到最大;T3采收期的双螺旋百分比在15.87%~70.83%范围内,当浓度从3.125 μg/mL提高至25 μg/mL时,保护作用逐渐增加,但当浓度继续提高至50 μg/mL时,保护作用反而显著下降。
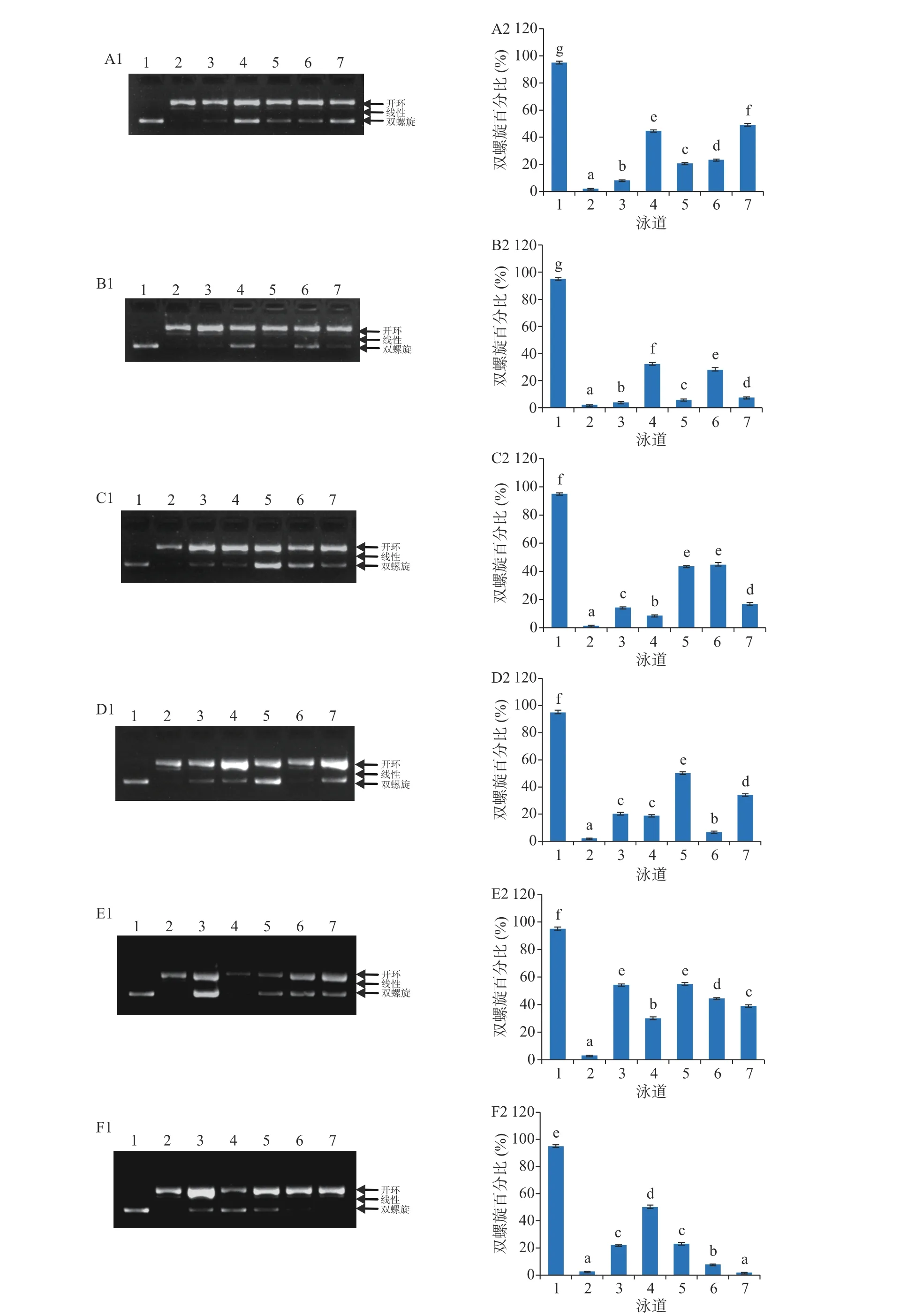
图 2 虫草参游离酚对 DNA 氧化损伤的保护作用Fig.2 DNA oxidative damage protective effect of free phenolics from Lycopus lucidus Turcz.
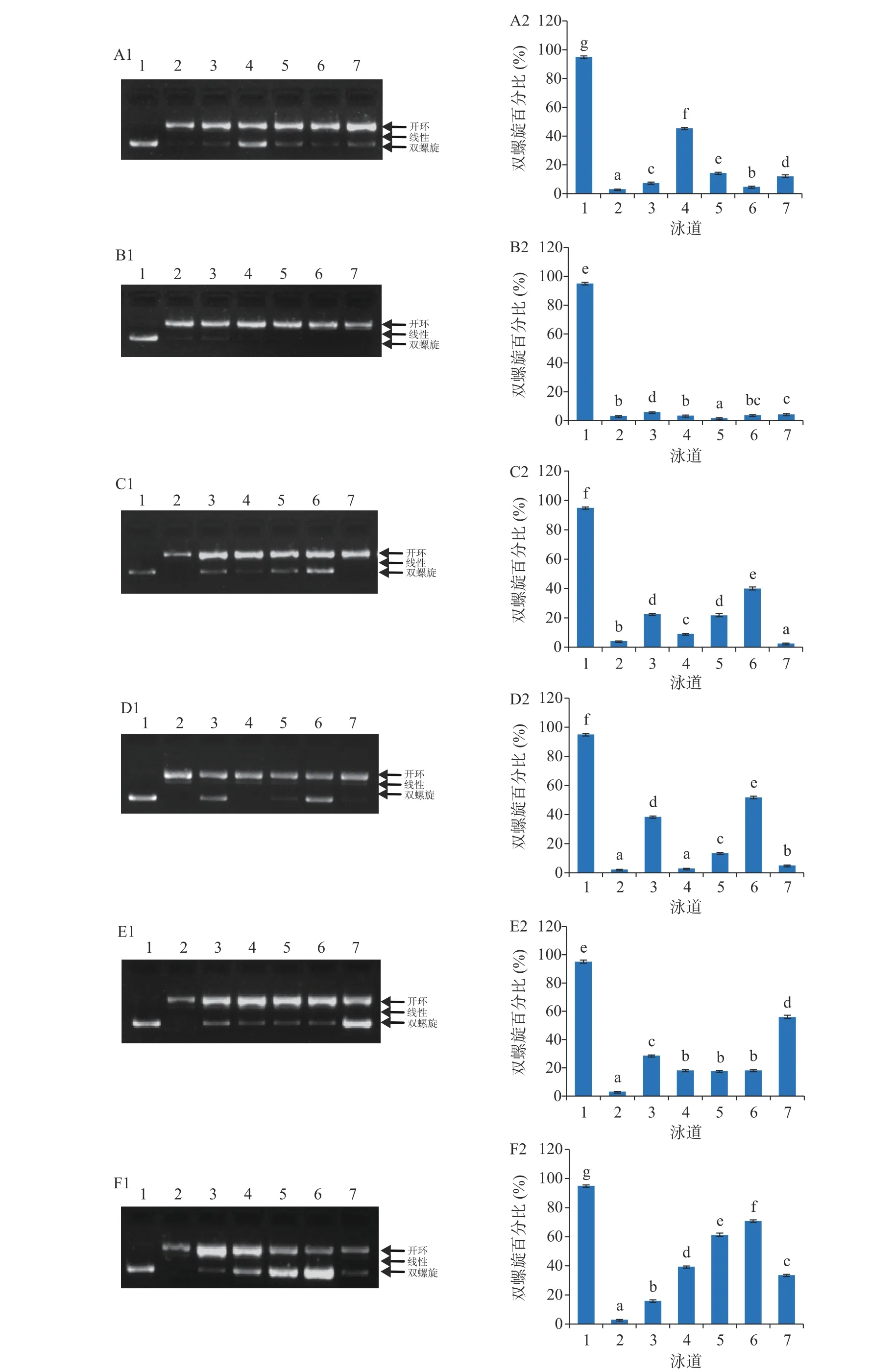
图 3 虫草参结合酚对 DNA 氧化损伤的保护作用Fig.3 DNA oxidative damage protective effects of bound phenolics from Lycopus lucidus Turcz.
具有清除·OH和螯合Fe2+能力的化合物,对·OH介导的DNA氧化损伤,都会显示出一定的保护作用。通过浸提法获得的多酚粗提物中通常含有色素、糖类、蛋白质、氨基酸等非多酚类成分,而这些物质同样具有清除自由基和螯合Fe2+的能力[35-36]。此外,多酚提取物中的各成分之间对DNA损伤的保护作用可能存在拮抗或协同的关系。因此,虫草参多酚提取物对DNA氧化损伤的保护作用未呈现出剂量依赖效应。
阳性对照Trolox对DNA氧化损伤的保护作用见图4,在浓度25~300 μg/mL范围内,其双螺旋百分比范围为53.27%~77.28%,且浓度越大,保护效果越好。与Trolox相比,在25~300 μg/mL浓度范围内,S1和S2采收地的游离酚提取物对DNA氧化损伤保护作用的双螺旋百分比最高分别为49.15%和55.04%,接近于25 μg/mL Trolox的保护作用;在3.125~50 μg/mL浓度范围内,S1和S2采收地结合酚提取物双螺旋百分比最高分别为46.36%和70.83%,分别与25 和100 μg/mL Trolox(图4中3、5泳道)的保护作用接近。大体上讲,相较于游离酚,结合酚对DNA氧化损伤表现出更好的保护作用,这不仅与两种不同结合态多酚提取物多酚含量水平的不同有关,还与两种多酚提取物中多酚类化合物单体的组成存在差异有关。
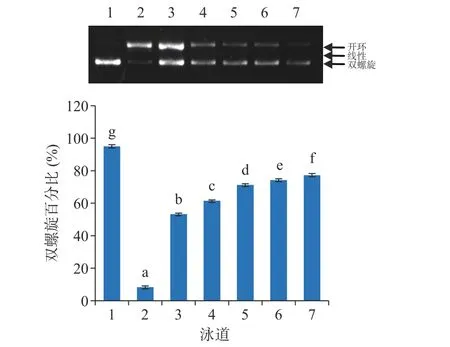
图 4 Trolox 对 DNA 氧化损伤的保护作用Fig.4 DNA oxidative damage protective effects of Trolox
3 结论
虫草参游离酚和结合酚提取物的多酚含量范围分别为86.53~181.40 μg GAE/mg和89.70~193.58 μg GAE/mg,且S2采收地的高于S1。游离酚提取物的多酚含量不仅受到采收地和采收期的影响,同时还受到两因素的共同交互作用;结合酚的多酚含量受到采收地的影响和两因素的共同交互作用。两个采收地三个采收期的虫草参多酚提取物中均未检出没食子酸和绿原酸。咖啡酸在结合酚中含量较高,而迷迭香酸在游离酚中含量较高,且不同采收地含量存在差异。虫草参多酚对·OH介导的DNA氧化损伤具有一定的保护作用,相较于游离酚,结合酚表现出更好的保护效果。

