西红花药材中胭脂红和赤藓红的离子迁移谱快检方法研究
高延甲,韩莹,孙利民,房娟娟,李强,王鹰
(1.山东省食品药品审评查验中心,山东 济南 250014;2.济南市民族医院,山东 济南 250012)
中药材、中药饮片非法染色掺假[1]不仅影响中药临床疗效,且极大地危害患者的健康。食品药品检验系统对食品药品非法添加色素的检测进行了大量研究,国家颁布的薄层色谱法[2-3]、高效液相色谱法[4-5]、毛细管区带电泳法[6]等系列药品检验补充检验方法,均可实现色素的定性定量鉴别,液质联用技术也逐渐成为了添加色素的检验“金标准”[7],但上述方法所需时间相对较长,不适用于现场快速筛查。离子迁移谱(IMS)技术是利用电喷雾电离产生[M+H]+或[M-H]-离子的迁移时间对化合物进行定性,专属性强,分析时间短,可实现每分钟一个样品的快速鉴定[8-9]。该方法可用于3-FMC、二亚甲基双氧苯丙胺等精神类管制品[10]以及100~500 Da小分子物质[11]的快速检测,也逐渐用于食品药品非法添加的快速检测[12]。常见染色药材包括西红花、乌梅、五味子等(胭脂红、赤藓红染色),黄柏、黄连等(金胺O染色)。本研究中利用IMS技术对中药材染色中常见的胭脂红、赤藓红进行检测鉴别,为中药材染色色素的快速检测提供参考。现报道如下。
1 仪器与试药
仪器:GA2100型电喷雾离子迁移谱(美国Excellims公司);XS205DU型电子天平(瑞士Mettler Toledo公司)。
试药:西红花对照药材(批号为121009-201707),胭脂红对照品(批号为111771-201603,含量>98%)、赤藓红对照品(批号为111772-201505,含量>98%),均购于中国食品药品检定研究院;乙醇为色谱纯。西红花药材(河北凯达药业有限公司编号分别为S1,S2;亳州市药材市场,编号分别为S3,S4)。
2 方法与结果
2.1 溶液制备
对照品溶液:分别取胭脂红、赤藓红对照品各10.0 mg,精密称定,分别置100 mL容量瓶中,加乙醇溶解并定容,摇匀,制成质量浓度为100μg/mL的单一对照品贮备液,置4℃保存,使用前取出并恢复至室温,加乙醇稀释,制成质量浓度均为1μg/mL、10μg/mL的单一对照品溶液。
模拟阳性供试品溶液:分别精密量取10μg/mL的2种单一对照品溶液5.0,2.5,1.0,0.5 mL,1μg/mL的2种单一对照品溶液2.5,1.0,0.5,0.25 mL,分别与100 mg西红花药材混合浸泡染色后晾干,即得模拟阳性样品;取100 mg,加10 mL乙醇浸泡5 min,经0.45μm滤膜滤过,取续滤液,即得。
供试品溶液:取市场可疑西红花药材样品1 g,加乙醇10 mL,浸泡5 min,经0.45μm滤膜滤过,取续滤液,加乙醇稀释10倍,即得。
2.2 IMS条件优化
色素类物质结构相对复杂,胭脂红含有亚硫酸根离子(SO32-)、赤藓红含有氧负离子(O-),易产生[M-H]-离子峰,故采用[M-H]-进行测试。[M-H]-条件下,以柠檬酸作校正物质,离子源电压2 000 V,漂移管电压7 500 V,进气温度180℃,漂移管温度180℃,栅电压45 V,栅脉冲宽度120μs,漂移管流速1.2 L/min,排气泵流速0.8 L/min,运行时间30 s,光谱范围25 ms;针对色素在中药材中非法染色的特性,优化迁移谱条件,考察其稳定性。
[M-H]-条件下,离子源电压变化对2种对照品迁移时间的影响较小,迁移时间较稳定,而对响应峰面积较大(图1)。胭脂红的响应峰面积随离子源电压的变化相对稳定,但高于2 200 V时,检出峰面积急剧减少,响应值较低;低于1 200 V时,随电压降低,响应值明显降低;1 600~2 000 V时,胭脂红的响应峰面积随电压的变化较小。赤藓红在离子源电压为1 600~2 200 V时响应峰面积均较大,但在低于1 600 V、高于2 200 V时,响应峰面积急剧减少。因此,选取电压2 000 V作为[M-H]-条件下标准离子源电压,优化后的离子迁移谱条件见表1。[M-H]-模式下,以柠檬酸为校正物质,校正时间为8.606 ms。仪器经校正后,柠檬酸迁移时间为(8.606±0.002)ms。

图1 离子源电压变化对色素鉴别的影响Fig.1 Effect of ion source voltage change on pigment identification of dye
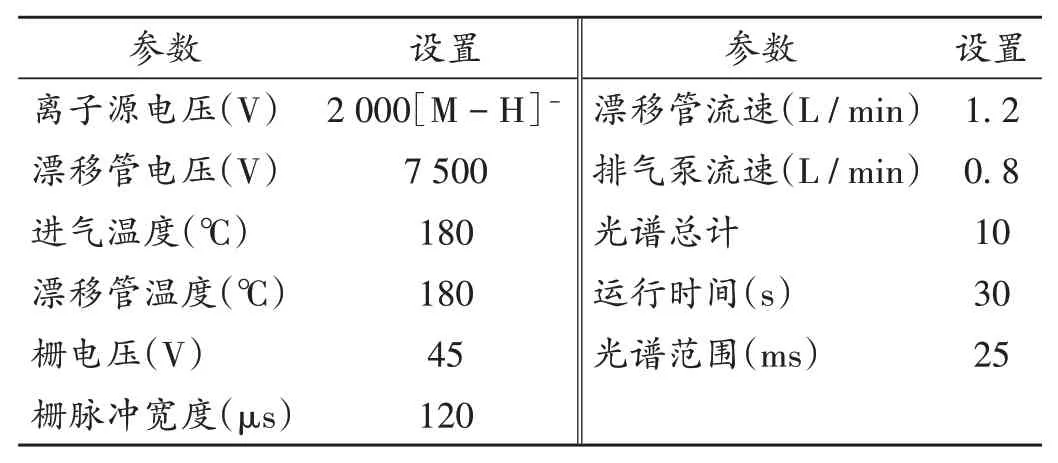
表1 IMS检测条件Tab.1 IMS detection conditions
2.3 色素迁移时间
分别对2种对照品(10μg/mL)的迁移时间进行考察,结果2种色素均有单一检测峰,易鉴别,胭脂红、赤藓红的迁移时间分别为(9.277±0.018)ms、(16.705±0.016)ms,见表2、图2。同时,对色素对照品连续3 d在同一台IMS仪上进行测试,结果见表3。2种色素对照品连续3 d测试结果的RSD均小于0.1%,表明稳定性良好。
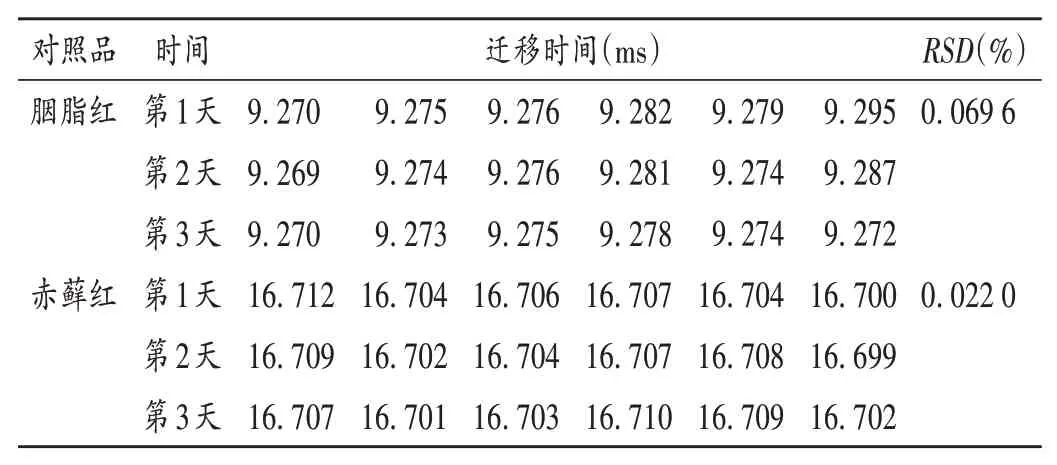
表3 色素标准品迁移时间结果Tab.3 The migration time of dyes standards

图2 色素对照品的离子迁移谱图1.Carmine 2.ErythrosineA.Carmine reference solution B.Erythrosine reference solutionFig.2 IMS spectra of dye reference
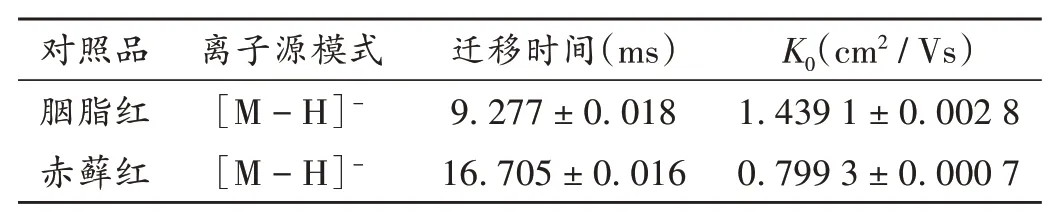
表2 色素标准物质IMS特性Tab.2 IMS characteristics of dye reference materials
2.4 2种色素同时存在时的迁移时间
胭脂红、赤藓红同时存在时,[M-H]-条件下出现了对应2种对照品的双峰,见图3。可见,胭脂红、赤藓红易区分,且迁移时间完全与单一色素存在时的迁移时间一致。
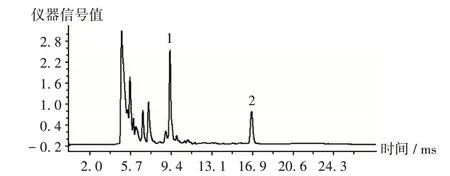
图3 2种色素同时存在时的离子迁移谱图1.Carmine 2.ErythrosineFig.3 IMS spectra of two dyes detected simultaneously
2.5 基质干扰
以西红花对照药材作空白对照品,取适量,按2.1项下供试品溶液制备方法制备不同质量浓度的空白对照品溶液,按从低到高的质量浓度进行分析,发现在色素出峰位置,各质量浓度的空白对照品溶液均无干扰峰出现(图4)。
图4 空白对照品的离子迁移谱图Fig.4 IMS spectra of blank reference
2.6 模拟阳性样品检测
取2.1项下模拟阳性供试品溶液适量,进行IMS分析,结果见图5。可见,胭脂红峰位于图5 A中9.282 ms处,赤藓红峰位于图5 B中16.702 ms处,与图2中2种色素的迁移时间一致,无基质干扰,表明方法专属性良好。
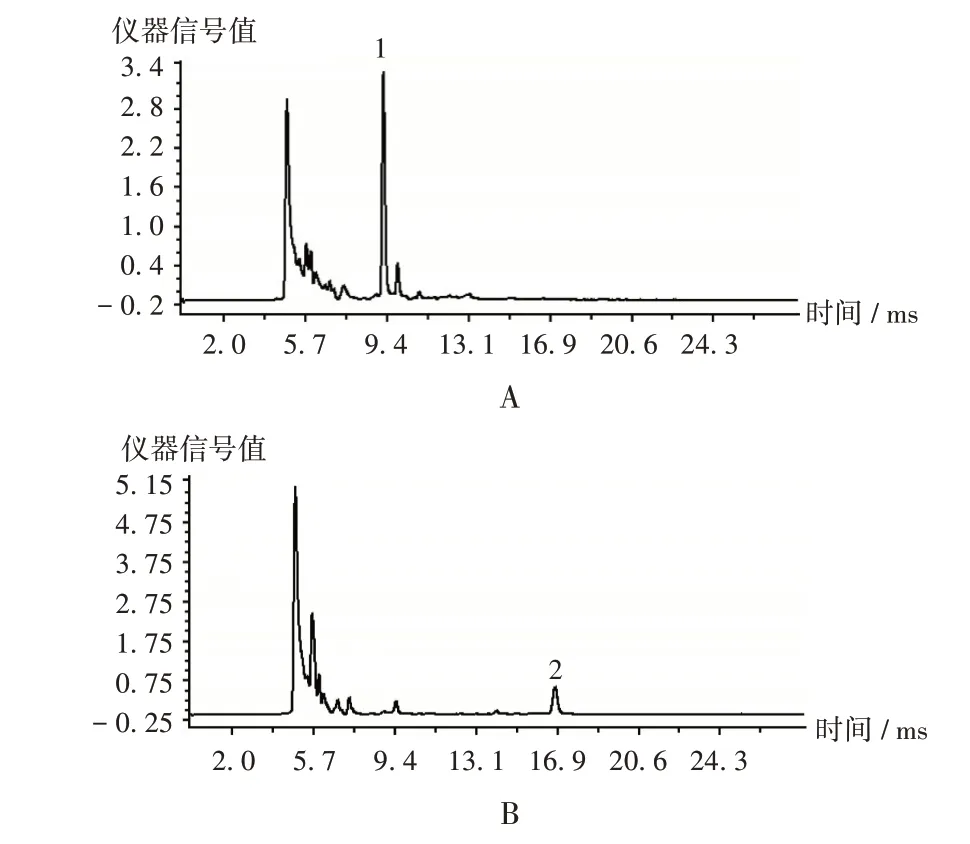
图5 模拟阳性样品离子迁移谱图1.Carmine 2.ErythrosineA.Simulated positive test solution of carmine B.Simulated positive test solution of erythrosineFig.5 IMS spectra of simulated positive samples
2.7 检测限考察
取2.1项下模拟阳性供试品溶液适量,加乙醇稀释制成2种色素对照品质量浓度均分别为50,25,10,5,2.5,1,0.5,0.25μg/mL的系列模拟阳性供试品溶液,取适量,分别进样检测,记录谱图,详见图6。以信噪比(S/N)为3时的色素质量浓度记作检测限,结果胭脂红、赤藓红的检测限均为5μg/mL。

图6 不同质量浓度2种色素的离子迁移谱图1.Carmine 2.ErythrosineA.Simulated positive test solution of carmine B.Simulated positive test solution of erythrosineFig.6 IMS spectra of two dyes with different mass concentrations
2.8 样品测定
取10批次西红花药材样品(S3-S12),按2.1项下方法制备供试品溶液进样检测,记录IMS图。发现有1批次药材供试品溶液的IMS图中,检出了与胭脂红迁移时间一致的峰,认定该批次样品中存在胭脂红染色,详见图7;另采用国家药监局批准的标准方法检测[12],仍检出胭脂红,与IMS结果一致。

图7 阳性样品的离子迁移谱图1.CarmineFig.7 IMS spectra of the positive sample
3 讨论
薄层色谱法、液相色谱法、毛细管区带电泳法、液质联用等技术均可用于色素的筛查[5,7],但均属实验室检查,不适合现场快检。本研究中建立的IMS检测体系,可实现同时、快速地检测市售西红花药材中是否存在胭脂红、赤藓红染色,前处理简单,检测时间短,数据结果准确,可信度高。
IMS方法仅能依靠迁移时间来进行初步定性判断,方法定性效果好,定量效果欠佳,后续还需在实验室中利用液质联用等技术进一步定量分析,有一定局限性。但在现场快速筛查中,该方法具备处理简单、检验迅速的特点,适合执法现场对大批量中药材进行快速有效的筛查,从而进行针对性的抽样检验。

