新型固态荧光增强的萘酰亚胺衍生物的合成与发光行为
李素婉, 曾 跃, 夏 炎, 李 曼, 陈茂文, 张灯青*
(1. 东华大学 化学化工与生物工程学院,上海 201620; 2. 上海市建平中学,上海 200135)
荧光材料由于其多功能性、高灵敏性和刺激响应性等特性,在荧光探针[1]、发光二极管[2]、生物成像和药物输送[3]等领域应用广泛。萘酰亚胺是用途最广泛的荧光团之一[4],这类化合物是典型的电子供体-π-电子受体(D-π-A)型荧光染料,其芳香核和N-酰亚胺位点可以通过简单且成本低廉的方式进行修饰[5]。例如在1,8-萘酰亚胺的4-位引入给电子基团后,其衍生物的共轭体系将发生改变形成分子内的推-拉电子的电荷转移,这种形式的共轭体系分子具有吸收系数高、斯托克斯位移大、荧光量子产率高、光稳定性强和易修饰等特点[6-7],此外还具有给电子官能团(donor, D)和吸电子官能团(acceptor, A)的D-A型萘酰亚胺及其衍生物在激发时伴随着分子内电荷转移(CT),从取代基到吸电子二甲酰亚胺基团的电子转移的特征[8]。
在过去的几十年中,研究人员已发展了一系列萘酰亚胺功能化的荧光探针[9-11]。然而萘酰亚胺会形成π-π堆积聚集体,导致荧光淬灭,固态荧光微弱或不发光,在一定程度上限制了其应用。自唐本忠[12]提出聚集诱导发光效应以来,研究人员通过共价修饰或者配位驱动自组装等方式在ACQ核心周围结合AIE单元实现了从ACQ分子向AIE分子的转化[13-15],虽然这会导致分子在溶液中荧光减弱甚至消失,然而当萘酰亚胺4-位引入强的给电子基团时可以增强化合物在低极性溶剂中的发射且取代基与萘酰亚胺部分以单键连接时,分子可以自由旋转形成扭曲的分子内电荷转移现象(TICT),固态TICT的抑制可以增强荧光发射[16]。
TICT模型最初由Grabowski及其同事提出,用于解释4-(二甲氨基)苯甲腈(DMABN)的不寻常双荧光带[17]。在TICT状态下,准平面荧光团的供电子部分(D)/电子接受部分(A)在光激发时朝着几乎垂直的排列方向旋转。在这种旋转过程中,分子内电荷转移(ICT)的程度大大增强,但是强烈的分子内电荷转移会破坏共轭体系,导致电子的去耦合,形成非发射性的电荷分离物质[18],引发荧光淬灭。CT与TICT是可逆的,因此D-A型化合物在气相和非极性溶剂中,激发态平衡构象比基态平衡构象(中间体ICT态)更平坦,但在高极性溶剂中变得更加扭曲(对应扭曲的ICT态,TICT),导致荧光减弱或淬灭[18]。固态时由于TICT受到抑制,因此能量以辐射方式传递并发出荧光[8]。因此,合理设计分子结构使化合物既能增强固态荧光,又能使其具备在溶液中的发光特性将具有重大意义。
本文以4-溴-1,8-萘酐为原料合成了化合物3,其固态荧光较微弱;随后利用亲核取代反应得到目标化合物4(Scheme 1),其表现出异于ACQ和AIE相同的光物理性质,能在溶液与固体状态下均发出明亮的荧光。

Scheme 1
1 实验部分
1.1 仪器与试剂
Jasco V-630型紫外分光光度计;SHIMADZU RF-6000型荧光分光光度计;Brucker-AV400MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Agilent LC-MS 6120型液质联用仪;Thermo Nicolet IS10 FT-IR型傅里叶变换红外光谱仪;WRS-2A型微机熔点仪。
化合物1按文献[19]方法合成;其余所用试剂均为光学纯、分析纯或化学纯。
1.2 合成
(1) 化合物2的合成
氩气保护下,向100.00 mL两口圆底烧瓶中依次加入化合物1(500.00 mg, 2.10 mmol)、N-Boc-乙二胺(368.00 mg, 2.30 mmol)和无水乙醇15.00 mL,加热至80 ℃,回流反应12 h。冷却至室温,减压蒸除溶剂,残余物经硅胶柱层析(洗脱剂:乙酸乙酯 ∶石油醚=20 ∶1,V∶V)纯化,得黄色固体2772.00 mg,产率96%;1H NMR(400 MHz, CDCl3)δ: 8.60(d,J=6.7 Hz, 1H),8.51(t,J=7.9 Hz, 2H), 7.72~7.67(m, 1H), 7.18(d,J=8.1 Hz, 1H), 4.36(t,J=5.4 Hz, 2H), 3.52(s, 2H), 3.14(s, 6H), 1.31(s, 9H)。
(2) 化合物3的合成
向50.00 mL两口烧瓶中加入化合物2(400.00 mg, 1.04 mmol),反应溶剂为CF3COOH和CH2Cl2(CF3COOH ∶CH2Cl2=1 ∶3,V∶V)的混合溶液。反应12 h, TLC监测反应,反应结束后减压蒸馏除去溶剂,加入碳酸氢钾调pH=8,二氯甲烷萃取,干燥,称重,得橙色固体化合物3280.00 mg,产率95%:1H NMR(400 MHz, CDCl3)δ: 8.56(dd,J=7.3 Hz, 1.1 Hz, 1H), 8.47(d,J=8.2 Hz, 1H), 8.43(dd,J=8.5 Hz, 1.1 Hz, 1H), 7.6~87.63(m, 1H), 7.12(d,J=8.2 Hz, 1H), 4.18~4.12(m, 2H), 3.11(s, 6H), 3.09~3.06(m, 2H)。
(3) 化合物4的合成
化合物4分两步合成:将3,5-二溴苯甲酸(420.00 mg, 1.50 mmol)在2.50 mL氯化亚砜溶液中加热回流6 h,蒸发除去过量的氯化亚砜,得到3,5-二溴苯甲酰氯的粗产物。粗产物无需进一步纯化,随后向制得的3,5-二溴苯甲酰氯中加入化合物3(509.00 mg, 1.80 mmol)和新蒸的二氯甲烷溶液,40 ℃反应过夜,减压蒸除溶剂,残余物经硅胶柱层析(洗脱剂:二氯甲烷 ∶甲醇=100 ∶1,V∶V)纯化得橙色固体4691.00 mg,产率85%, m.p.188~189℃; IR(KBr)(ν/cm- 1): 3337.8(N—H的伸缩振动),3105.3(Ar—H的伸缩振动),2930.9(烷基碳的C—H伸缩振动),1685.3、 1645.0和1592.3(C=O的伸缩振动),1318.7和1260.6(C—N键的伸缩振动),754.4、 783.1和800.8(间位三取代苯环的面外弯曲振动);1H NMR(400 MHz, CDCl3)δ: 8.58(dd,J=7.3 Hz, 0.9 Hz, 1H), 8.48(d,J=8.3 Hz, 1H), 8.42(dd,J=8.5, 0.9 Hz, 1H), 7.79(d,J=1.7 Hz, 2H), 7.70(t,J=1.7 Hz, 1H), 7.64(dd,J=8.3 HZ, 7.4 Hz, 1H), 7.08(d,J=8.3 Hz, 1H), 4.53~4.50(m, 2H), 3.83~3.79(m, 2H), 3.10(s,J=14.5 Hz, 6H);13C NMR(101 MHz, CDCl3)δ: 165.45, 165.00, 164.71, 157.34, 137.71, 136.42, 133.21, 131.49, 130.38, 129.07, 124.94, 124.86, 123.04, 122.48, 113.94, 113.19, 44.74, 40.97, 38.95; LC-MS(EI)m/z: calad for C23H19N3O3Br2543.8{[M+H]+}, found 543.8{[M+H]+}。
2 结果与讨论
在前躯体3的基础上,利用亲核取代反应合成了具有扭曲结构的化合物4,并研究了其光物理性质。化合物4中萘酰亚胺部分与N,N-二甲基胺以单键连接,并能够自由旋转,因此它可以形成TICT态(图1),TICT态对溶剂极性敏感[20]。
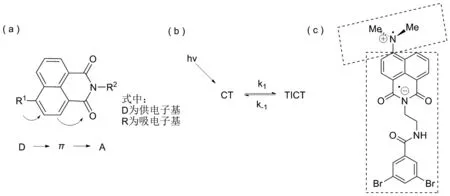
图1 (a) 1,8-萘酰亚胺类化合物的分子内电荷转移示意图;(b) 1,8-萘酰亚胺类化合物两种(CT和TICT)S1激发态相互转换的动力学过程;(c)化合物4的扭曲的分子内电荷转移(TICT)模型Figure 1 (a) The intramolecular charge transfer of 1,8-naphthalimide derivatives; (b) Kinetics process of the interconversion of in terms of two(CT and TICT) S1 excited states of 1,8-naphthalimide compounds; (c) Twisted intramolecular charge transfer(TICT) model for compound 4
化合物4的固态荧光发射曲线如图2(a)所示。由图2可知,化合物4在固态时发出明亮的黄色荧光,这可以归因于分子紧密堆积使得两部分官能团不能顺利扭转其角度,分子轨道保持原本状态并保持一定的角度,产生非平面分子构象,抑制了分子的面对面堆积,可有效防止由于发射极和空穴传输分子靠得太近而造成的能量损失,因此,能量以辐射方式传递并发出荧光。相比之下,前驱体化合物3的荧光较弱,这可能是由于化合物4中引入的取代基体积较大,有效抑制了分子间相互作用,减弱了聚集导致的荧光淬灭效应[21]。从图2(b)可知,化合物4在不同溶剂中可以实现黄、绿、蓝3种荧光颜色的发射,这可能是溶剂极性使化合物4分子内电荷发生了变化。

图2 (a)化合物4(左)与化合物3(右)在自然光线的固态荧光图;(b)化合物4(左)与化合物3(右)的固态荧光图(λex=365 nm); (c)化合物4在不同溶剂中的荧光图(c=10 μM)Figure 2 (a) Solid-state fluorescence images of compound 4(left) and compound 3(right) in natural light; (b) Solid state fluorescence of compound 4(left) and compound 3(right) (λex=365 nm); (c) Fluorescence of compound 4 in different solvents(c=10 μM)
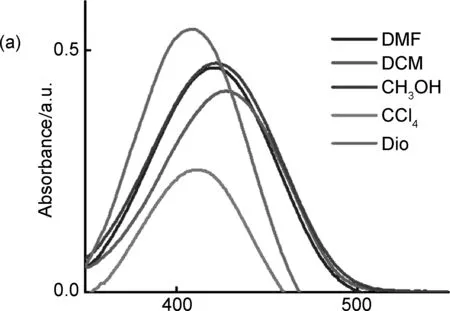
化合物4在不同溶剂中的紫外可见吸收光谱如图3(a)所示。从图3(a)可以看出,化合物4在极性溶剂CH3OH与DMF中的吸收曲线近乎重合,最大吸收波长在421 nm;化合物4在极性较小的CCl4溶液中的最大吸收波长为413 nm。不同溶剂中,其溶解度及极性都将对化合物4的吸收光谱与荧光光谱产生影响。从图3(b)可以看出,化合物4在极性溶剂如CH3OH与DMF溶液中的荧光微弱,但在CH2Cl2溶液中的荧光强度约为DMF溶液中荧光强度的250倍,最大发射波长为530 nm,而在CCl4溶液中的最大发射波长为485 nm,在CH2Cl2溶液中的发射波长相对于CCl4溶液红移45 nm。化合物4的荧光强度与光谱位置表现出溶剂效应,形成溶剂效应的原因主要有两方面,一方面是溶剂极性越大,化合物4与溶剂间的静电作用越强,使其激发态更稳定,荧光波长红移,另一方面,化合物4是推拉电子的共轭体系,光照激发后分子极性的增加使得分子在极性较大的溶剂中激发态的稳定化作用比基态更强烈,两者共同作用使得化合物4的发射波长随溶剂极性增大而产生红移。此外在非极性溶剂如CCl4、 CH2Cl2溶液中,分子的主要激发态是发射电荷转移激发态(CT),因此可以在溶液中发出明亮的荧光。但随着溶剂极性的增加,例如化合物4在DMF和CH3OH溶液中荧光强度降低,表明除了其中等极性的发射CT状态外,化合物4具有极性更强的TICT状态,并且在极性较高的溶剂中激活TICT状态更有效,TICT状态的形成是化合物4的辐射激发态CT的主要淬灭过程,因此在DMF和CH3OH溶液中荧光几乎不发射。
λ/nm
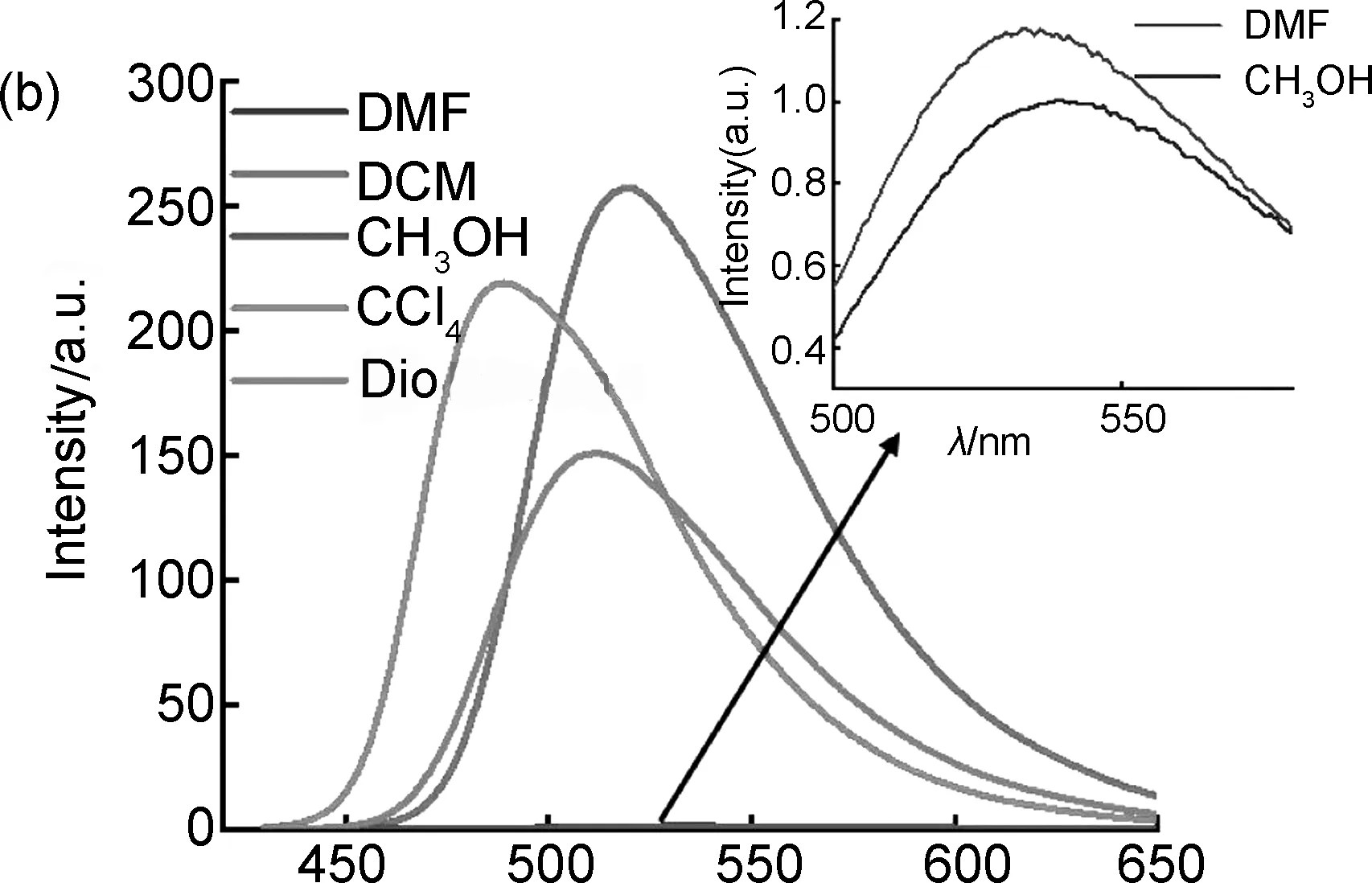
λ/nm图3 (a)化合物4在不同溶剂中的紫外可见吸收谱图(c=10 μM); (b)化合物4在不同溶剂中的荧光发射谱图(λ=418 nm, c=10 μM)Figure 3 (a) UV absorption spectra of compound 4 in different solvents.(c=10 μM); (b) Fluorescence emission spectra of compound 4 in different solvents(λex=418 nm, c=10 μM)
本文成功合成了一种新型固态荧光增强的萘酰亚胺衍生物(4),并研究了其在不同溶剂中的紫外吸收光谱与荧光光谱。结果表明,化合物4在极性溶剂更趋向于形成TICT态,导致其荧光较弱而在非极性溶剂中荧光较强;化合物4的固态荧光明显强于前驱体3的固态荧光,表明取代基体积较大时可以更有效抑制分子的面对面堆积,并且处于固态时能抑制扭曲的分子内电荷转移,从而增强荧光发射。

