可见光催化胺的氧化自偶联合成亚胺
杨 雨, 王景芸, 陈 阳
(辽宁石油化工大学 石油化工学院,辽宁 抚顺 113001)
亚胺作为重要的氮源之一,在药物和生物合成中为重要的含氮活性中间体[1],可用于合成多种被广泛用作抗癌和抗炎的生物活性化合物[2]。同时,亚胺在C—H键活化反应、氮丙啶化、环化和缩合反应中也具有潜在的应用价值[3-5]。传统的亚胺合成是胺与羰基官能团化合物在酸性条件下进行反应,通常需要不稳定的醛和酸作为催化剂,并且涉及加热、有毒氧化剂(如2-碘苯甲酸)和脱水剂等条件[6-8]。然而这些条件均不可避免地造成了能源浪费和环境污染等问题。
从绿色化学的角度来看,利用分子氧作为氧化剂直接光催化氧化胺合成亚胺具有更好的可持续性。虽然部分贵金属光催化剂(如钌和铱)在氧气作氧化剂的条件下,具有良好的反应性[9-10],但它们的价格昂贵且难以回收利用,因而在催化合成中的应用受到极大限制。在过去几年里,研究人员开发了基于绿色光催化剂的光催化氧化胺合成亚胺的反应,从而为解决能源浪费和环境污染问题提供了借鉴。例如,有机染料曙红Y、卟啉和三苯胺等[11-13],因其价格便宜且毒性小,可用作光催化剂取代贵金属催化剂。蒽醌类小分子化合物作为一种有机染料,因其结构中的前沿轨道羰基会在光激发时经历从n→π*或π→π*跃迁到激发单重态,并通过系统间交叉迅速转移到三重态。处于三重态的受激分子显示出双自由基特征,该特征可活跃地提取环境中脆弱的氢并形成半醌自由基。在有氧条件下,半醌自由基将被氧分子捕获,以产生原始的蒽醌结构,并随之形成过氧化氢和羟基自由基[14]。因此,蒽醌及其衍生物也可作为光催化剂。
Scheme 1
虽然利用光催化合成亚胺的方法已有研究[15-17],但以蒽醌类化合物作为光催化剂合成亚胺鲜有报道。本文首次以蒽醌-2-羧酸小分子化合物作为光催化剂,对光催化下胺类化合物(1a~1k)自偶联合成亚胺的反应进行了研究(Scheme 1)。通过对反应条件进行优化得到了最佳绿色环保的反应条件,讨论了不同电子效应的取代基对反应产率的影响。最后,在最佳条件下合成了11种不同取代基的亚胺化合物,分析了该反应发生的可能机理。
1 实验部分
1.1 仪器与试剂
WRS-3型熔点仪;Bruker AVANCE 400型核磁共振仪(CDCl3为溶剂,TMS为内标)。
所用试剂均为分析纯。
1.2 2a~2k的合成
在25.0 mL史兰克管中加入1(0.5 mmol)、蒽醌-2-羧酸(AQ-2-COOH, 2%,摩尔分数,下同)和乙酸乙酯(5.0 mL)。在室温下使用12 W紫色LED灯照射反应并通过TLC(薄层色谱法)监测。反应结束后通过硅胶柱层析(洗脱剂:石油醚 ∶乙酸乙酯=15 ∶1~10 ∶1,V∶V)纯化得目标产物2a~2k。
N-苄基-1-苯基甲亚胺(2a)[18]:无色液体90.8 mg,产率93%;1H NMRδ: 8.40(s, 1H), 7.81~7.75(m, 2H), 7.46~7.38(m, 3H), 7.34(d,J=4.4 Hz, 4H), 7.31~7.22(m, 1H), 4.83(s, 2H);13C NMRδ: 162.0, 139.3, 136.1, 130.7, 128.6, 128.5, 128.2, 128.0, 127.0, 65.0。
N-(4-甲基苄基)-1-(对甲苯基)甲亚胺(2b)[18]:无色液体102.7 mg,产率92%;1H NMRδ: 8.33(s, 1H), 7.66(d,J=7.9 Hz, 2H), 7.26~7.19(m, 4H), 7.14(d,J=7.6 Hz, 2H), 4.76(s, 2H), 2.38(s, 3H), 2.33(s, 3H);13C NMRδ: 161.7, 140.9, 136.5, 136.3, 133.6, 129.3, 129.1, 128.2, 127.9, 64.8, 21.5, 21.1。
N-(4-甲氧基苄基)-1-(4-甲氧基苯基)甲亚胺(2c)[18]:黄色油状液体114.9 mg,产率90%;1H NMRδ: 8.30(s, 1H), 7.71(d,J=8.8 Hz, 2H), 7.24(d,J=9.2 Hz, 2H), 6.90(dd,J=17.0, 8.7 Hz, 4H), 4.72(s, 2H), 3.84(s, 3H), 3.80(s, 3H);13C NMRδ: 161.7, 160.9, 158.6, 131.7, 129.8, 129.2, 129.1, 114.0, 113.9, 64.4, 55.34, 55.29。
N-(4-氟苄基)-1-(4-氟苯基)甲亚胺(2d)[18]:黄色油状液体98.3 mg,产率85%;1H NMRδ: 8.33(s, 1H), 7.81~7.72(m, 2H), 7.32~7.25(m, 2H), 7.12~6.99(m, 4H), 4.75(s, 2H);13C NMRδ: 165.6, 163.2(d,JC,F=5.0 Hz), 160.6,(d,JC,F=28.2 Hz), 134.9(d,JC,F=3.2 Hz), 132.3(d,JC,F=3.0 Hz), 130.1(d,JC,F=8.5 Hz), 129.4(d,JC,F=7.9 Hz), 115.7(d,JC,F=21.7 Hz), 115.3(d,JC,F=21.2 Hz), 64.1;19F NMRδ: -109.21, -115.95。
N-(4-氯苄基)-1-(4-氯苯基)甲亚胺(2e)[18]:白色固体113.6 mg,产率86%; m.p. 64.7~65.6 ℃;1H NMRδ: 8.34(s, 1H), 7.71(d,J=8.4 Hz, 2H), 7.39(d,J=8.4 Hz, 2H), 7.32(d,J=8.8 Hz, 2H), 7.27(d,J=6.2 Hz, 2H), 4.77(s, 2H);13C NMRδ: 160.8, 137.6, 136.9, 134.4, 132.8, 129.4, 129.2, 128.9, 128.6, 64.1。
N-(4-溴苄基)-1-(4-溴苯基)甲亚胺(2f)[18]:白色固体155.3 mg,产率88%; m.p. 91.2~92.1 ℃;1H NMRδ: 8.25(s, 1H), 7.57(d,J=8.4 Hz, 2H), 7.48(d,J=8.8 Hz, 2H), 7.39(d,J=8.4 Hz, 2H), 7.13(d,J=8.4 Hz, 2H), 4.67(s, 2H);13C NMRδ: 161.0, 138.1, 134.9, 131.9, 131.6, 129.7, 129.6, 125.4, 120.9, 64.2。
N-(3,4-二氯苄基)-1-(3,4-二氯苯基)甲亚胺(2g)[2]:黄色油状液体140.8 mg,产率85%;1H NMRδ: 8.30(s, 1H), 7.89(d,J=2.0 Hz, 1H), 7.60z(dd,J=8.4 Hz, 2.0 Hz, 1H), 7.50(d,J=8.0 Hz, 1H), 7.41(d,J=8.4 Hz, 2H), 7.17(dd,J=8.2 Hz, 1.8 Hz, 1H), 4.75(s, 2H);13C NMRδ: 160.0, 139.1, 135.7, 135.1, 133.2, 132.6, 131.1, 130.7, 130.5, 129.8, 127.3, 127.2, 63.5。
N-(4-(三氟甲基)苄基)-1-(4-(三氟甲基)苯基)甲亚胺(2h)[19]:黄色油状液体139.9 mg,产率84%;1H NMRδ: 8.46(s, 1H), 7.91(d,J=8.4 Hz, 2H), 7.69(d,J=8.4 Hz, 2H), 7.61(d,J=8.0 Hz, 2H), 7.47(d,J=8.0 Hz, 2H), 4.90(s, 2H);13C NMRδ: 161.1, 143.0, 139.0, 132.6(d,J=32.2 Hz), 129.5(d,J=32.3 Hz), 128.5, 128.1, 125.6(q,J=3.8 Hz), 125.5(q,J=3.8 Hz), 122.7(d,J=33.1 Hz), 64.4;19F NMRδ: -62.47, -62.84。
1-(萘-1-基)-N-(萘-1-基甲基)甲亚胺(2i)[18]:白色固体128.5 mg,产率87%; m.p. 69.5~70.1 ℃;1H NMRδ: 9.02(s, 1H), 8.92(d,J=8.4 Hz, 1H), 8.21(d,J=8.0 Hz, 1H), 7.92~7.75(m, 5H), 7.58~7.40(m, 7H), 5.36(s, 2H);13C NMRδ: 161.9, 135.5, 133.8, 133.7, 131.6, 131.3, 131.1, 129.1, 128.6, 128.5, 127.8, 127.1, 126.1, 126.0, 125.8, 125.6, 125.5, 125.2, 124.4, 123.9, 63.2。
1-(噻吩-2-基)-N-(噻吩-2-基甲基)甲亚胺(2j)[20]:黄色液体95.4,产率92%;1H NMRδ: 8.40(s, 1H), 7.39(d,J=4.8 Hz, 1H), 7.31(dd,J=3.6 Hz, 1.2 Hz, 1H), 7.22(dd,J=4.8 Hz, 1.6 Hz, 1H), 7.05(dd,J=4.8 Hz, 3.6 Hz, 1H), 6.99~6.94(m, 2H), 4.93(s, 2H);13C NMRδ: 155.3, 142.1, 141.5, 130.9, 129.3, 127.3, 126.8, 125.2, 124.8, 58.4。
1-(呋喃-2-基)-N-(呋喃-2-基甲基)甲亚胺(2k)[18]:黄色液体79.7 mg,产率91%;1H NMRδ: 8.11(s, 1H), 7.51(d,J=2.0 Hz, 1H), 7.38(dd,J=1.6 Hz, 0.8 Hz, 1H), 6.79(d,J=3.6 Hz, 1H), 6.49~6.45(m, 1H), 6.35~6.33(m, 1H), 6.27(dd,J=3.2 Hz, 0.8 Hz, 1H), 4.75(s, 2H);13C NMRδ: 151.8, 151.5, 151.2, 144.9, 142.3, 114.4, 111.6, 110.3, 107.9, 56.8。
2 结果与讨论
2.1 反应条件优化
(1) 溶剂对反应的影响
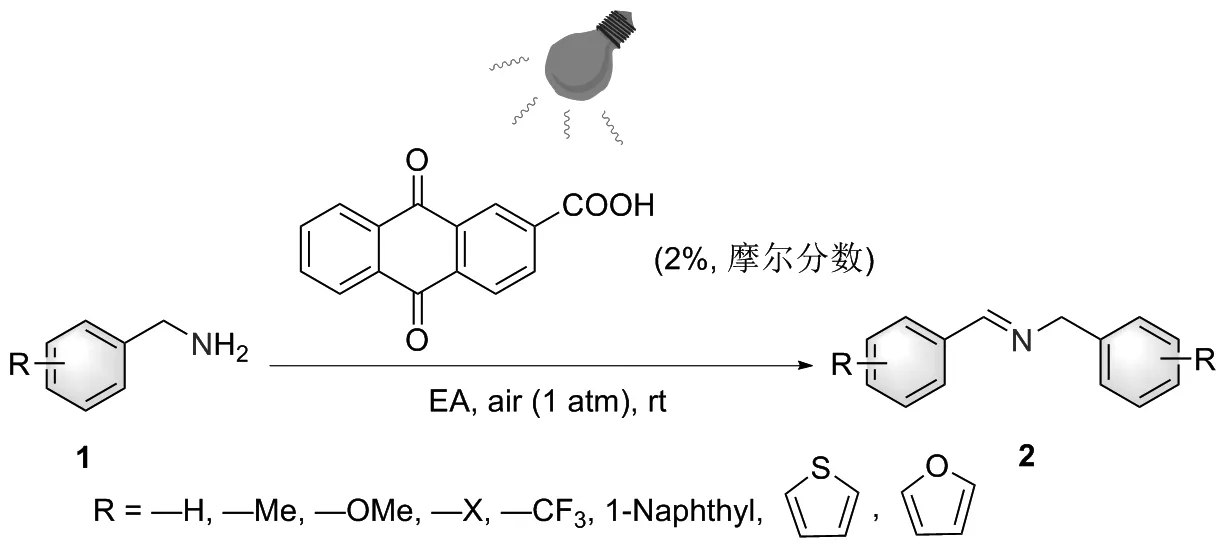
以苄胺为反应底物,5%蒽醌-2-羧酸为光催化剂,12 W紫色LED灯为光源,在空气气氛的室温下进行照射,考察溶剂对反应产率的影响,其结果如表1所示。由表1可知,当以1,4-二氧六环和丙酮作为溶剂时,反应不发生(N.R);当以1,2-二氯乙烷(DCE)、异丙醇(IPA)和二氯甲烷(DCM)作为溶剂时,反应能够发生,但产率不高,分别为44%、 47%和48%;以乙醇(EtOH),甲醇(MeOH)和乙腈(MeCN)作为溶剂时,反应的产率有一定提升,可分别达到79%、 88%和90%。而当以乙酸乙酯(EA)作为溶剂时,反应的产率达到最大值94%。因此,选择乙酸乙酯作为该反应最佳溶剂来进行后续研究工作中条件的进一步优化。
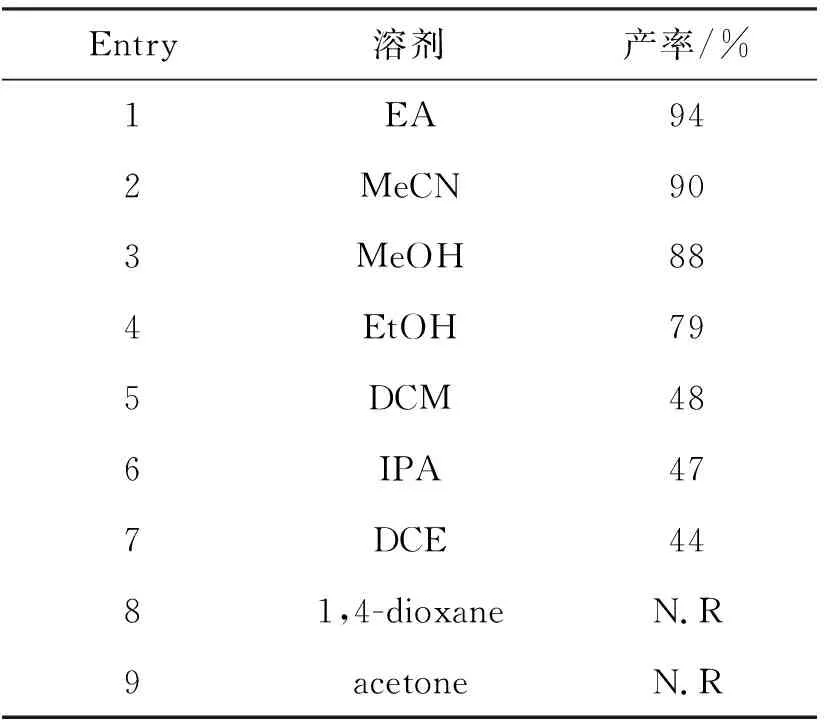
表1 不同溶剂对反应的影响Table 1 Effects of different solvents on reaction
(2) 光催化剂种类及用量对反应的影响
基于以上优化实验,以苄胺为反应底物,乙酸乙酯作为溶剂,12 W紫色LED灯为光源,在空气气氛的室温下进行照射,考察光催化剂种类及用量对反应的影响,其结果如表2所示。结果表明,AQ-2-COOH是反应最佳的光催化剂,这可能是AQ-2-COOH在该反应体系中最易被激发,因而其催化反应的效果最好。从表2中可以看出,当AQ-2-COOH用量仅为2%时,在此条件下反应产率仍可高达93%(Entry 1、 Entry 6)。

表2 催化剂种类及用量对反应的影响Table 2 Effects of catalyst type and dosage on reaction
(3) 光源种类对反应产率的影响
在得到最佳溶剂、光催化剂及其用量后,基于此条件对反应的光源进行了考察,其结果如表3所示。结果表明,在红色和黄色LED光源下该反应不发生,而在蓝色LED灯照射下,反应产率只有13%,在白色LED灯照射下,反应产率可达67%,由此可以看出,以上不同颜色的光源下的反应产率均低于紫色LED灯作为光源时的产率,该现象是由于光催化剂AQ-2-COOH的最大激发波长处在紫色LED光源的波长范围之内,AQ-2-COOH可以更好的被激发来催化反应的进行。因此,本文将紫色LED作为反应的最佳光源。

表3 LED光源对反应的影响Table 3 Effects of different LED Lights on reaction
(4) 其他背景条件对反应的影响
为了更全面地分析该反应的影响因素,考察了其他背景条件(催化剂、避光与否、气体和反应温度)对反应的影响,其结果如表4所示。由表4可以看出,反应在无光催化剂或光源下不发生,说明光催化剂和光源是反应发生的必需条件,即该反应为光反应。此外,该反应在氮气气氛下不发生,而在氧气或空气气氛下反应可以发生,说明反应过程中需有氧气参与,即该反应需有氧化剂才能发生。由于在氧气或空气气氛下反应产率接近,但空气气氛下反应的实验成本更低且操作更简便,选择在空气气氛下进行反应。室温下的反应产率与50 ℃和回流温度下的产率接近,表明温度对反应的影响不明显,即反应可以在室温下进行。
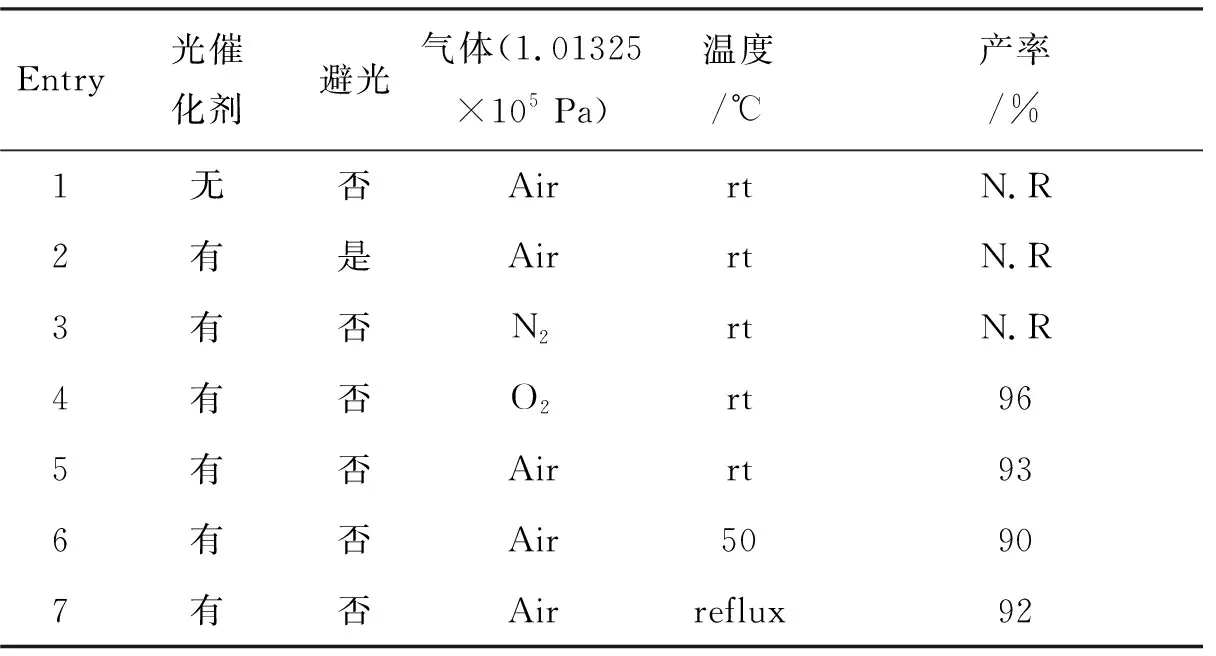
表4 背景条件对反应的影响Table 4 Effects of background condition on reaction
综上所述,反应的最优条件为:乙酸乙酯为溶剂,AQ-2-COOH(2%)为光催化剂,12 W紫色LED灯为光源,空气气氛室温下进行反应。

Scheme 2
2.2 底物普适性
在确定最佳反应条件之后,对该反应进行了底物普适性研究,其结果如表5所示。由表5可以看出,在最佳反应条件下拓展了11个带有不同取代基的亚胺类化合物,讨论供电子效应、吸电子效应及杂原子底物对反应产率的影响。以苄胺(1a)为原料,反应以93%的产率得到了无取代基的目标产物N-苄基-1-苯基甲亚胺(2a)。当底物为带有供电子效应的甲基、甲氧基时,反应以92%和90%的产率得到了相应的目标产物2b和2c。带有吸电子效应的底物也以84%~88%的产率得到了相应的目标产物2d~2h。近中性带有萘基的底物以87%的产率得到了目标产物2i,而含有杂原子的底物以92%和91%的产率得到了目标产物2j和2k。以上实验结果表明,无论底物带有供电子还是吸电子取代基,反应都能够很好的进行,并且能够以良好至优秀的产率得到相应的目标产物,因此该反应具有良好的底物普适性。
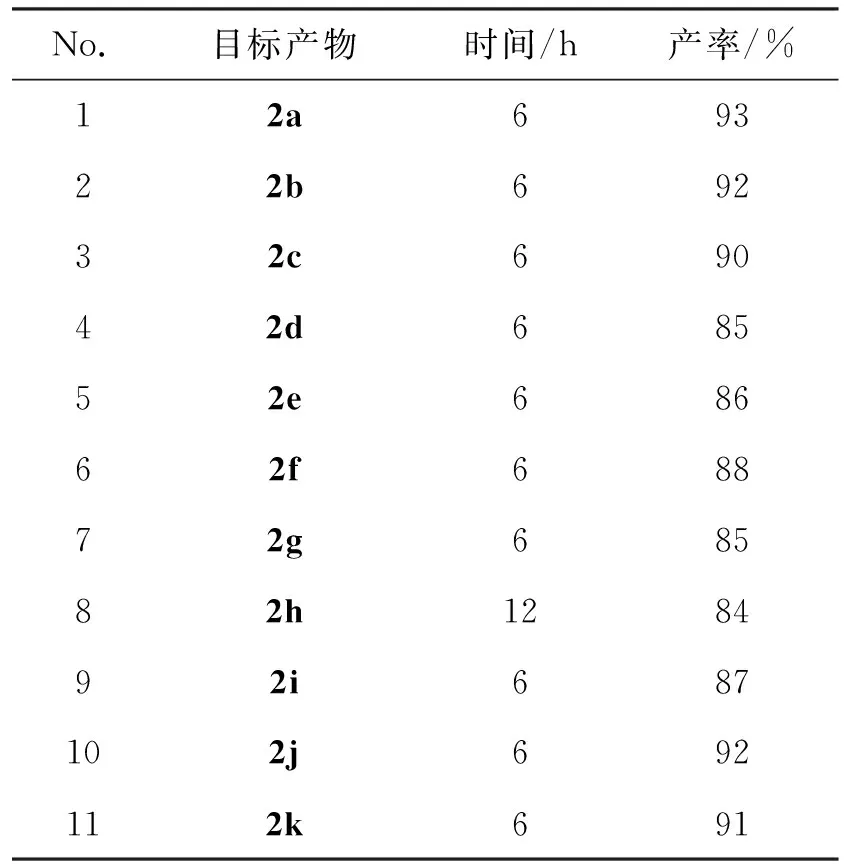
表5 底物普适性研究Table 5 Substrate universality research
2.3 反应机理

本文以带有不同取代基的苄胺为原料,首次以AQ-2-COOH为光催化剂,空气中的氧气为氧化剂,利用有机光催化方法合成了不同取代基的亚胺化合物(2a~2k),产率84%~93%。底物拓展实验表明了该反应具有良好的底物普适性,并分析了反应可能发生的机理,为有机光催化领域内绿色合成亚胺类化合物提供了研究依据。

