慢性乙型肝炎患者肝组织PI3K/Akt/mTOR信号通路与HBV病毒载量及肝纤维化程度关系
蔺 萍 金 梅
湖北文理学院附属医院,襄阳市中心医院N医学检验部 (湖北 襄阳, 441000)
乙型肝炎病毒(HBV)属嗜肝DNA病毒家族,是一种小的、有包膜的部分双链DNA病毒, HBV持续感染是慢性乙型肝炎(CHB)、肝纤维化、肝硬化、原发性肝癌等慢性肝病的重要致病因素[1,2]。肝纤维化是肝细胞坏死或炎症刺激时肝内纤维结缔组织异常增生的病理过程,大多数慢性肝病都伴有肝纤维化,其中约25%发展为肝硬化甚至肝癌[3-6]。磷脂肌醇3-激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白(PI3K/Akt/mTOR)信号通路活化可以抑制细胞凋亡,促进细胞周期进展、细胞生存和增殖,同时参与血管形成,被证实与肝纤维化的发展密切相关[7-9]。本研究旨在观察PI3K/Akt/mTOR信号通路与CHB患者肝纤维化和病毒载量的相关性,报道如下。
1 资料与方法
1.1 研究对象 2019年4月至2021年4月在本院行肝穿刺的CHB患者74例,男49例,女25例;年龄39~75岁,平均63.78±7.15岁。另选取同期接受肝穿刺检查的非酒精性脂肪性肝病患者20例作为对照组,男13例,女7例;年龄36~72岁,平均61.93±7.45岁。两组患者性别和年龄比较,差异无统计学意义(P<0.05)。本研究经医院医学伦理委员会审核。
1.2 纳入及排除标准 纳入标准:(1)CHB患者纳入标准:①符合《CHB防治指南(2019年版)》[10]的诊断标准;(2)非酒精性脂肪性肝病患者纳入标准:① 符合《非酒精性脂肪性肝病防治指南(2018年更新版)》[11]诊断标准;(3)接受肝穿刺活检;(4)签署知情同意书。
排除标准:(1)CHB患者排除标准:① 有饮酒习惯(女性>20 g/d,男性>40 g/d)或酒精性肝炎;②其他病毒性肝炎;③合并恶性肿瘤;④近2个月内使用过抗病毒治疗或其他影响免疫功能的药物者。(2)非酒精性脂肪性肝病患者排除标准:①病毒性或酒精性肝炎;②合并恶性肿瘤。
1.3 肝组织病理学检查 在MX-01000305型彩色超声诊断仪(南京贝登疗股份有限公司)的引导下,行经皮肝脏穿刺术,获取肝组织(长度>1.0 cm),行病理学检查。交由2名经验丰富的病理科主治医师阅片,参照文献[11],将74例CHB患者按纤维化程度分为S0~S4级,其中S0为无肝纤维化病变,S4为肝硬化。
1.4 免疫组化检测 肝组织切片行常规HE复染确认,切片经烤片、脱蜡、水化后,TBST冲洗3 min×3次。抗原热修复:将切片浸泡于柠檬酸盐热修复液中,经高压煮沸2 min,然后室温放置自然冷却。TBST冲洗1次。阻断内源性过氧化物酶:甩去TBST液,每张切片滴加3% H2O2溶液,室温下孵育10 min。甩去3% H2O2溶液,TBST冲洗3 min×3次。封闭非特异性结合:甩去TBST液,每张切片滴加5% BSA溶液,室温孵育1 h。甩去5% BSA液,每张切片滴加100 μl相应的一抗:兔抗人p-PI3K、兔抗人p-Akt和兔抗人p-mTOR(美国Cell signaling Techmology公司生产),将切片置于室温下孵育1 h。甩去一抗,TBST冲洗3 min×3次。每张切片上滴加100 μl新鲜配制的DAB显色溶液,显微镜下观察显色情况,显色时间为2~3 min。自来水冲洗终止显色,苏木精复染3 min,1% 盐酸酒精分化数秒,自来水冲洗返蓝5 min。梯度酒精脱水干燥、二甲苯透明后,中性树胶封固。显微镜下观察结果。以PBS代替一抗作为阴性对照,已知的STAT3阳性标本为阳性对照。
判定标准:观察高倍(×400)视野下阳性细胞百分数及染色强度,阳性细胞占比≤5%为0分、6%~25%计1分、26%~50%计2分、51%~75%计3分、≥76%计4分;细胞未染色计0分、淡黄色为1分、棕黄为2分、棕褐为3分。总分=细胞染色评分×细胞占比评分,总分≥3分即为阳性表达。结果评判由2人进行双盲读片确定。
1.5 血清HBV DNA载量检测 利用PE-5700荧光定量PCR仪对CHB患者血清HBV DNA载量进行检测(试剂盒购自中山达安基因中心)按照试剂盒说明书操作,依据HBV DNA标准品建立计算曲线,由专用软件自动分析,读取样本HBV拷贝数。

2 结果
2.1 两组患者肝组织PI3K/Akt/mTOR信号通路蛋白阳性率比较 见表1。
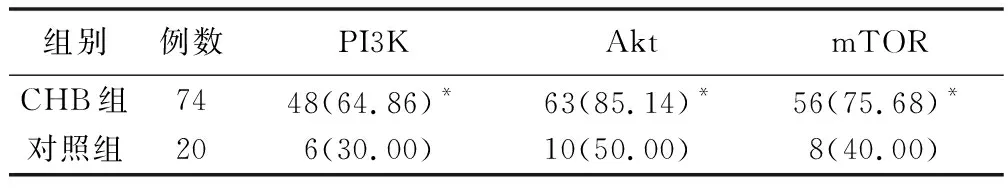
表1 两组患者肝组织PI3K/Akt/mTOR信号通路蛋白阳性率 [例(%)]
2.2 不同肝纤维化程度CHB患者PI3K/Akt/mTOR信号通路蛋白阳性率比较 见表2。
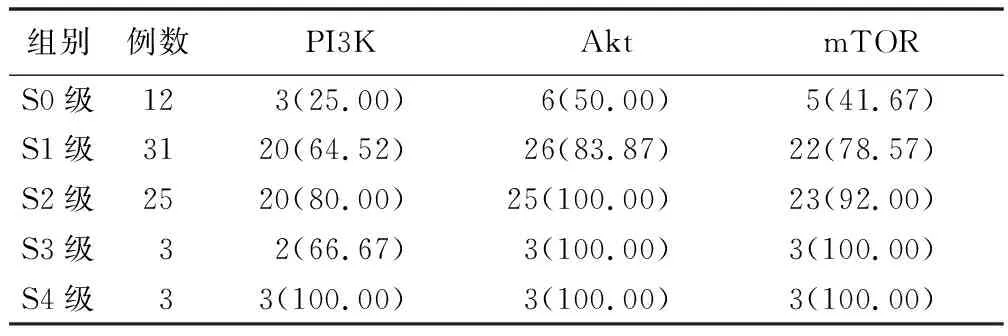
表2 不同肝纤维化程度CHB患者PI3K/Akt/mTOR信号通路蛋白阳性率 [例(%)]
2.3 不同HBV DNA载量CHB患者PI3K/Akt/mTOR信号通路蛋白阳性率比较 根据HBV DNA载量将CHB患者分为4组,<104IU/ml组26例,104~105IU/ml组21例,105~106IU/ml组20例,>106IU/ml组7例;4组患者肝组织PI3K、Akt、mTOR蛋白阳性表达率比较,差异有统计学意义(P<0.05),随HBV DNA载量增加,PI3K、Akt、mTOR蛋白阳性表达率呈升高趋势。见表3。
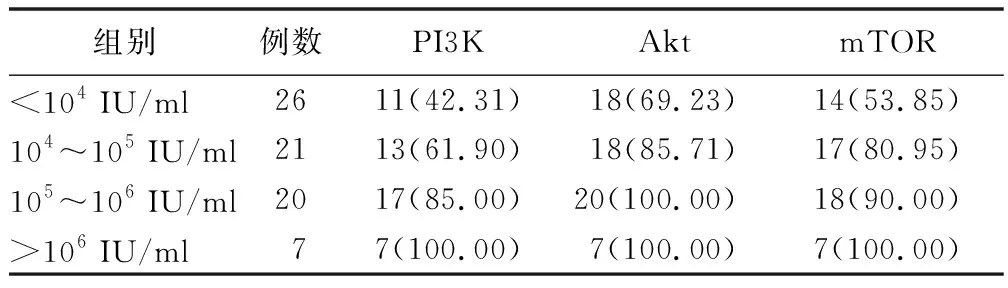
表3 CHB患者不同HBV DNA载量PI3K/Akt/mTOR信号通路蛋白阳性率 [例(%)]
3 讨论
PI3K是由调控亚基p85和催化亚基p110组成的异二聚体,当细胞受到生长因子的刺激,PI3K被激活和聚集在细胞膜,使3,4-二磷脂酰肌醇向3,4,5-三磷脂酰肌醇转化,而3,4,5-三磷脂酰肌醇充当第二信使激活其下游Akt[12,13]。Akt是一种进化上高度保守的丝氨酸/苏氨酸蛋白激酶,主要位于静止状态的细胞质中,又称蛋白激酶B,在哺乳动物细胞中有三种Akt异构体,大部分具有相同的功能;PI3K生成3,4,5-三磷脂酰肌醇后,可与Akt的PH结构域作用,使Akt聚集到细胞膜,通过3-磷脂酞肌醇依赖性蛋白激酶l将其Thr305位点磷酸化,以及梭基端的Ser473磷酸化,激活后的磷酸化Akt(p-Akt)蛋白再转位到胞浆中或胞核内,随后磷酸化其一系列底物,从而达到调控细胞存活和凋亡的目的[14]。mTOR是哺乳动物细胞内Akt信号分子下游雷帕霉素作用的靶点,激活后的Akt可以通过直接直接磷酸化mTOR的ser2448位点而激活mTOR,还能通过抑制结节性硬化复合物和TSCI形成复合物,激活mTOR信号[15,16]。
PI3K/Akt/mTOR信号转导通过影响下游效应分子的活化,参与细胞增殖、凋亡、分化、代谢等一系列重要生理活动。近年在许多恶性肿瘤中发现PI3K/Akt/mTOR信号通路的异常激活,提示PI3K/Akt/mTOR信号通路可能与肿瘤细胞增殖和凋亡密切相关,目前该通路在CHB患者肝纤维化中的研究较少[17]。本研究中,CHB组患者PI3K、Akt、mTOR阳性表达率均显著高于对照组(P<0.05),提示与非酒精性脂肪性肝病患者相较,CHB患者PI3K/Akt/mTOR信号通路激活。随后,根据肝组织活检结果和肝纤维化分级,将CHB患者对应分组,发现随肝纤维化分级升高、HBV DNA载量增加,CHB患者PI3K、Akt、mTOR阳性表达率呈升高趋势,提示CHB患者体内PI3K/Akt/mTOR信号通路激活可能与病毒载量和肝纤维化程度相关,考虑原因是激活的PI3K/Akt/mTOR信号通路通过调节肝星状细胞的增殖和迁移、增加Ⅰ型胶原的表达、影响基质金属蛋白酶和组织金属蛋白酶抑制剂的平衡,促进肝纤维化形成和发展[18]。
综上所述,本研究提示CHB患者肝组织中存在PI3K/Akt/mTOR信号通路激活,其活化程度与血清HBV DNA病毒载量和肝纤维化程度相关。本研究对临床工作有一定参考价值,但本研究有待扩大样本量进行多中心、前瞻性研究,进一步探究PI3K/Akt/mTOR信号通路在CHB发展中的作用。

