安罗替尼联合注射用紫杉醇(白蛋白结合型)二线治疗晚期驱动基因阴性NSCLC患者的效果
施晓婧 刘卓 陈亚楠 韩雪
对于晚期驱动基因阴性非小细胞肺癌(NSCLC)患者的治疗目标是延长生存期,提高生存质量[1]。目前临床上可采用注射用紫杉醇(白蛋白结合型)进行二线治疗,该药物为新型白蛋白溶剂型纳米紫杉醇,可通过酸性分泌(SPARC)蛋白吸附于肿瘤细胞上,将细胞毒性药物注入肿瘤细胞,杀死肿瘤细胞,从而达到治疗目的。但由于晚期NSCLC患者病情较重,肿瘤细胞已扩散,单药化疗往往无法达到预期的治疗效果[2]。恶性肿瘤生长繁殖主要特征为血管生成,故可将抗血管生长作为肿瘤治疗的关键靶点[3]。安罗替尼是一种新型抗肿瘤靶向药物,可通过抑制血管生成因子受体,阻断酪氨酸激酶通路,发挥抑制肿瘤细胞血管生成的作用,与紫杉醇联合用于晚期驱动基因阴性NSCLC患者的治疗中可能效果更好。基于此,张家港市第一人民医院进行相关研究,现报道如下。
1 资料与方法
1.1 一般资料
选择本院2019年2月-2021年9月收治的68例晚期驱动基因阴性NSCLC患者,纳入标准:(1)符合文献[4]中晚期非小细胞肺癌诊断标准;(2)体力活动状态(ECOG)评分为0~2分,预计生存期在3个月以上;(3)经CT、磁共振等检查,检测全身病灶数≥1处;(4)肿瘤属驱动基因阴性。排除标准:(1)对本研究所用药物过敏;(2)既往3个月内有大咯血史;(3)凝血功能异常;(4)伴有血管侵犯或较难控制的高血压。按照随机数字表法分为两组,单药组34例,男25例,女9例;年龄43~75岁,平均(51.42±7.31)岁;ECOG评分0~2分,平均(1.12±0.32)分;病理分型:鳞状细胞癌11例,腺癌23例;转移部位:肺内8例,肝脏9例,骨髓6例,脑3例,胸膜3例,其他5例。联合组34例,男23例,女11例;年龄45~75岁,平均(51.33±7.47)岁;ECOG评分0~2分,平均(1.09±0.31)分;病理分型:鳞状细胞癌13例,腺癌21例;转移部位:肺内7例,肝脏10例,骨髓5例,脑4例,胸膜5例,其他3例。两组一般资料对比差异无统计学意义(P>0.05),有可比性。本研究已取得本院伦理委员会批准,获得患者及家属同意并签署知情同意书。
1.2 方法
单药组于化疗第1、8、15天静脉滴注注射用紫杉醇(白蛋白结合型)(江苏恒瑞医药股份有限公司,国药准字H20183378,规 格:100 mg)100 mg/m2,21 d为1个治疗周期。
联合组在单药组基础上予以口服盐酸安罗替尼胶囊(正大天晴药业集团股份有限公司,国药准字H20180002,规格:12 mg)12 mg/d,给药 2 周后停药1周,21 d为1个治疗周期。
两组均治疗2个周期,随访6个月。
1.3 观察指标及评价标准
观察两组的临床疗效、生存质量、生存状况及不良反应发生情况。(1)临床疗效:治疗2个周期后,若患者肺癌肿块完全消失为完全缓解;肺癌肿块缩小体积不小于1/2为部分缓解;肺癌肿块缩小体积小于1/2为疾病稳定;肺癌肿块体积不变或增大为疾病进展[5]。疾病控制率=(完全缓解+部分缓解+疾病稳定)例数/总例数×100%。(2)生存质量:采用肺癌患者生存质量量表(FACT-L)评价两组治疗前及治疗2个周期后的生存质量,该量表包括社会/家庭(0~28分)、情感(0~24分)、功能(0~28分)、生理(0~28分)及附加关注状况(0~32分)5个维度,其中社会/家庭、情感、功能得分越高,生存质量越好;生理及附加关注状况得分越高,生存质量越差[6]。(3)生存状况:随访6个月后,统计两组无进展生存率,其中无进展生存是指患者从接受治疗开始的6个月内并未观察到疾病进展或发生因任何原因而导致死亡。(4)不良反应发生情况:治疗期间,观察两组发生恶心呕吐、肝肾功能异常、胃纳差、中性粒细胞减少、脱发、血小板减少情况。
1.4 统计学处理
数据录入SPSS 22.0软件中分析,计量资料以(±s)表示,采用t检验,计数资料以率(%)表示,采用χ2检验,等级资料采用秩和检验,用Z值表示,P<0.05为差异有统计学意义。
2 结果
2.1 两组临床疗效对比
联合组的疾病控制率(85.29%)高于单药组(61.76%),差异有统计学意义(P<0.05),见表1。
2.2 两组生存质量对比
治疗前,两组社会/家庭、情感、功能、生理、附加关注状况得分对比差异无统计学意义(P>0.05);治疗2个周期后,两组社会/家庭、情感、功能得分均降低,但联合组高于单药组(P<0.05),两组生理、附加关注状况得分均升高,但联合组低于单药组(P<0.05),见表 2。
表2 两组生存质量对比[分,(±s)]

表2 两组生存质量对比[分,(±s)]
组别 社会/家庭 情感 功能治疗前 治疗2个周期后 治疗前 治疗2个周期后 治疗前 治疗2个周期后联合组(n=34) 16.34±2.83 14.27±2.16* 15.19±2.74 13.16±2.27* 17.41±2.47 15.39±2.34*单药组(n=34) 16.49±2.72 12.36±2.37* 15.81±2.63 11.54±2.46* 17.55±2.51 13.57±2.80*t值 0.223 3.473 0.952 2.822 0.232 2.908 P值 0.824 0.001 0.345 0.006 0.817 0.005

表2(续)
2.3 两组生存状况对比
联合组6个月内无进展生存率为58.82%(20/34),高于单药组的32.35%(11/34),差异有统计学意义(χ2=4.802,P=0.028)。
2.4 两组不良反应发生情况对比
联合组各类不良反应发生率与单药组对比,差异均无统计学意义(P>0.05),见表3。
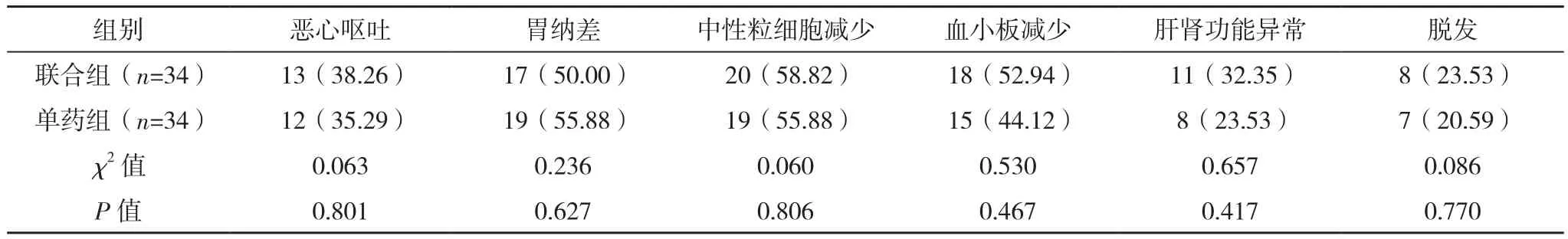
表3 两组不良反应发生情况对比[例(%)]
3 讨论
NSCLC标准一线治疗方案通常为含铂双药化疗,可延长生存期,改善生活质量[7]。目前,二线治疗可采用紫杉醇(白蛋白结合型),可由数个白蛋白结合紫杉醇纳米微粒进入肿瘤组织,抑制肿瘤细胞生长[8]。而有研究指出,血管生成在肿瘤进展中扮演重要角色,为了进一步提高NSCLC患者无进展生存率,可采取抗血管生成药物与紫杉醇联合应用作为临床治疗肿瘤的二线用药[9]。安罗替尼是一种新型人表皮生长因子酪氨酸酶抑制剂,具有较强的抗肿瘤血管生长作用,可减缓肿瘤病灶扩张进程,与紫杉醇(白蛋白结合型)联用可能有助于提高NSCLC患者无进展生存率[10]。
在本研究中联合组疾病控制率为85.29%,高于单药组的61.76%(P<0.05);联合组6个月内无进展生存率为58.82%,高于单药组的32.35%(P<0.05);说明两种药物联合用于二线治疗晚期驱动基因阴性NSCLC患者中,有助于提高疾病控制率,增加无进展生存率。可能的原因是白蛋白结合型紫杉醇是以白蛋白作为携带紫杉醇的载体。该药物为细胞毒类抗肿瘤药,作用机制是通过外层SPARC蛋白作为载体吸附肿瘤细胞后,将内层紫杉醇转运至肿瘤细胞中,以诱导和促进微管组装,干扰微管的正常动态重排,阻断细胞间期和有丝分裂过程,进而发挥抑制肿瘤细胞生长的作用[11]。安罗替尼是一种新型抗肿瘤药物,其抗肿瘤血管生长作用较强,主要是通过抑制血管内皮细胞、血小板源、成纤维细胞、干细胞、表皮细胞等细胞的生长因子受体,以降低在癌细胞中高表达的酪氨酸激酶活性,干扰肿瘤细胞内血管生成过程,阻遏肿瘤细胞生长,使其灭亡[12]。两者联用治疗晚期驱动基因阴性NSCLC患者可起到协同作用,可发挥较好的抗肿瘤作用,有助于提高临床疗效。徐珊珊等[13]通过对32例晚期驱动基因阴性NSCLC患者进行安罗替尼与紫杉醇联合治疗时发现,上述两种药物联用可提高疾病控制率及无进展生存率,临床效果较好,可进一步验证本研究。
在本研究中,联合组社会/家庭、情感、功能得分高于单药组,联合组生理、附加关注状况得分低于单药组(P<0.05),说明安罗替尼联合紫杉醇二线治疗NSCLC患者有助于改善患者生存质量,可能的原因是上述两种药物可分别从抑制肿瘤细胞生长和血管生成两方面协同发挥抗肿瘤作用,可有效延缓疾病发展,减轻疾病带来的痛苦,改善病理状态,延长生存期,提高生存质量。同时,在本研究中,联合组各类不良反应发生率与单药组对比差异无统计学意义(P>0.05),且杨炜[14]的研究中指出,对NSCLC患者使用安罗替尼联合注射用白蛋白结合型紫杉醇二线治疗,临床疗效确切,可缓解病情进展,不增加不良反应发生率,进一步说明对晚期驱动基因阴性NSCLC患者,使用罗替尼联合紫杉醇进行二线治疗安全性较好。
综上所述,将安罗替尼与紫杉醇(白蛋白结合型)联合用于晚期驱动基因阴性NSCLC患者的二线治疗中,有助于提高疾病控制率,改善生存质量,增加无进展生存率,且不增加不良反应发生率。

