加工方式对鱼饼小清蛋白免疫原性和致敏性的影响
周林杰,陆佳达,施文正,卢 瑛,*
(1.上海海洋大学食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心,上海 201306;3.农业农村部水产品贮藏保鲜质量安全风险评估实验室,上海 201306)
食物过敏是指过敏人群对食物过敏原的异常免疫反应,严重的食物过敏可能导致过敏性休克,危及生命[1],是当前世界上影响过敏人群健康的重要公共卫生问题。相关调查显示,世界上食物过敏人群数量逐年增长,约有8%的儿童和3%的成年人有不同程度的食物过敏症状[2]。根据联合国粮食及农业组织调查[3]显示,鱼类及其制品是过敏食物中的一大类,目前只能通过避免食用过敏食品或缓解过敏症状来控制。
鱼类的主要过敏原是小清蛋白(parvalbumin,PV),其分子质量为10~12 kDa,主要存在于鱼肌肉的肌浆蛋白中,大部分对鱼类及其制品的过敏反应是由PV引起的[4]。目前,消减PV的加工方法有多种,如通过美拉德反应对PV赖氨酸残基进行糖基化修饰,修饰后PV免疫原性下降[5]。高卿等[6]研究木糖葡萄球菌发酵对鲈鱼PV免疫原性的影响发现,发酵60 h后PV的免疫原性显著降低。此外,不同加工技术的组合可以更有效地降低水产品过敏原的致敏性,王丽娟等[7]发现经高压结合酶法处理的虾肉,其主要过敏原原肌球蛋白的免疫原性消减率达到97%。实验室前期研究发现高温高压技术可以显著降低虾类过敏原的致敏性,因此高温高压技术与乳酸菌发酵相结合可能会提供一种降低食物致敏性的新途径。
本研究分别采用加热、高温高压、副干酪乳杆菌(Lactobacillus paracasei)发酵和发酵-高温高压联合处理(简称F-HP)制备鱼饼,通过酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)和傅里叶变换红外光谱分析不同处理组鱼饼中主要过敏原PV的免疫原性和二级结构的变化,通过BALB/c小鼠过敏模型评价不同加工处理对PV致敏性的影响,以期为食物过敏原的控制与消减以及低致敏性鱼制品的开发提供科学依据。
1 材料与方法
1.1 菌种、动物、材料与试剂
副干酪乳杆菌为本课题组前期从奶豆腐中分离纯化。
BALB/c小鼠购自上海捷思捷实验动物有限责任公司,生产许可证号:SCXK(沪)2018-0004,本研究动物实验方法均经上海海洋大学动物保护评审委员会批准,批准编号:SHOU-DW-2021-003。
白鲢鱼 上海临港芦潮港水产市场;MRS(de Man-Rogosa-Sharpe )培养基 青岛海博生物技术有限公司;预染色和未染色的蛋白质标记物,3,3’,5,5’-四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine,TMB)显色液 上海碧云天生物技术有限公司;鼠抗PV单克隆抗体 无锡迪腾敏生物科技有限公司;二氨基联苯胺(diaminobenzidine,DAB)染色液 美国Sigma公司;羊抗鼠辣根过氧化物酶(horseradish peroxidase,HRP)标记免疫球蛋白(immunoglobulin,Ig)G上海威奥生物科技有限公司;羊抗鼠HRP-IgE抗体美国arigo公司;小鼠血清组胺、细胞因子(白细胞介素(interleukin,IL)-4、IL-5和IL-13)检测试剂盒上海酶免生物科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
Mini protean 4蛋白质电泳仪 美国Bio-Rad公司;AE-8135半干式转膜仪 日本ATTO公司;Powerlook 2100XL-MSB凝胶扫描仪 美国MMAX公司;Synergy2多功能酶标仪 美国BioTek公司;Z36HK高速冷冻离心机德国Hermle公司;TS-8脱色摇床 江苏海门其林贝尔仪器制造有限公司;MLS-3750高压灭菌锅 日本Sanyo公司。
1.3 方法
1.3.1 发酵菌种的培养
将副干酪乳杆菌接种在MRS液体培养基中,37 ℃恒温培养至稳定期,调整活菌数1×108CFU/mL以上,4 ℃、8 000 r/min离心20 min,收集沉淀,将菌体重悬于5 mL生理盐水中,4 ℃冷藏备用。
1.3.2 不同加工方式制备鱼饼
新鲜白鲢鱼除去鱼鳞、鱼鳃和内脏,清洗后采肉切块(3 cm×3 cm×2 cm)。将鱼肉粉碎并添加鱼肉质量分数3%的氯化钠和5%的葡萄糖,混匀后平铺在鱼饼模具中,然后采用不同加工方式制备鱼饼。加热组:100 ℃沸水蒸制15 min;高温高压处理组:置于高压灭菌锅,121 ℃分别处理10、20、30、40、50 min;发酵处理组:在鱼饼中接种1×108CFU/g副干酪乳杆菌,密封后置于30 ℃恒温培养箱中发酵12、24、36、48 h;F-HP处理组:将发酵12、24、36、48 h的鱼饼于高压灭菌锅中121 ℃处理20 min;上述鱼饼均保存在-20 ℃冰箱中备用。
1.3.3 鱼饼中小清蛋白的制备
参考文献[8]的方法,将分别取5 g不同处理组鱼饼,加入30 mL、4 ℃ Tris缓冲液(pH 7.4、0.1 mol/L,含0.5 mmol/L甘氨酸和0.1 mmol/L二硫苏糖醇,后同),均质处理1 min后得到蛋白粗提液。将粗提液于4 ℃冰箱放置12 h后10 000 r/min离心30 min,收集上清液。然后用Tris缓冲液溶解沉淀物,浸提5 h,4 000 r/min离心30 min,收集合并两次上清液得到鱼饼PV粗提液。用0.1 mol/L、pH 7.4(后同)磷酸盐缓冲液(phosphate buffered saline,PBS)透析24 h得到鱼饼PV富集液,冷冻干燥后得到不同处理组PV,于-20 ℃冰箱保存备用。取鱼肉粉碎后按照相同操作制备天然PV。
1.3.4 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳和免疫印迹分析
参考文献[9]的方法。分离胶质量分数12%,浓缩胶质量分数5%,标准蛋白上样量为8 μL,样品蛋白(加热组鱼饼的PV粗提液和富集液)上样量为10 μL。样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离后,用半干式转膜仪,200 mA反应20 min将蛋白转移到聚偏氟乙烯膜上。加入5 g/100 mL脱脂奶粉在37 ℃反应1 h,用含吐温-20的PBS(phosphate buffered salinetween,PBST)洗涤3 次。以PV的特异性单克隆抗体(1∶10 000)为一抗,孵育1 h。洗涤后以羊抗鼠HRP-IgG(1∶2 500)为二抗,孵育1 h。洗涤后加入DAB显色液显色,用去离子水洗去多余的显色液后拍照观察。
1.3.5 间接酶联免疫吸附试验测定PV的免疫原性
参考文献[10]的方法略作修改。取不同处理组PV和天然PV用50 mmol/L碳酸盐缓冲溶液(pH 9.6)配制质量浓度20 μg/mL溶液,以100 μL/孔加入酶标板中,4 ℃反应12 h。PBST洗涤3 次后加入5 g/100 mL脱脂奶粉(200 μL/孔),37 ℃孵育2 h。洗涤后以鼠抗PV单克隆抗体(1∶10 000)为一抗(100 μL/孔),37 ℃孵育1 h;洗涤后以羊抗鼠HRP-IgG(1∶5 000)为二抗(100 μL/孔),37 ℃孵育1 h,洗涤后加入TMB显色液(100 μL/孔)显色10 min后,加入2 mol/L的硫酸溶液(50 μL/孔)终止显色,用酶标仪测定450 nm波长处光密度(OD450nm)。以不含样品的50 mmol/L碳酸盐缓冲溶液作为阴性对照。按下式计算IgG结合能力消减率,以表征PV的免疫原性。
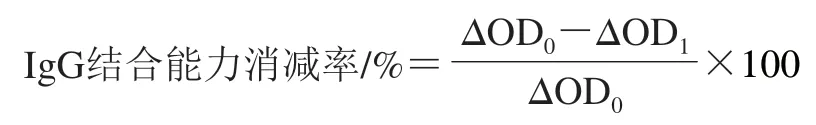
式中:ΔOD0为天然PV与阴性对照组OD450nm的差值;ΔOD1为其他处理组与阴性对照组OD450nm的差值。
1.3.6 傅里叶变换红外光谱分析
参考文献[11]的方法,加热组、高温高压组(121 ℃处理20 min)、发酵组(发酵48 h)和F-HP组(发酵48 h后121 ℃处理20 min)和天然PV冷冻干燥样品中加入KBr晶体(质量比1∶100)混合压成薄片,以空气为背景,在4 000~400 cm-1范围内采集光谱,每个样品重复扫描3 次。利用Peakfit软件对PV样品的红外光谱原始图进行基线校准、二阶导数处理,根据吸收峰的积分面积计算各二级结构相对含量。
1.3.7 BALB/c小鼠过敏模型的建立
参考文献[12]的方法略作修改,将30 只BALB/c雌性小鼠适应性喂养1 周后随机分为5 组(n=6),以PBS溶液为抗原设为阴性对照组,即PBS组;以不同处理组PV冻干粉末为抗原设为实验组。
1.3.7.1 致敏小鼠血清特异性IgE抗体水平的测定
第1、21、28天不同处理组小鼠分别腹腔注射100 μg相应处理组PV(用PBS配制2 mg/mL PV溶液,然后加入等体积弗氏完全佐剂振荡乳化),PBS组腹腔注射等体积PBS乳液。腹腔注射24 h后对各组小鼠进行尾尖采血,离心(4 000 r/min、20 min)收集血清。按照1.3.5节方法,以实验室前期提取纯化的鲢鱼PV为样品,采用间接ELISA法分析小鼠血清中IgE抗体水平的变化情况。将PV用50 mmol/L碳酸盐缓冲溶液(pH 9.6)稀释至5 μg/mL,一抗采用小鼠血清(1∶1 000),二抗采用羊抗鼠HRPIgE抗体(1∶2 500),测定OD450nm以表征IgE抗体水平。
1.3.7.2 灌胃激发后小鼠过敏表现评分及血清中组胺和Th2型细胞因子质量浓度的测定
参考文献[13]的方法并略作修改,第35天各组小鼠均灌胃0.5 mg加热组(100 ℃沸水蒸制15 min)、高温高压组(处理20 min)、发酵组(发酵48 h)和F-HP组(发酵48 h后高温高压处理20 min)PV(用PBS配制2 mg/mL PV溶液进行灌胃)激发小鼠。激发后1 h内观察小鼠过敏表现并评分,具体评分标准见表1。
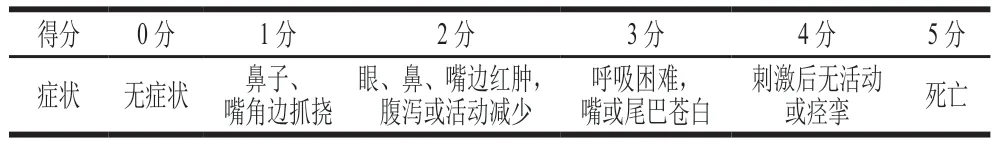
表1 小鼠过敏表现评分标准[13]Table 1 Criteria for evaluation of allergic symptoms in in mice[13]
激发24 h后采用放血法处死小鼠,取小鼠心脏部位血液,离心(4 000 r/min、20 min)收集血清,按照1.3.5节方法小鼠血清中IgE抗体水平(OD450nm),并分别参照相应ELISA试剂盒说明书测定致敏小鼠血清中的组胺和辅助型T细胞2(T helper 2 cell,Th2)型细胞因子(IL-4、IL-5和IL-13)的质量浓度。
1.4 数据处理与分析
结果均以平均值±标准差表示,采用SPSS 19.0软件进行单因素方差分析,采用Duncan多重比较进行显著性分析,P<0.05表示差异显著。采用Origin 2021软件作图。
2 结果与分析
2.1 加工方式对鱼饼免疫原性的影响
2.1.1 鱼饼粗提液和富集液PV的鉴定
加热组鱼饼PV粗提液和富集液的SDS-PAGE图谱如图1A所示,Jiang Xingyi等[14]研究报道PV分子质量为10~12 kDa,本研究鱼饼PV的主要条带在10 kDa处附近。免疫印迹结果如图1B所示,10 kDa处附近条带与PV的特异性单克隆抗体有反应,故该条带被鉴定为白鲢鱼的PV。
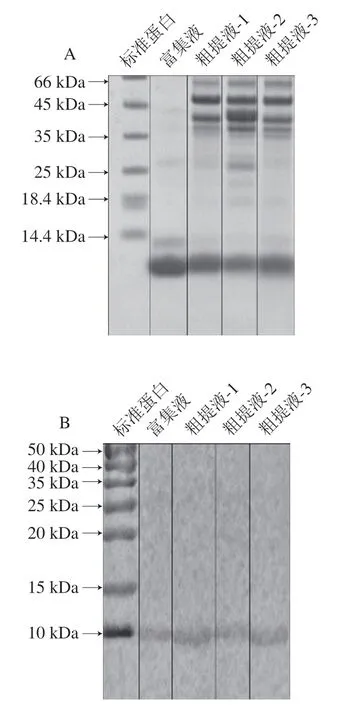
图1 鱼饼中PV粗提液和富集液的SDS-PAGE(A)和免疫印迹结果(B)Fig. 1 SDS-PAGE pattern (A) and Western blot pattern (B) of PV from fish cakes
2.1.2 加工方式对鱼饼中主要过敏原PV免疫原性和二级结构的影响
如图2所示,高温高压和发酵处理均可以降低鱼饼PV的免疫原性,其中高温高压处理时间20 min,副干酪乳杆菌发酵48 h和F-HP组发酵48 h后高温高压处理20 min的鱼饼中PV的IgG结合能力消减率最高,分别为50.6%、34.7%和68.5%,加热组消减率仅10.4%。研究发现,高温高压处理主要通过影响蛋白质分子的非共价相互作用如氢键和离子键等,间接或直接影响过敏蛋白质的结构[15]。由图2A可知,高温高压处理不同时间制备的鱼饼中PV的IgG结合能力消减率均高于30%,作用效果显著,其中处理20 min时鱼饼中PV的IgG结合能力消减率达到最大(50.6%)。如图2B所示,随发酵时间的延长,鱼饼中PV的IgG结合能力消减率逐渐增加,发酵48 h时达到34.7%。F-HP组制备的鱼饼中PV的IgG结合能力变化趋势与发酵组类似,发酵48 h时为68.5%(图2C)。Zhu Yidan等[16]采用植物乳杆菌发酵鱼肉,与发酵0 h相比,发酵48 h后鱼肉中PV的免疫原性降低了39.7%,本研究采用副干酪乳杆菌发酵鱼肉,随着发酵时间的延长,PV免疫原性逐渐降低(图2B、C)。不同处理组鱼饼中,发酵48 h F-HP组鱼饼中PV的免疫原性降低最大。
蛋白质红外光谱酰胺I带(1 700~1 600 cm-1)的特征振动频率主要取决于其氨基酸残基的C=O和N—H之间的氢键性质,可用于反映蛋白质二级结构中α-螺旋(1 650~1 658 cm-1)、β-折叠(1 610~1 640 cm-1)、β-转角(1 660~1 700 cm-1)及无规卷曲(1 640~1 650 cm-1)等结构相对含量[17]。由图2D可知,过敏原天然PV的二级结构中α-螺旋相对含量最高,β-折叠相对含量最少,分别为43.9%、9.0%。杨汝晴等[18]研究磷酸化对鲢鱼PV免疫原性的影响也发现,天然状态下PV的α-螺旋相对含量最高,β-折叠相对含量最少。加热组鱼肉PV二级结构中α-螺旋和β-折叠相对含量与天然PV相比没有明显变化,这可能是加热处理对鱼肉PV免疫原性影响很小的原因[18]。与天然PV相比,高温高压处理后鱼肉PV的α-螺旋相对含量降低了10.7%,而β-折叠相对含量增加了7.8%,β-转角和无规卷曲相对含量均有增加。有研究表明高温高压会导致PV的二级结构发生不可逆的变化从而掩盖其抗原表位[20]。如图2D所示,发酵处理后,发酵组PV的α-螺旋相对含量较天然PV降低了13.3%,而β-折叠、β-转角和无规卷曲相对含量均有增加,其中β-折叠相对含量增加了5.1%。肖叶等[21]利用植物乳杆菌及其不同成分提取物处理虾类原肌球蛋白,发现原肌球蛋白的α-螺旋相对含量明显减少,β-折叠相对含量显著增加,原肌球蛋白二级结构的变化影响了其免疫原性。因此推测副干酪乳杆菌发酵过程中的发酵产物对PV的表位有掩盖作用[22],从而降低了鱼饼中PV的免疫原性。与加热组相比,其他加工方式中F-HP处理后PV二级结构变化最大。与天然PV相比,F-HP处理后α-螺旋相对含量降低了17.3%,β-折叠相对含量增加了14.8%。
综上可知,加热、高温高压、发酵和F-HP处理对PV二级结构影响主要为α-螺旋解旋转变为β-折叠,PV结构的折叠化导致暴露的抗原表位被掩盖,影响了PV与抗体结合的能力,从而降低了PV蛋白的免疫原性。而单一的加热、高温高压和发酵处理对α-螺旋相对含量降低效果不如F-HP处理,PV的折叠化程度较低,因而相较于发酵48 h F-HP处理,高温高压和仅进行发酵处理PV的免疫原性消减率较低。
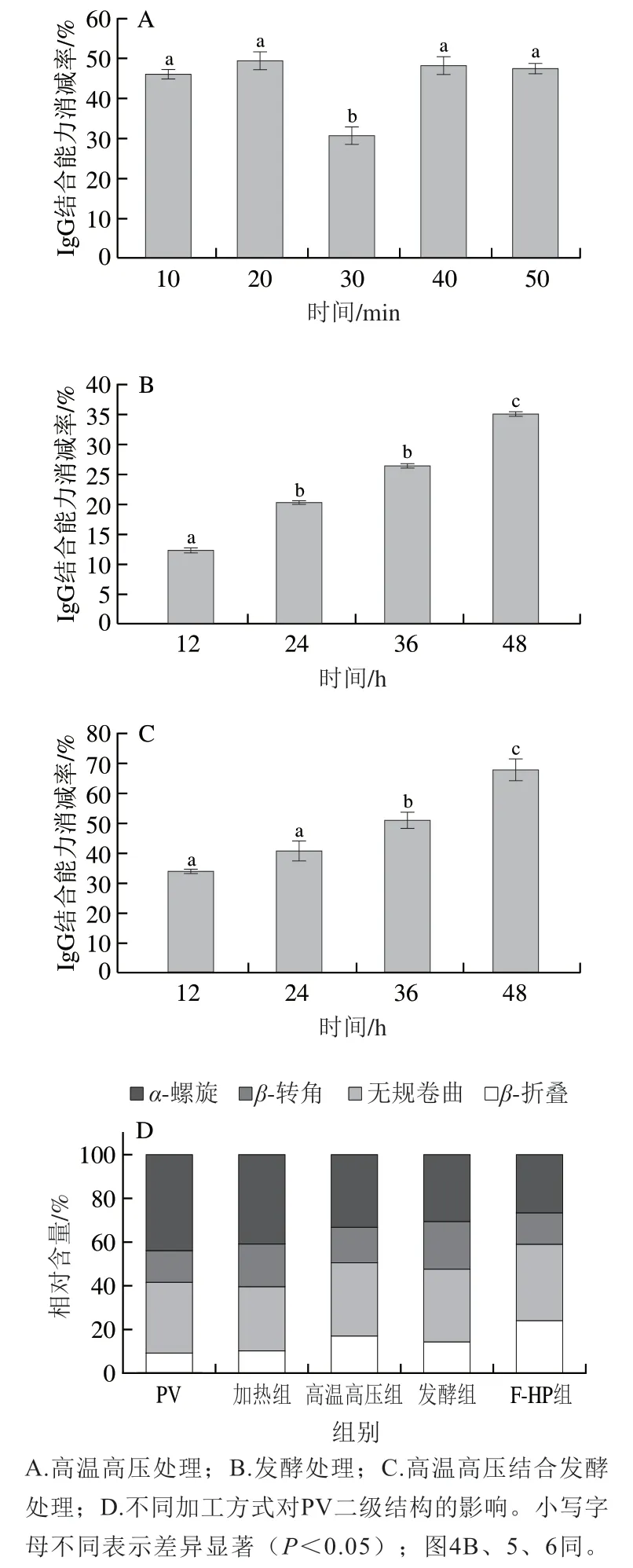
图2 加工方式对鱼饼中PV免疫原性和二级结构的影响Fig. 2 Effects of processing methods on the immunogenicity and secondary structure of PV from fish cakes
2.2 加工方式对鱼饼中主要过敏原PV致敏性的影响
采用BALB/c小鼠构建过敏动物模型,是评价过敏蛋白致敏性最直接的方法之一[23]。因此,本研究以PBS抗原作为阴性对照,各加工处理组鱼饼中PV冻干样品抗原作为实验组,构建BALB/c小鼠过敏模型,灌胃激发小鼠后1 h内观察小鼠过敏症状,发现过敏原刺激后小鼠出现抽搐、活动减弱等一系列症状[24]。各组小鼠的过敏反应评分结果如图3所示,加热组蛋白免疫的小鼠表现出不同程度的过敏症状,50%的小鼠出现了刺激后无活动的症状,1/3的小鼠出现呼吸困难或抽搐等症状。PBS组2/3的小鼠无过敏症状。高温高压组小鼠2/3出现腹泻或活动减少的症状,50%的发酵组小鼠也出现类似现象,而F-HP组2/3的小鼠过敏症状整体表现出轻微的症状。从过敏症状评分结果来看,不同加工处理后鱼饼PV导致的小鼠过敏症状都有不同程度降低,其中F-HP组小鼠整体过敏症状最轻。
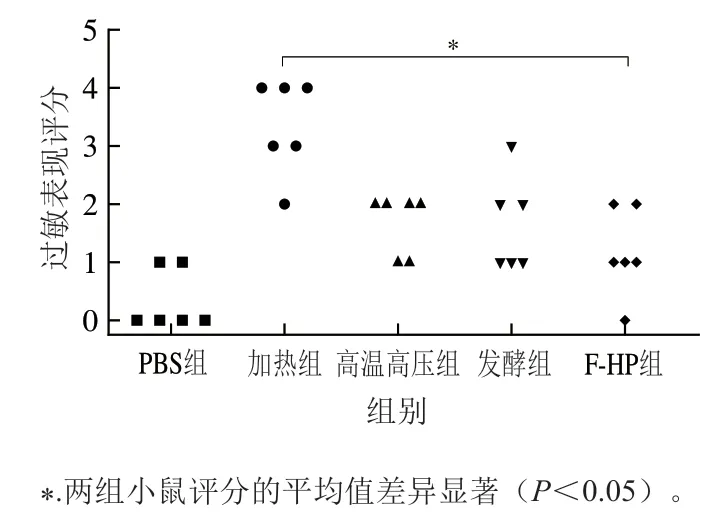
图3 小鼠模型的过敏表现评分(n=6)Fig. 3 Symptom scores of allergen-induced anaphylactic reactions in mouse model (n = 6)
血清中IgE抗体水平是评价过敏原致敏性的重要指标[25]。本研究测定了小鼠过敏模型构建过程小鼠血清中IgE水平,由图4A可见,PBS组免疫小鼠血清IgE抗体水平无明显变化,而加热组IgE抗体水平随免疫时间延长逐渐增加。结合上述加热组过敏症状评分结果可知,BALB/c小鼠过敏模型构建成功。如图4B所示,第35天灌胃不同处理组PV激发后,加热组小鼠血清中IgE抗体水平(0.766)最高;而高温高压组、发酵组和F-HP组的IgE抗体水平均显著高于PBS对照组,但显著低于加热组(P<0.05);其中F-HP组IgE抗体水平(0.349)最低,比加热组降低了54.4%。由此可知,相比于单一加工处理,F-HP组鱼饼中PV致敏性降低最为显著(P<0.05)。
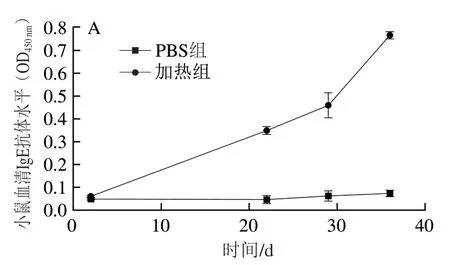
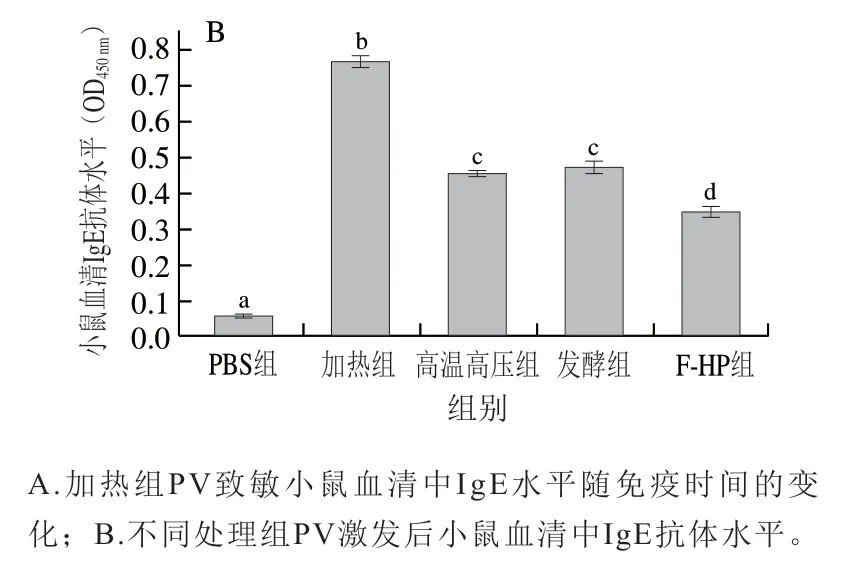
图4 BLAB/c小鼠血清中IgE抗体水平Fig. 4 Serum IgE antibody levels in BALB/c mice
组胺是引起全身过敏症状的主要物质,小鼠血清中组胺质量浓度可以反映BALB/c小鼠过敏反应的严重程度[26]。如图5所示,高温高压组、发酵组和F-HP组小鼠血清组胺质量浓度显著低于加热组(P<0.05),均较加热组降低了40%以上,其中F-HP组降低了63.6%,略高于PBS组。上述结果表明,加热处理后鱼肉PV的致敏性强烈,高温高压、发酵和F-HP处理都可以显著降低鱼饼中PV的致敏性,且F-HP处理对PV致敏性影响最大,降低效果最佳。以上结果与小鼠血清IgE抗体水平相互印证。
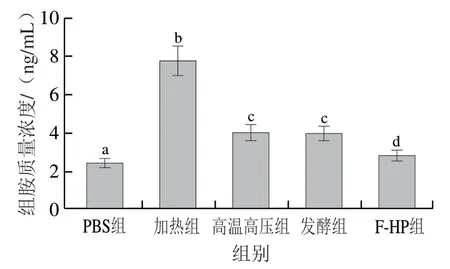
图5 BLAB/c小鼠血清中组胺质量浓度Fig. 5 Histamine levels in serum of BLAB/c mice
为进一步探究不同加工处理消减PV致敏性的机制,本研究分析了不同处理组PV激发致敏后小鼠血清中IL-4、IL-5和IL-13质量浓度。如图6所示,加热组IL-4、IL-5和IL-13质量浓度均最高,而高温高压组、发酵组和F-HP组均出现了不同程度降低,其中小鼠血清中IL-5质量浓度下降最为显著,分别较加热组降低了51.6%、48.6%、47.7%(图6B);与加热组相比,F-HP组IL-13质量浓度下降了34.8%(图6C)。Th2型细胞产生的细胞因子IL-4、IL-5和IL-13都是促过敏细胞因子,能够增强机体致敏反应[27]。Luo Chen等[28]报道小鼠经鱼类PV的脂肪乳化消化产物免疫后,血清中细胞因子IL-4和IL-13的释放量显著增加。本研究结果显示,与加热组相比,其他加工处理组鱼饼中PV免疫的小鼠血清中的促过敏细胞因子(IL-4、IL-5和IL-13)的分泌量均降低,其中F-HP组小鼠的细胞因子质量浓度降低效果最好。
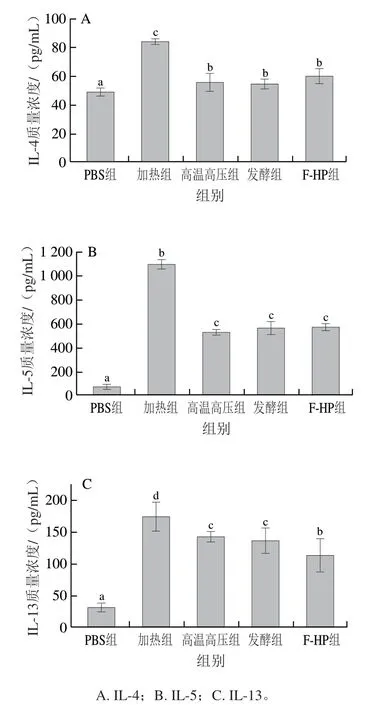
图6 BALB/c小鼠血清中细胞因子质量浓度Fig. 6 Serum cytokine levels in BALB/c mice
BALB/c小鼠过敏模型是评价食物潜在致敏性最直接的方法之一。通过BALB/c小鼠过敏模型,研究发现,与加热组相比,其他加工处理组PV激发致敏后小鼠的过敏症状明显减弱(图3),小鼠血清中组胺质量浓度和Th2型细胞因子(IL-4、IL-5和IL-13)的质量浓度(图5、6)显著降低(P<0.05),小鼠血清中IgE抗体水平均显著降低(图4)(P<0.05),其中F-HP组的小鼠的过敏反应减轻最显著(P<0.05)。van der Ventel等[29]将鲤鱼PV腹腔注射BALB/c小鼠进行致敏实验,发现小鼠血清中特异性抗体IgE水平和Th2型细胞因子(IL-4和IL-5)质量浓度显著升高。根据相关研究[30]可知,当过敏原刺激机体后,Th2细胞被抗原激活后,释放IL-4、IL-5和IL-13等淋巴因子,进而促进IgE产生。而IgE-抗原复合物与肥大细胞表面受体结合后被激活,然后发生脱颗粒现象,释放多种炎症介质如组胺,激活后的肥大细胞还会合成和释放细胞因子如IL-13,这些因子会进一步增强Th2型过敏反应。因此推测可能是不同加工方式破坏了鱼饼中PV的二级结构,掩盖其抗原表位,导致加工处理组小鼠的Th2型细胞免疫应答效果减轻,进而抑制了其过敏反应,其中联合加工处理组的降低效果最佳。本研究结果显示,与加热组相比,其他加工方式制备的鱼饼中的PV致敏性均显著降低,其中F-HP处理对鱼类主要过敏原PV的致敏性影响最为显著。
3 结 论
本研究通过体外免疫学和红外分析结合致敏动物模型两种方法,研究了4种加工处理方式对鱼饼主要过敏原PV的免疫原性、二级结构和致敏性的影响作用,发现与加热组相比,其他处理组中F-HP处理对过敏原PV的二级结构、免疫原性和致敏性影响最为显著。此外发现加工处理可能会破坏PV的二级结构,致其α-螺旋解旋为β-折叠,PV结构的折叠化导致暴露的抗原表位被掩盖,减轻Th2型细胞的免疫应答,从而降低过敏反应。本研究为今后开发低致敏性水产制品和过敏原的消减控制技术提供了科学依据。

