生物炭环境协同生防菌Bacillus amyloliquefaciens P4防控香芋软腐病的研究
王莹乐,李泳霖,梁 雪,黄淑芬,张炼辉,廖立胜,周筱帆
(华南农业大学,群体微生物研究中心∕广东省微生物信号与作物病害防控重点实验室,广州 510642)
香芋作为中国重要的经济作物之一,产地遍及广东、广西、江西、福建等地,其中以珠江流域及台湾省种植较多。广东省内以乐昌市(张溪村)、广州市花都区(文冈村)香芋较为闻名。香芋种植产业的健康发展对广东省农作物经济有重要影响,而软腐病作为香芋种植过程中的常见病害,是影响香芋产量的最主要因素之一,株发病率一般3%~15%,严重时超过50%,甚至绝收,严重挫伤芋农积极性[1]。软腐菌(Dickeya fangzhongdai)为细菌,多发生在香芋的球茎和叶柄的底部,病部会有一层水渍状的黑色斑点,迅速向内腐烂、软化,严重的时候,球茎的中央会完全腐烂,渗出黏液、散发恶臭,植株容易被连根拔起,当腐烂到一定程度时,拔起母芋会使得一部分腐烂残株留在土里,最终全株枯萎倒伏死亡[2,3]。病菌随病残组织在土壤或球茎中越冬。病菌从伤口、气孔侵入,伤口主要有自然裂口、虫伤、病痕、机械伤口等,在田间靠昆虫接触及灌溉流水传播蔓延,进行再侵染。发病最适温度为25~30℃,大风大雨、高温高湿等剧烈天气变化时易暴发流行[4]。
化学农药的使用给植物病害防控带来了诸多成效及便利,但同时也加剧了环境污染及病菌抗药性,人们开始寻找更为安全有效的病害防控治理措施。利用有益微生物控制病害发生发展的方法称为植物病害生物防治,而这些有益微生物则称为植物病害生防菌[5]。与化学防治不同,利用有益微生物的寄生、溶菌、激活抗性等多种方式达到抑制病原物活性的病害防治方法[6],其不仅对人畜安全,而且对环境友好。同时,植物病害生防菌具有改善环境、获得长期效益的作用。以菌治病的方式目前已经广泛地运用于各种生产实践中,如利用生防菌可有效控制魔芋[7]、棉花[8]、辣椒[9]、黄瓜[10]等作物的病害。
解淀粉芽孢杆菌(Bacillus amyloliquefaciens),属于芽孢杆菌属(Bacillussp.),是一种具有广谱抑菌活性的细菌,具有较强的次生代谢产物产生能力,能产生多种抑菌物质,被广泛用于病害防治。研究表明,解淀粉芽孢杆菌对欧文氏菌(Erwinia amylovora)引起的梨火疫病有防治效果[11],能抑制油菜核盘菌(Sclerotinia sclerotiorum)菌丝的生长和菌核的形成[12],对黄瓜枯萎病的致病菌尖孢镰刀菌(Fusarium oxysporumSchlecht)具有拮抗作用和防治效果[13],解淀粉芽孢杆菌在美国作为杀菌剂和植物生长调节剂进行登记[14]。目前,有关解淀粉芽孢杆菌作为生防菌防治香芋软腐病的研究鲜见报道。
生物炭(生物质热解的固体副产品)是一种固碳土壤改良剂,据报道可以提高植物性能并降低叶面和土壤植物病害的严重程度[15]。在生产实践中,农民常常在种植块茎植物时施用草木灰(生物炭),如马铃薯[16]和香芋等,有利于减少发病率和促进植株健康生长。张广雨等[17]研究表明,生物炭能够改变土壤理化性质和结构,特别是对微生物种群结构有明显的影响,能够增加土壤和植物根际土壤中微生物的多样性和活性。在生物炭诱导的微生物中,PGPR和PGPF的群体如荧光假单胞菌属、黄杆菌属、芽孢杆菌属、链霉菌属和木霉属都显著增强[18]。有研究表明,施用生物炭能减少小麦赤霉病[19]、西瓜枯萎病[20]等病害的发生,但解析生物炭对香芋软腐病及其生防菌的拮抗与协同效果的研究鲜见报道。
本研究结合室内试验和盆栽试验,验证生物炭能否加强生防菌(解淀粉芽孢杆菌)对香芋软腐病的生防效果或是否能够直接抑制病原菌致病。研究有助于结合生防菌和生物炭研发高效的微生物生防制剂,预防和减少大田香芋软腐病的发生,减少农药的使用量,帮助农民增产增收,符合中国构建绿色农业、可持续农业的战略构想。同时,研究结果可为防控其他块茎作物的细菌性软腐病,如马铃薯、甘薯等提供理论依据。
1 材料与方法
1.1 供试材料
1.1.1 供试植株广西壮族自治区(以下简称广西)市售的荔浦香芋及香芋苗。
1.1.2 供试病原菌香芋软腐病病菌[Dickeya fangzhongdaiZXC1](简称ZXC),由华南农业大学群体微生物研究中心张炼辉老师课题组从广东省韶关市发病的香芋中分离得到。
1.1.3 供试生物炭500~600℃高温厌氧环境下裂解的水稻秸秆生物炭(rice husk),河南立泽环保科技有限公司。
1.1.4 供试培养基LB液体∕固体培养基:胰蛋白胨10 g∕L、酵母提取物5 g∕L(美国西格玛奥德里奇公司),氯化钠10 g∕L(广州化学试剂厂),琼脂15 g∕L(上海生工生物工程股份有限公司),121℃灭菌20 min。
琼脂糖凝胶:琼脂糖10 g∕L(Biowest Agarose公司),充分溶解后,121℃灭菌20 min。
1.1.5 主要仪器T100TM型PCR仪、Gel Doc 2000型凝胶成像系统(Bio-Rad公司);JY600型电泳仪、JYSPFT型水平电泳槽(北京君意东方电泳设备有限公司);Innova®44型恒温摇床(德国Eppendorf公司);SW-CJ-2FD型超净工作台(安泰空气技术有限公司);PSX智能型恒温恒湿培养箱(宁波莱福科技有限公司);HVE-50型全自动高压灭菌锅(日本Hirayama公司);电热鼓风干燥箱(上海一恒科学仪器有限公司)。
1.2 试验方法
1.2.1 生物炭-土壤混合物配制设置3个生物炭-土壤浓度,体积比例分别为0%、1%、3%,将生物炭按照比例与土壤混匀后使用。
1.2.2 生物炭-生防菌共培养液配制设置3个生物炭溶液浓度,分别为0%、1%、3%,将生物炭按照比例与新鲜的P4菌液混匀,28℃、200 r∕min振荡30 min后使用。
1.2.3 香芋软腐病ZXC生防菌的筛选健康香芋表面消毒、切块、加入适量LB液体培养基后,置于28℃摇床中,150 r∕min振荡12 h。取菌液连续稀释涂布于LB平板上,28℃培养24 h,用3步划线法分离纯化,并统一编号登记。采用平板对峙法,初步筛选能抑制香芋软腐病病原菌生长的拮抗细菌。多次复筛后,根据抑菌圈直径大小共筛选到数株具有生防效果的菌株,本研究选取其中一株抑菌环宽度较大,约为8.5 mm的菌株为研究对象,保存该菌株,命名为P4。
1.2.4 P4菌株的形态测定及16S rDNA序列分析取纯化后的菌株置于LB平板上,28℃培养24 h,待长出纯菌落,根据菌落的形态、颜色、LB平板颜色等进行形态特征鉴定。
利用菌落PCR 16S rRNA基因[21]并进行测序。培养新鲜菌液,选取16S rRNA基因通用引物27F(AGAGTTTGATCCTGGCTCAG)和1492R(TACGGCTACCTTGTTACGACTT),PCR反应总体系为50 μL,将反应体系按比例混合置于冰上,用枪头吸取1 μL菌液作为模板,混合均匀后,进行PCR扩增。通过1.0%的琼脂糖凝胶电泳鉴定PCR结果,PCR产物委托北京擎科生物科技有限公司测序。将所得序列通过NCBI数据库进行Blast同源性分析,并采用MEGA 7.0软件构建系统发育树结合菌落菌体形态及其生理生化特征,对P4菌株进行分类鉴定。
1.2.5 P4菌株生防效果的验证培养新鲜的ZXC和P4菌液,调节OD600nm=1.0,各取菌液1 mL,接种于含50 mL新鲜LB液体培养基的锥形瓶中,置于28℃摇床,150 r∕min振荡30 h,分别于0、6、12、18、24、30 h取适量菌液稀释涂布于LB固体培养基中,28℃培养箱中培养24 h后统计菌落数目。
1.2.6 模拟生产环境下生物炭对生防菌P4和ZXC作用效果的影响将新鲜的香芋苗洗净并切去底部球茎2~3 cm,单个花盆土约500 g。设置7个处理:处理1至处理3为0%、1%、3%生物炭-土壤浓度,分别接种软腐病病菌ZXC;处理4至处理6为0%、1%、3%生物炭-土壤浓度,分别接种软腐病病菌ZXC和生防菌P4;处理7为0%生物炭-土壤浓度,不接菌,每个处理重复6次。将OD600nm=1.0的ZXC和P4新鲜菌液,按照病原菌∶生防菌=1∶5的比例接种。先接种生防菌P4,将香芋苗切面蘸取P4菌液后种植,再以灌根的方式接种等量稀释过的P4菌液;接种生防菌7 d后按相同方式接种ZXC菌液。期间保持土壤湿润,10 d后统计香芋苗发病情况。
1.2.7 生物炭对生防菌抑菌效果的影响培养新鲜的P4和ZXC菌液,调节OD600nm=1.0,进行平板对峙试验。设置3个处理:处理1至处理3在含有ZXC的琼脂糖固体培养皿直径为5 mm的孔内分别接种P4菌液、混有1%生物炭溶液浓度的P4菌液、混有3%生物炭溶液浓度的P4菌液各20 μL,28℃、48 h后测量抑菌圈的大小,每个处理重复3次。加入按照“1.2.2”方法制备的生物炭-生防菌共培养液,取上清液,将培养好的混合菌液经离心、吸附柱过滤后进行点样。
1.2.8 无杂菌干扰的土壤环境中生物炭对致病菌与拮抗菌数量的影响试验设置9个处理:处理1至处理3为0%、1%、3%生物炭-土壤浓度,分别接种ZXC菌液;处理4至处理6为0%、1%、3%生物炭-土壤浓度,分别接种P4菌液;处理7至处理9为0%、1%、3%生物炭-土壤浓度,不接菌,每个处理重复2次。将各浓度生物炭-土壤混合物灭菌烘干后,分别称取30 g于50 mL离心管中,调整新鲜菌液OD600nm=1.0,分别将1 mL ZXC、1 mL P4菌液加水稀释至10 mL,摇匀后倒入离心管中密封好,28℃培养7 d后进行稀释涂布平板计数,确定ZXC与P4数量。
2 结果与分析
2.1 香芋软腐病病菌拮抗菌株的筛选及分类鉴定
以香芋软腐病病菌为指示菌,从健康芋头中分离、筛选得到的细菌为待测菌,将分离纯化的待测菌按平板对峙法进行初筛、复筛,选取其中一株抑菌环宽度较大,约为8.5 mm的菌株P4为研究对象(图1)。将P4菌株在LB固体平板划线,28℃条件下培养2 d后,菌落呈白色不透明、形状不规则近圆形,边缘不整齐、呈锯齿状,表面粗糙干燥、有褶皱(图2)。

图1 分离菌株P4对D.fangzhongdai ZXC的抑菌效果

图2 菌株P4菌落形态
将测序得到的P4菌株16S rDNA序列在NCBI的“rRNA_typestrains∕16S_ribosomal_RNA”数据库中进行BLAST搜索,发现P4菌株与已经公布的Bacillus amyloliquefaciesPI3菌 株(GenBank登 录 号:MH719373.1)间16S rDNA序列的相似性达到99.93%。进一步构建系统发育树(图3),从图3可以看出,虽然进化树整体支持度较低,但菌株P4与3个Bacillus amyloliquefacies菌株亲缘关系最为接近。因此,综合BLAST和系统发育分析结果,判断P4最有可能是解淀粉芽孢杆菌(Bacillus amyloliquefacies),并将该菌株命名为Bacillus amyloliquefaciesstrain P4,其16S rDNA序列提交至NCBI,GenBank登录号为MZ618706。

图3 菌株P4和其他亲缘种的16S rDNA序列构建的系统发育树
2.2 生防菌拮抗效果验证
经分离、筛选、鉴定得到菌株P4后,为了对其生防效果进一步进行验证,将菌株P4与ZXC新鲜菌液等量接种于LB液体培养基中混合培养,每隔6 h取适量菌液进行稀释涂布平板计数、统计(图4、图5)。从2种菌株混合培养时开始记录,P4菌株呈上升趋势直至24 h后进入稳定期,ZXC菌株在前6 h呈上升趋势,后逐渐下降,并在第12小时数目下降为0,这表明菌株P4对菌株ZXC有较强的拮抗作用,可作为生防菌用于后续的试验。

图4 在LB培养基中共培养条件下菌株ZXC与P4的菌落数目变化

图5 在LB培养基中共培养条件下菌株ZXC与P4的菌落数目占比
2.3 盆栽试验中生物炭对生防菌P4和病原菌ZXC作用效果的影响
为了探究加入生物炭是否可以加强生防菌P4对病原菌ZXC的生防效果或是否能够直接抑制病原菌致病,进行了盆栽试验。按照“1.2.1”生物炭-土壤混合物配制方法,将生物炭按比例与土壤混合后种植香芋苗,分别接种2种菌株,一段时间后统计香芋苗发病率及发病程度。
从图6可以看出,不加P4菌株的处理中,当生物炭浓度为0%时,香芋苗发病率约为83%,且有80%为中度以上发病;加入的生物炭浓度为1%时,香芋苗发病率约为67%,其中有50%为中度以上发病;当加入生物炭浓度为3%时,香芋苗发病率约为50%,其中约有33%为轻度及中度发病。此结果表明仅施用生物炭也能够降低香芋软腐病的发病率。
从图7可以看出,加入P4菌株的处理中,当生物炭浓度为0%时,香芋苗发病率为33%,且全部为中度发病,比不加P4菌株的发病率下降了50%;当生物炭浓度为1%时,加P4菌株的香芋苗发病率为50%,比不加P4菌株的发病率下降了约17%,且全为轻度发病;当生物炭浓度为3%时,加P4菌株的香芋苗发病率为50%,与不加P4菌株处理的发病率相同,且全为重度发病。说明适量生物炭与生防菌的共同施用能够有效地控制发病率及发病程度,但施加生物炭浓度较高时抑制病害效果反而不明显(图6、图7)。
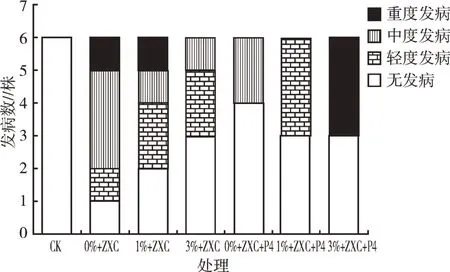
图7 生物炭及生防菌P4处理下香芋苗的发病情况
2.4 生物炭对生防菌抑菌效果的影响
为了解生物炭降低植株发病率及发病程度的作用机制,探究加入生物炭是否能够增强生防菌P4对病原菌ZXC的拮抗作用,按照“1.2.2”生物炭-生防菌共培养液配制方法,将生物炭按比例加入新鲜P4菌液中,培养一段时间,取上清液和菌液分别进行平板对峙试验,根据抑菌圈的大小进行验证(图8、图9)。在生防菌菌液的上清液及生物炭-生防菌共培养液的上清液处理中,没有抑菌圈产生,推测生防菌可能要与病原菌直接接触后才会产生相应的拮抗物质,或者有可能是产生的拮抗物质较少,没有明显的抑菌效果。
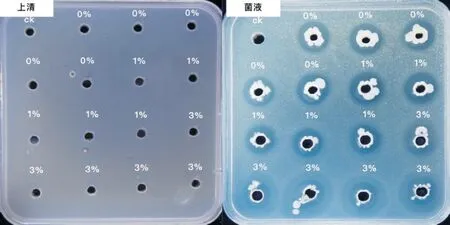
图8 不同生物炭浓度下生防菌P4对病原菌ZXC的抑菌效果展示
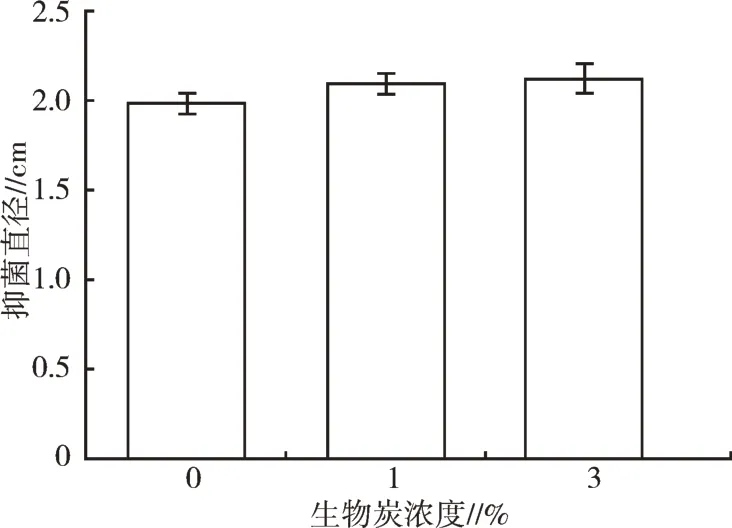
图9 不同生物炭浓度对生防菌P4抑菌圈大小的影响
在生物炭-生防菌共培养的菌液处理中,抑菌圈的大小随着加入生物炭浓度的上升有轻微扩大趋势,但通过计算发现,并没有显著性差异表明这种“轻微的上升”是确定的现象,说明生物炭对香芋软腐病的抑制效果可能并不是通过促进生防菌分泌拮抗物质产生的。
2.5 土壤环境中生物炭对生防菌P4及病原菌ZXC数量的影响
为了探究生物炭是否作为碳源通过促进生防菌P4的生长繁殖从而降低了植株发病情况,在无杂菌的不同生物炭浓度的土壤中培养P4菌株,一段时间后取样进行稀释涂布平板计数,以相同方法对病原菌ZXC的数目进行探究。在无杂菌干扰的情况下,土壤中P4菌株与ZXC菌株的数目随生物炭浓度的升高而增加,并且当生物炭浓度为3%时,2种菌落数目明显增多(图10、图11),这表明生物炭能够为细菌提供充足的碳源,进而促进细菌的生长繁殖。依据盆栽试验的结果,进而得到加入适量的生物炭能够促进生防菌P4的增殖从而降低植株发病率及发病程度;而加入较高浓度的生物炭可能会促进病原菌的增殖从而抵消了生防菌的作用,导致生防效果不明显。

图10 病原菌ZXC和生防菌P4菌落数量变化效果展示

图11 不同生物炭浓度下病原菌ZXC与生防菌P4的数量变化
3 小结与讨论
近年来,香芋种植区软腐病频繁暴发,造成香芋严重减产,软腐病已成为制约香芋产业发展的重大因素。Dickeya fangzhongdai是香芋软腐病的主要病原菌之一[22],在香芋的整个生长周期均可破坏植株正常生长,是造成香芋减产的主要原因之一。化学农药防治效果较好,但是造成的环境污染日益增多,引发许多食品安全问题。此外,随着社会的发展与进步,人们的消费观念发生变化,更加注重食品及其相应生活必需品的安全性和环保性。本试验对香芋软腐病生物防治资源进行深入地研究,为协同其他防控手段对香芋软腐病进行综合防治,同时也为了能更环保、安全地进行香芋及其相关产品的生产提供理论数据。
近些年的研究表明,生防微生物的运用对植物病害的可持续控制与无公害防治产生了巨大的成效,尤其是从源头上限制了化学农药的滥用,减少了环境污染及病菌耐药性等。这种防治技术适应绿色环保的要求,适应社会的发展,有着广阔的应用前景[5,6]。目前使用较多的生防细菌主要有芽孢杆菌、假单胞杆菌、土壤放射杆菌和巴氏杆菌等。不同生防菌对病原菌的拮抗作用机制不同,生防菌株可以通过分泌抗菌活性物质抑制病原菌的生长,可以通过分泌溶菌物质直接杀死病原菌,可以通过与病原菌竞争营养和生存空间、延缓或者阻止病原菌定殖过程与病害发生发展,也有的生防菌可以促进植物的抗病性。本研究从健康香芋植株中分离筛选出1株能抑制香芋软腐病菌D.fangzhongdai生长的拮抗细菌,命名为Bacillus amyloliquefaciesstrain P4,竞争性试验证明P4菌株对D.fangzhongdaiZXC1有良好的拮抗效果;对峙培养时,P4菌株可以产生明显的抑菌性物质抵抗病原菌ZXC1的生长,故此推测P4菌株分泌的抑菌活性物质应该是其抑制病原菌的原因之一。P4菌株的抑菌活性物质有待深入研究。
生物炭是一种新兴的农业生产材料,具有吸附能力强、比表面积大、多孔结构稳定性强等特点。生物炭作为优良的土壤改良剂,除了改善土壤理化性质外,还能够显著地增加土壤微生物的多样性及活性。目前已有研究表明,施用生物炭能够有效地减少植物病害的发生[15-20]。本研究进一步探究了生物炭环境协同生防菌B.amyloliquefaciensP4菌株对香芋软腐病菌的拮抗作用。盆栽试验的结果表明,适量生物炭与生防菌的共同施用能够明显降低植株发病率或减轻发病程度,并且仅施用生物炭也可以在一定程度上降低发病率或减轻发病程度,此外,当加入的生物炭浓度较高时,生防菌的拮抗效果却不明显。
进一步深入探究生物炭提高P4菌株生防效率的原因,发现单独添加生物炭未能促进P4菌株产生抑菌物质外排到胞外;当与病原菌对峙培养时,抑菌物质也无明显差异。因此,本研究认为生物炭可能不是通过直接促进生防菌产生相应的拮抗物质来增强对香芋软腐病病菌的抑制效果,而是存在另外的作用机制。通过检测不同含量的生物炭处理下P4菌株与ZXC菌株的种群数量变化,发现P4菌株与ZXC菌株种群数量随着生物炭浓度的增加而呈递增趋势,并且在3%生物炭含量时达到峰值,说明生物炭环境能够有效地促进土壤微生物的生长;有研究表明生物炭环境可直接为土壤微生物提供良好的庇护所和生长所需养分以促进其增殖[23]。本研究发现1%含量的生物炭与生防菌共同处理下植株发病率最低,3%含量的生物炭与生防菌共同处理下防治效果却不明显。根据其他学者的研究[17,18],生物炭环境可以改变微生物群落结构。不同菌株对生物炭的响应机制不同,适量的生物炭环境可以调节P4菌株的种群数量优于病原菌的种群数量,使P4菌株在与病原菌对抗的过程中更具优势,故此表现出明显的防病效果;过高生物炭含量,促进生防菌生长繁殖的同时也使得病原菌繁殖过快,防病效果反而不明显。种群的平衡是微生物相互制约的重要基础,如何正确把握和控制生物炭材料在农业生产中的使用剂量,是今后需要研究的重点之一。
本研究结果表明,加入生物炭能够抑制植物病原菌致病,1%含量的生物炭与生防菌的共同作用相较于生物炭或生防菌单独作用而言,防病效果更佳。适量的生物炭能够通过加快土壤中生防菌的生长繁殖使其占据良好的生态位,从而加强生防菌对香芋软腐病病原菌的生防效果。本研究为未来绿色农业的发展提供了理论依据,可以大量利用农业生产中的植物废料,如秸秆、种壳,经济有效地将其转化为生物炭,使其变废为宝,同时利用有益微生物,双管齐下,研发高效的生物炭与生防菌混合制剂治理及预防大田植物病害,减少化学农药的使用,从而帮助农民增产增收,最终实现一加一大于二的效果。

