牛Basigin基因变异体的克隆与鉴定
刘雪艳,程林圆,周国利
(聊城大学生命科学学院,山东 聊城 252059)
选择性剪接(Alternative splicing,AS)是扩大真核细胞遗传多样性的一种普遍机制[1]。大约90%的人类基因通过这个精细调控的过程产生一个以上的转录本[2,3]。基因的前体mRNA通过不同的剪接方式产生不同的mRNA剪接变异体,通过剪接因子和相应转录组中顺式作用元件之间的相互作用,进而精细调控组织和阶段特异性剪接事件,可变剪接是调节基因表达和产生蛋白质组多样性的重要机制,是导致真核生物基因和蛋白质种类多样性和差异性的重要原因[4]。AS转录本的时空表达谱在很大程度上有助于细胞分化、特化和器官发生[5]。
选择性多聚腺苷酸化(Alternative polyadenylation,APA)是真核生物细胞中普遍存在的一种基因调控机制,选择不同的加尾信号可以使单个基因产生不同的转录本[6,7]。APA的结果是可以产生具有不同编码序列的转录本,或者不同长度的3'端非翻译区(3'untranslated region,3'UTR),而不同长度的3'UTR影响着mRNA的稳定性、定位和翻译效率,因此,APA在细胞发育、分化和增殖过程中对基因表达具有重要的调控作用[8,9]。
牛的Basigin(BSG)基因,位于7号染色体上,长约9 kb,含有7个外显子。BSG基因编码一种广泛表达的跨膜糖蛋白Basigin,也称CD147,它参与机体肿瘤发生、胚胎发育、能量代谢、损伤修复等多种生理和病理过程[10]。人和小鼠的BSG基因剪接变异体已经被克隆[11,12],然而牛的BSG基因是否存在AS和APA变异体尚不清楚。因此,本研究的目的是通过3'RACE技术和测序技术去寻找牛的BSG基因是否存在AS或APA的生物学事件。研究结果将会补充牛的基因组数据,为进一步分析牛BSG基因不同变异体在不同的生物学过程中的功能奠定分子生物学基础。
1 材料与方法
1.1 试剂
RNAeasy™Plus动物RNA抽提试剂盒、BeyoRT™cDNA第一链合成试剂盒购自上海碧云天生物技术有限公司;琼脂糖、凝胶DNA回收试剂盒均购自天根生化科技公司;Taq酶、dNTPs、T载体PCR产物克隆试剂盒购自生工生物工程(上海)有限公司;其他试剂均为国产普通分析纯。
1.2 动物组织样品及总RNA提取
鲁西黄牛的组织样品采自山东省聊城市张炉集镇屠宰场。在屠宰后立即采集牛的里脊、睾丸、肾脏、肝脏等组织,并迅速投到液氮中带回实验室,利用RNA试剂盒提取总RNA,用浓度为1%~1.5%的琼脂糖凝胶电泳检测总RNA的完整性。
1.3 BSG基因变异体的克隆与测序
根据NCBI中牛BSG基因的mRNA序列(Gen-Bank登录号:NM_001075371.2),利用Oligo 6.0软件设计用于牛BSG基因变异体克隆的2条上游特异性引物,第一个引物在第二个引物的下游。经BLAST程序比对,各条引物在牛的基因组上均没有互补序列。
利用表1中所设计的用于3'RACE的cDNA反转录通用引物,用cDNA第一链合成试剂盒反转录合成相应组织的cDNA,然后以获得的cDNA为模板进行PCR。PCR产物通过凝胶回收试剂盒纯化回收,利用连接试剂盒将回收的PCR产物克隆到T载体上,阳性的克隆进行双向测序,再用DNAStar 5.0软件、NCBI和UCSC网站的BLAST程序作序列比对分析。
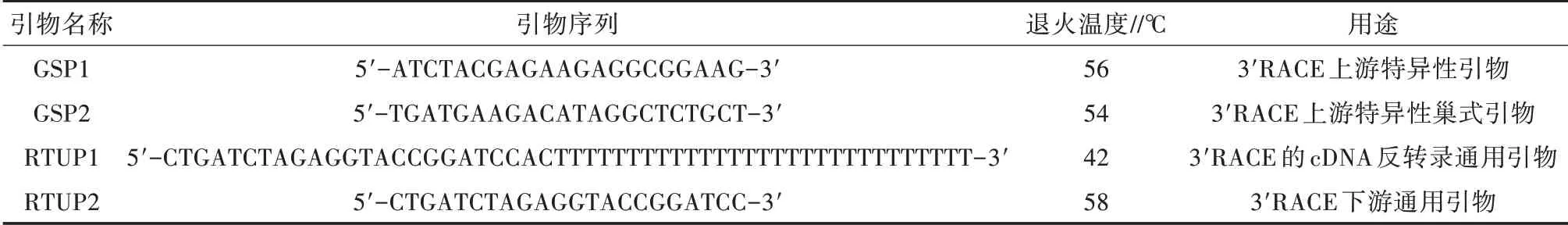
表1 BSG基因3'RACE相关引物信息
2 结果与分析
2.1 组织样品总RNA电泳检测
分别从肝、睾丸、肾、里脊组织中提取总RNA,通过琼脂糖凝胶电泳检测总RNA的完整性。电泳结果显示,提取总RNA的28S rRNA与18S rRNA的条带比较明显,5S条带比较暗,说明提取的RNA完整性较好,没有明显的降解(图1),可以用于后续的相关试验。
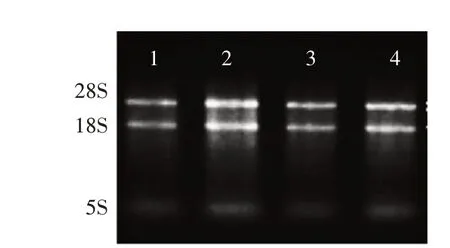
图1 各组织样品总RNA电泳检测
2.2 3'RACE产物的电泳及测序
2.2.1 3'RACE产物电泳 通过浓度为1.5%的琼脂糖凝胶电泳结果(图2)可以看出,扩增出的目标片段至少为3条,可能是由于基因选择性表达,它们并没有来源于同一个组织。在肾组织的PCR扩增产物中,有2条比较明显条带,700 bp左右的条带亮度明显大于300 bp,并且在100 bp附近也能观察到1条与里脊中大小相似的条带,但是条带的亮度比较弱。在里脊组织中有1条亮度明显的约100 bp的条带,但该条带较宽,不能确定该条带存在几条目的片段,可以通过后续的克隆和测序验证。
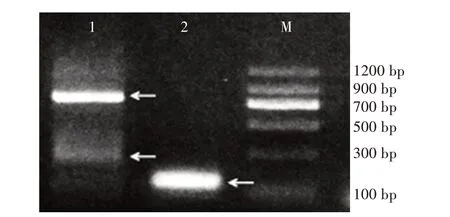
图2 3'RACE产物电泳
2.2.2 3'RACE产物片段测序 通过利用上游GSP1、GSP2特异性引物与下游RTUP2通用引物进行巢式PCR,PCR产物经回收、克隆和测序后发现有4条目的片段,根据片段的大小将它们分别命名为BSG-v1、BSG-v2、BSG-v3和BSG-v4,各片段的部分序列及峰图见图3。
BSG-v1片段的组织来源为牛的肾脏组织,上下游引物之间长767 bp,在poly(A)尾上游17~23 bp处存在1个经典的加尾信号“AATAAA”(图3a)。利用NCBI中的BLAST程序对该序列与牛的基因组进行比对,发现与牛BSG基因的序列完全一致,并且所获得的BSG-v1就是NCBI中已经公布的序列(Gen-Bank登录号:NM_001075371.2)。BSG-v2片段的组织来源为牛的肾脏组织,上下游引物之间长245 bp,在poly(A)尾上游12~18 bp处存在1个经典的加尾信号“AATAAA”,该加尾信号序列与BSG-v1是同一个加尾信号(图3b)。该序列与牛的基因组比对,发现与牛BSG基因的序列高度同源。BSG-v3和BSGv4片段来源于牛的里脊组织,上下游引物之间分别为168 bp和129 bp,具有明显的poly(A)尾结构,但无经典的加尾信号(图3c,3d)。该序列与牛的基因组比对,发现BSG-v3和BSG-v4序列与牛BSG基因序列高度同源。
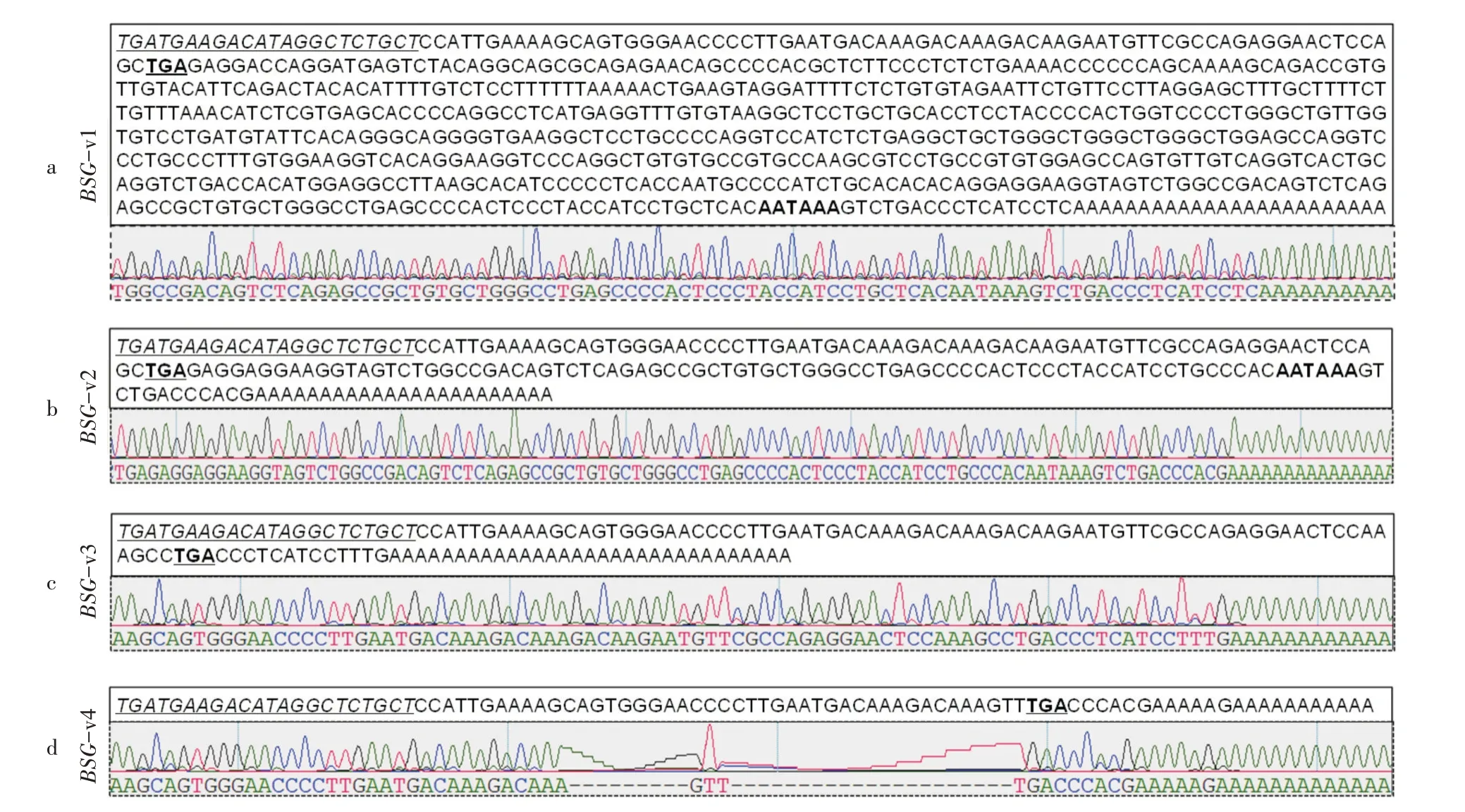
图3 牛BSG基因各转录本变异体的部分序列与测序峰
通过使用NCBI比对发现,只有BSG-v1序列与已经报道的完全一致,BSG-v2,BSG-v3和BSG-v4是新发现的可变剪接变异体。
2.2.3 牛BSG基因的可变剪接变异体的结构分析利用NCBI网站上的BLAST程序和UCSC网站(http://genome.ucsc.edu/)上的BLAT程序联合分析发现,与BSG-v1相比,BSG-v2、BSG-v3和BSG-v4是BSG-v1不同形式的变异体(图4)。BSG-v2在第7外显子处发生了A3SS,导致BSG-v2的外显子7比BSG-v1的短了515 bp,相当于BSG-v2的内含子6在原来的基础上延伸了515 bp,但分析发现BSG-v2的内含子6的边界仍然符合“GT-AG”规则(图4a)。此外,通过对来源于里脊组织的2个可变剪接变异体BSG-v3和BSG-v4的分析发现,二者都发生了APA现象,它们都没有外显子7,导致产生了更短的3'UTR(图4b,4c)。进一步地分析发现,与BSG-v1和BSG-v2相比,虽然终止密码子的位置发生了变动,但并没有造成原有开放阅读框(ORF)移码突变,而是密码子碱基以3的倍数形式缺失,造成羧基端变化。BSG-v3终止密码子前2个密码子与BSG-v1和BSG-v2不同,并且BSG-v3多了1个编码氨基酸的密码子(图4b)。而BSG-v4在3'端缺失了9个编码氨酸的密码子,使BSG的羧基端变短(图4c)。而且BSG-v1和BSG-v2的3'UTR区都非常短,无经典的加尾信号,具有明显的poly(A)尾巴。
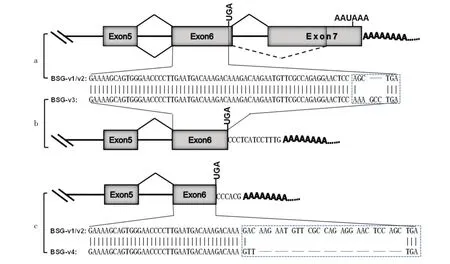
图4 牛BSG基因各转录本变异体的部分结构与序列
3 小结与讨论
在真核生物中,AS和APA的现象是普遍存在的[9,13],本研究通过3'RACE技术成功地克隆出了牛BSG基因的4条转录本的3'端片段。经序列对比和分析后发现,在这4条转录本中,最长的1条BSG-v1已经在NCBI中公布。BSG-v2则在外显子7中(也是3'UTR)存在明显的A3SS剪接现象。较短的2条BSG-v3和BSG-v4都分别存在1个新的poly(A)位点,但这4条不同的转录本并没有来源于牛的同一个组织,这可能是基因的选择性表达造成的。同时这也是AS和APA在真核细胞中的遗传多样性精细调控的一种体现[13]。
在本研究中,BSG-v2的外显子7有515 bp的序列被剪接,与BSG-v1的内含子6一起作为新的内含子6被剪接掉,因为发生剪接的是外显子7的5'端,并且属于3'UTR,所以BSG-v2变异体的加尾信号并没有改变(图4a)。推测BSG-v1和BSG-v2可能会存 在 不 同 的 转 录 后 调 控 机 制[13,14]。MicroRNAs(miRNAs)是在真核生物中发现的一类内源性的具有调控基因表达功能的非编码RNA,其大小长约20~25个核苷酸。成熟的miRNAs由较长的初级转录物经过一系列核酸酶的剪切加工而产生,随后组装进RNA诱导的沉默复合体,通过碱基互补配对的方式识别靶mRNA,并根据互补程度的不同指导沉默复合体降解靶mRNA或者阻遏靶mRNA的翻译。成熟的miRNA结合到与其互补的mRNA的位点来调控基因表达,其中一些靶位点就存在于3'UTR[15]。研究发现,与一般3'UTR相比,一些基因通过内含子保留形成的3'UTR区域比其他区域有更大的可能含有更多miRNA的靶标位点,因此,保留内含子能显著增加该基因被miRNA调控的可能[16]。一些研究已经报道,基因的AS或APA的事件会导致该基因逃避某些miRNAs或RNA结合蛋白(RNA binding proteins,RBPs)的调控[15-17]。所以由于BSG-v2变异体3'UTR的A3SS剪接事件存在,可能会使该变异体逃避miRNAs的调控,从而导致牛BSG-v1和BSG-v2的差异表达调控;此外,基因的3'UTR除受miRNAs的转录后调控外,还会有一些RBPs的结合,从而促进或抑制mRNA的稳定性或翻译效率。与BSG-v1相比,BSG-v2的3'UTR长度短了515 bp,因此可能会缺失RBPs的结合位点,从而导致mRNA或蛋白水平上的差异。但具体逃避了哪些能够与BSG-v2变异体的3'UTR发生相互作用的miRNAs或RBPs,还需通过相应的试验进一步证实。
此外,有趣的是本次克隆BSG基因mRNA的3'端片段表明,来源于牛里脊组织的2条较短转录本具有明显的新poly(A)位点,有非常短的3'UTR序列,且都不包含外显子7。BSG-v3比BSG-v1的ORF多一 个密码 子,BSG-v4比BSG-v1的ORF缺 失9个密码子,它们都是羧基端发生了变化,这种变化是否影响了BSG蛋白的功能,尚需进行功能验证。但有报道指出,APA如果发生在编码区,可能会引起终止密码子前移,提前终止编码蛋白[6]。此外,在BSG-v4的poly(A)尾中还有一个“G”存在,这也是近年来研究发现的在poly(A)尾中存在非“A”碱基的一种新事件,也已经成为近年来关于转录后调控研究的热点[18]。AS同样也可能会引起终止密码子位置的改变,根据当前的研究发现,人的BSG基因通过AS选择性编码出4种变异体蛋白,分别为basigin-1、basigin-2、basigin-3和basigin-4[11]。但目前获得的BSG-v3和BSG-v4变异体只是包括了外显子5和外显子6,至于其前面的外显子是否发生了AS事件,还需要进一步证实。但本研究成功克隆了牛BSG基因几种不同形式的变异体,为进一步探索BSG基因在牛的各种相关生物学过程中的表达调控及生物学功能奠定了一定的分子生物学基础。

