铅镉胁迫下泡桐1201幼苗的生理机制响应
朱秀红,张记钟,李哲静,张淑静,茹广欣
(河南农业大学林学院,郑州 450002)
在工农业快速发展的当今时代,越来越多的有毒有害物质排放到生态环境中,人们面临的污染问题日益严重。尤其在生产活动中,由于农药化肥的不合理施用、工业三废的过度排放,导致大量重金属进入土壤中。其中,铅(Pb)和镉(Cd)为植物生长的非必需元素,也是主要的重金属污染物[1]。当土壤中Pb和Cd浓度超过一定范围时,会对植物整个生长发育过程产生一定的毒害作用,严重时甚至会导致植株中毒死亡。
泡桐(Paulownia fortunei)原产于中国,自然分布或栽培区遍布全国23个省(市)、自治区,是一种重要的优质速生用材树种,在中国林业生产中占有特殊地位。泡桐质轻、纹理美观、不易燃烧、不易变形,易干燥、易加工,主要用于生产单板类人造板。此外,相比生物量小的超富集植物,泡桐具有速生、丰产、生物量大、材质优良、繁育便捷、栽培时间长、经济价值高等优点。但目前为止,关于泡桐的研究多集中在遗传选育与繁殖技术[2]、栽培与造林技术[3]、病虫害防治[4]、黄酮类化合物提取[5]、生物质燃料制备[6]等方面,而有关泡桐在重金属胁迫下的生长生理状况鲜有研究报道。
鉴于此,本研究以泡桐1201幼苗为研究对象,测定在Pb、Cd胁迫影响下,其幼苗生物量、生理生化指标和亚细胞分布的一系列变化,从植株和细胞2个层次上探究泡桐1201幼苗对Pb、Cd的吸收规律及耐性机理,为泡桐在重金属污染修复方面的应用提供一定的理论依据。
1 材料与方法
1.1 材料
泡桐1201种子来自河南农业大学林木遗传育种实验室毛庄科教园区。于2021年6月下旬,在河南农业大学林木遗传育种实验室开始试验。选取大小一致、饱满健康的泡桐种子,经H2O2消毒后,用去离子水浸种24 h催芽,后再置于发芽盒中待其萌发,当幼苗长至两叶一心时加入1/8 Hongland营养液,促进其生长,2.5 d更换一次营养液,培养一周时将幼苗置于1/2 MS营养液继续培养,后移至Hongland完全营养液中培养,每3 d更换一次营养液。充分缓苗后,进行重金属胁迫处理,并观察其长势。
1.2 方法
试验选取长势良好、健康茁壮的泡桐1201幼苗,在光照培养箱内进行,调整间距,使幼苗受光均匀。采用CdCl2为Cd源、Pb(CH3COO)2·3H2O为Pb源,加入营养液中对幼苗进行胁迫处理。试验设置9个水平处理,Pb胁迫处理浓度分别为0 mg/L(CK)、100 mg/L(A2)、300 mg/L(A3)、500 mg/L(A4)和800 mg/L(A5);Cd胁迫处理浓度分别为0 mg/L(CK)、10 mg/L(B2)、20 mg/L(B3)、30 mg/L(B4)和40 mg/L(B5)。各处理设置3个重复,每个重复10株苗。连续胁迫30 d后,采取样品,进行相关指标的测定。
1.3 项目测定
1.3.1 泡桐1201生物量的测定 去离子水洗净幼苗,滤纸吸干表面水分,用剪刀将植株根、茎、叶剪开,烘箱调至105℃,杀青2 h,后调至80℃烘干至恒重,用万分之一电子天平测定根、茎、叶各部位生物量。
1.3.2 泡桐1201对重金属转运及富集系数的测定 根部及叶片Cd、Pb含量的测定:用去离子水冲洗干净幼苗,后用20 mmol/L Na2-EDTA溶液浸泡根系10 min,解吸其表面附着的Pb2+、Cd2+,用去离子水冲洗干净,并用滤纸吸干表面水分,105℃杀青15 min,70℃下烘干至恒重,粉碎后过2 mm筛。混酸消解后用原子吸收分光光度计(AASZEEnit 700型)测量。具体公式如下。

1.3.3 泡桐1201丙二醛含量的测定 酶液制备:分别称取0.1 g根、叶鲜样于研钵中,加入pH 7.8的H3PO4缓冲液1.0 mL,冰浴研磨至匀浆,倒入离心管,冷冻离心20 min,所得上清液即为酶液,0~4℃下保存。
丙二醛(MDA)含量测定采用硫代巴比妥酸(TBA)比色法[8]。反应液制备:先称取0.6 g TBA,用少量1 mol/L NaOH溶解,再用10% TCA(三氯醋酸)定容至100 mL。取0.5 mL酶液,向其加入1 mL 0.6% TBA,封口沸水浴15 min,取出后迅速冷却离心10 min,取上清液,测定其在600、532、450 nm处的波长。计算公式如下。

1.3.4 泡桐1201抗氧化酶活性的测定 酶液制备和MDA活性测定。超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)法[9]。反应液配制为H3PO4缓冲液:C6H11NO3S∶NBT∶EDTA-Na2∶核黄素∶H2O=15∶3∶3∶3∶2.5。测定步骤:取6.5 μL酶液,向其加入1.0 mL反应液,光照30 min,对照和空白组均用缓冲液代替,空白组放在暗处,对照和酶液组光照后避光保存,空白调零,于560 nm波长处进行比色。每隔1 min读数1次,共读3次,每分钟吸光度变化值表示酶活力的大小。
过氧化物酶(POD)活性测定采用愈创木酚法[10]。反应液制备:取50 mL 0.1 mol/L pH为6.0的H3PO4缓冲液于烧杯中,向其加入28 μL的C7H8O2,充分搅拌使其溶解,冷却后加入219 μL 30%的H2O2,0~4℃保存。测定步骤:取6.5 μL酶液和1.0 mL反应液于比色皿内,于470 nm波长处进行比色。
过氧化氢酶(CAT)活性测定采用双氧水法[11]。反应液制备:取20 μL 0.1 mol/L酶液和1.0 mL反应液于比色皿内,于240 nm波长处进行比色。以pH 7.0的H3PO4缓冲液为对照调零。
1.3.5 泡桐1201渗透调节物质含量的测定
1)游离脯氨酸含量的测定。采用酸性茚三酮法[9]。称取0.1 g鲜样,向其加入1.0 mL 3%磺基水杨酸溶液,沸水浴中浸提10 min,取出样品并冷却至室温,吸取1.0 mL滤液,加入1.0 mL CH3COOH和1.5 mL酸性C9H6O4,沸水浴30 min。冷却后加入4 mL甲苯,摇荡30 s,静置片刻,取上层液于10 mL离心管中,3 000 r/min高速离心5 min。取反应后上层红色溶液于比色杯中,于520 nm波长处进行比色。
2)可溶性蛋白质含量的测定。采用考马斯亮蓝(G-250)染料结合法[12]。酶液的提取:称取1.0 g根或叶鲜样于研钵中,加5.0 mL冰浴研磨至匀浆,然后移入离心管中,静置30~60 min以充分提取,后在4℃低温、4 000 r/min条件下高速离心20 min,上层清液即为提取到的可溶性蛋白质溶液。反应液配制:取0.1 g G-250于试管中,加入50 mL 90%乙醇溶解,再加100 mL 85%磷酸缓冲液,去离子水定容至1 000 mL,于棕色瓶中保存。测定时的具体操作:取10 μL可溶性蛋白质提取液和1.5 mL G-250充分振荡混合均匀,静置2 min,空白组为6.5 μL磷酸缓冲液加1.0 mL G-250,于595 nm波长处进行比色。
3)可溶性糖含量的测定。采用蒽酮比色法[13]。切取样品0.5 g置于研钵内,加入去离子水和少量石英砂研磨至匀浆,将研磨后的物质定容至100 mL的容量瓶中,于室温下静置30 min,并每隔5 min上下混匀1次,过滤弃去残渣。取几个干净的试管,分别加入1 mL样品和5 mL蒽酮试剂,摇匀后置于沸水浴中加热10 min,取出冷却至室温后,取比色皿在620 nm波长处测定其吸光值。
1.3.6 非蛋白巯基化合物(NPT)含量的测定 参照Keltjens法[14]。分别称取1.0 g根、叶鲜样于研钵中,加入2.0 mL 3%的磺基水杨酸溶液和干净的石英砂,冰浴研磨至匀浆,后在4℃、8 000 r/min条件下,冷冻离心5 min。取300 μL上清液于试管中,向其加 入630 μL 0.5 mol/L pH为7.5的H3PO4缓 冲 液 和25 μL 6.3 mmol/L的2-硝基苯甲酸,静置20 min,于421 nm波长处进行比色。
谷胱甘肽(GSH)含量测定:分别称取0.5 g根、叶鲜样于研钵中,剪碎,加入5.0 mL 5.0%的C2HCl3O2和干净的石英砂,冰浴研磨至匀浆,后在4℃、15 000 r/min条件下,冷冻离心10 min。取2.0 mL上清液于比色皿中,向其加入2.6 mL pH为7.7的H3PO4缓冲液和0.18 mL DTNB,H3PO4缓冲液作空白对照,摇匀,静置5 min,于421 nm波长处进行比色。
螯合肽(PCs)含量为NPT总量与GSH含量二者之差。
1.3.7 亚细胞中重金属浓度的测定 亚细胞组分的提取参照Xin等[15]的方法。取根、茎、叶鲜样各0.5 g置于研钵中,加入5 mL预冷(4℃)提取液[50 mmol/L Tris-HCl(pH 7.5)、250 mmol/L蔗 糖 和1.0 mmol/L C4H10O2S2],研磨成匀浆,高速离心(3 000 r/min离心15 min)沉淀(F1)主要为细胞壁组分。上清液继续高速离心(12 000 r/min)30 min,得到沉淀(F2)主要为细胞器组分,剩余上清液(F3)为可溶组分(包括细胞液和液泡)。分离后的F1和F2组分分别装入5 mL离心管中,经HNO3-HClO4消化后用电感耦合等离子体原子发射光谱仪ICP-AES(IRIS Intrepid II)测定Pb、Cd浓度,F3组分直接稀释后测定。
1.4 数据分析
试验所得最终数据使用Excel 2016、SPSS 20.0软件完成统计分析,采用单因素ANOVA完成试验处理,利用Duncan’s法进行多重比较(α=0.05),所有图表均使用Excel 2016软件制作完成。
2 结果与分析
2.1 Pb、Cd胁迫对泡桐1201幼苗生物量的影响
通过方差分析(表1)可知,Pb、Cd胁迫对泡桐1201幼苗生物量产生存在显著性差异。Pb、Cd胁迫下,随着胁迫浓度的增加,泡桐1201幼苗各部位干重和整株总干重均呈略微升高后显著降低的趋势。其中,A2、A3处理下,幼苗根、茎、叶干重和总干重相比对照(CK)分别增加44.00%、19.05%、24.14%、13.46%和12.00%、9.52%、-1.72%、3.85%。B2处理下,幼苗根、茎、叶干重和总干重相比CK分别增加12.01%、4.76%、5.17%、6.73%。随着胁迫浓度的增加,幼苗生物量显著降低,其中,A5处理下,幼苗根、茎、叶干重和总干重分别为对照的76.02%、52.38%、65.52%、65.38%;B5处理下,幼苗根、茎、叶干重和总干重分别为对照的44.00%、38.10%、53.45%、48.08%。
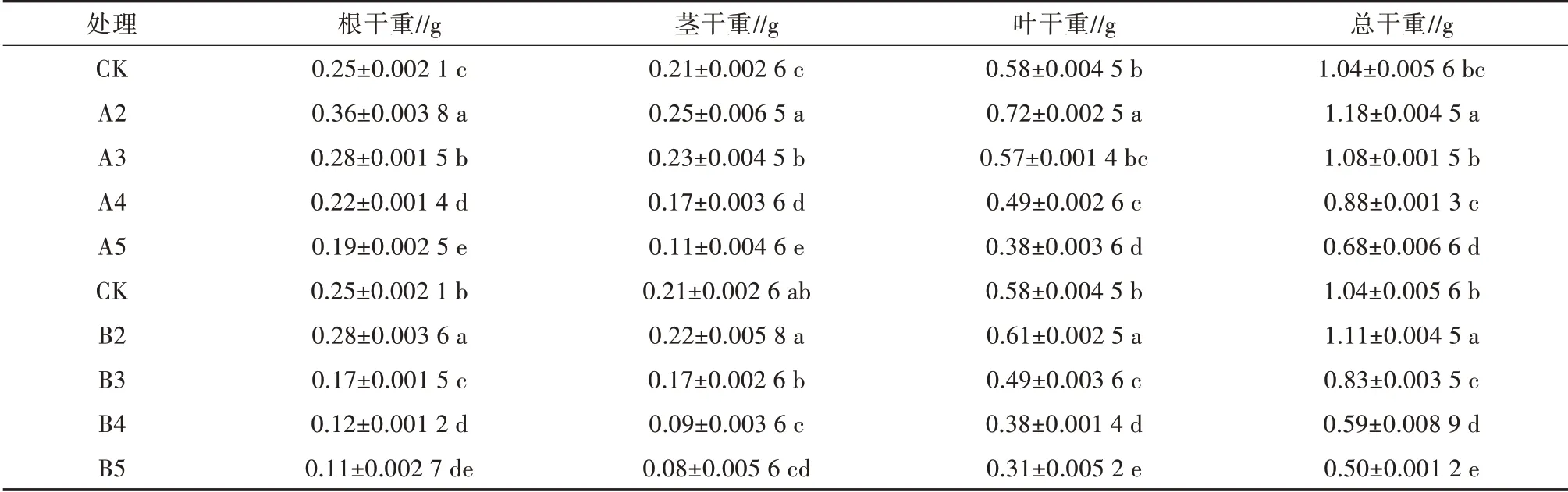
表1 Pb、Cd胁迫对幼苗生物量的影响
综上可知,一定浓度(Pb≤100 mg/L、Cd≤10 mg/L)下,泡桐1201幼苗生物量相比CK升高,且Pb胁迫下的促进作用更强,Cd胁迫下的促进作用较弱;但当胁迫浓度超过一定范围(Pb>100 mg/L、Cd>10 mg/L)时,泡桐1201幼苗总生物量显著受到抑制。
2.2 泡桐1201幼苗对Pb2+、Cd2+的转运及富集
由表2可知,Pb、Cd胁迫下,泡桐1201幼苗各部位重金属含量均表现为根>叶>茎,随着胁迫浓度的增加,各部位生物富集系数及转运系数均呈下降趋势。Pb胁迫下,根部Pb离子含量为69.47~285.63 mg/kg,叶片Pb离子含量为21.13~32.16 mg/kg,茎部Pb离子含量为10.12~25.97 mg/kg;Cd胁迫下,根部Cd离子含量为60.25~195.29 mg/kg,叶片Cd离子含量为25.02~41.44 mg/kg,茎部Cd离子含量为11.76~21.33 mg/kg。上述结果表明,重金属离子在泡桐1201幼苗体内转运能力较弱,且幼苗根部为吸收重金属离子的主要部位。
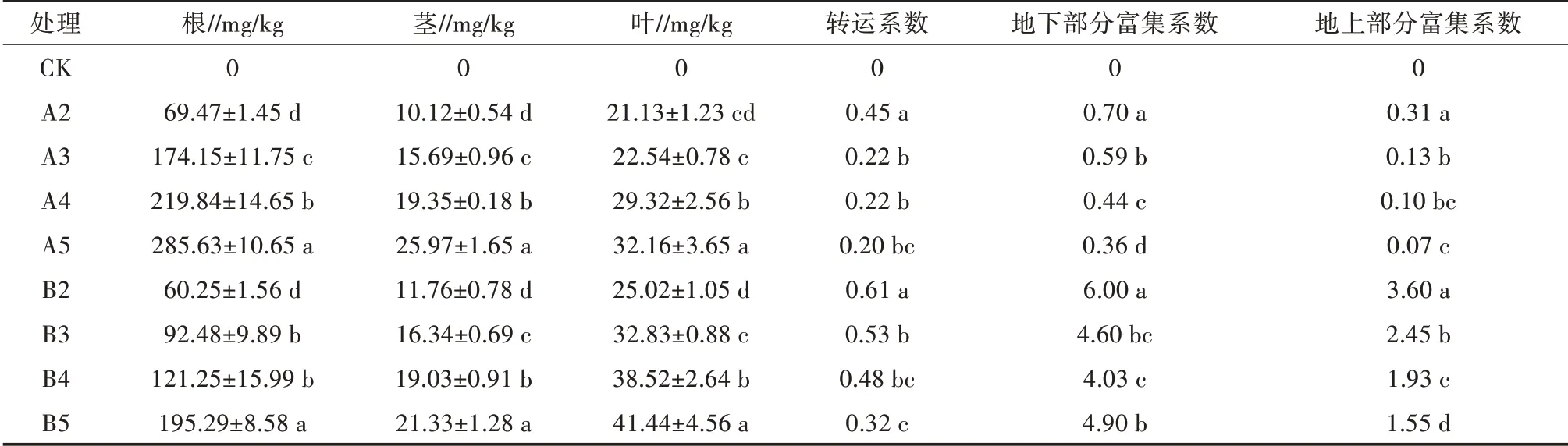
表2 Pb、Cd胁迫对幼苗各部位的重金属离子浓度和生物转移系数及富集的影响
2.3 Pb、Cd胁迫对泡桐1201幼苗MDA含量的影响
通过方差分析可知,Pb、Cd胁迫对泡桐1201幼苗MDA活性产生显著性差异(P<0.05)。由图1可知,随着重金属胁迫浓度的增大,泡桐1201根部及叶片MDA含量均呈增加的趋势,且随着重金属离子浓度的升高,MDA的含量也逐渐增高。其中,A2、A3、A4、A5处理下泡桐1201根部MDA含量分别为对照处理的1.02、1.05、1.27、1.37倍,叶片MDA含量分别为对照处理的1.05、1.08、1.15、1.26倍;B2、B4、B5处理下泡桐1201根部MDA含量分别为对照处理的1.05、1.37、1.43倍,叶片MDA含量分别为对照处理的1.10、1.18、1.31倍,而B3处理下泡桐1201根部、叶部MDA含量均与对照处理相当。

图1 Pb、Cd胁迫对幼苗MDA含量的影响
2.4 Pb、Cd胁迫对泡桐1201幼苗抗氧化酶活性的影响
2.4.1 Pb、Cd胁迫对SOD活性的影响 通过方差分析可知,Pb、Cd胁迫对泡桐1201幼苗SOD活性产生显著性差异。由图2可知,Pb胁迫处理下,泡桐1201叶片SOD活性与对照相比整体上变化趋势较复杂。其中,A4处理SOD活性达到峰值,比对照显著提高17.65%,A5比对照显著提高2.94%;根部SOD活性总体上呈先降低后升高的趋势,A3处理比对照显著降低13.46%,A5比对照显著提高17.31%。Cd胁 迫处 理下,B4处理 泡桐1201叶片SOD活性达到峰值,比对照显著提高11.76%,B2、B5处理比对照均提高5.88%但差异不显著;根部SOD活性总体上呈先下降后升高的趋势,B2、B3处理比对照分别显著降低7.69%、15.38%,B4、B5比对照分别显著提高3.85%、15.38%。且各离子浓度胁迫处理下,泡桐1201幼苗根部SOD活性均显著(P<0.05)高于叶片SOD活性。

图2 Pb、Cd胁迫对幼苗SOD活性的影响
2.4.2 Pb、Cd胁迫对POD活性的影响 通过方差分析可知,Pb、Cd胁迫对泡桐1201幼苗POD活性产生显著性差异。由图3可知,Pb、Cd胁迫处理下,泡桐1201幼苗根部和叶片POD活性均呈逐渐上升的趋势,且胁迫的金属离子浓度与幼苗各部位POD含量呈显著正相关。A5处理根部、叶片POD活性分别为对照的1.68、2.51倍。B5处理根部、叶片POD活性分别为对照的1.71、2.51倍。各离子同浓度胁迫处理下,泡桐1201幼苗根部POD活性均显著(P<0.05)高于叶片POD活性。

图3 Pb、Cd胁迫对幼苗POD活性的影响
2.4.3 Pb、Cd胁迫对CAT活性的影响 通过方差分析可知,Pb、Cd胁迫对泡桐1201幼苗CAT活性产生显著性差异(P<0.05)。由图4可知,Pb、Cd胁迫处理下,泡桐1201根部CAT活性呈逐渐上升的趋势,且随着胁迫浓度的增加,根部CAT活性越来越高。其中,A5、B5处理幼苗根部CAT活性分别为对照的2.11、2.33倍;但在泡桐1201叶片中,随着胁迫浓度的升高,叶片CAT活性呈先升高后降低的趋势,但每个处理的CAT活性均高于对照。其中,A2、B2处理叶片CAT活性均为对照的1.26倍。不同的是各离子浓度胁迫处理下,泡桐1201幼苗叶片中的CAT活性均显著(P<0.05)高于根部。

图4 Pb、Cd胁迫对幼苗CAT活性的影响
2.5 Pb、Cd胁迫对泡桐1201幼苗渗透调节物质含量的影响
2.5.1 Pb、Cd胁迫对游离脯氨酸含量的影响 通过方差分析可知,Pb、Cd胁迫对泡桐1201幼苗游离脯氨酸含量产生显著性差异(P<0.05)。由图5可知,随着胁迫浓度的增加,泡桐1201根部及叶片游离脯氨酸含量均呈逐渐增高的趋势。其中,A2、A3、A4、A5处理下泡桐1201根部游离脯氨酸含量分别为对照的2.22、2.82、4.25、5.30倍,叶片游离脯氨酸含量分别为对照的1.06、1.47、1.70、1.82倍;B2、B3、B4、B5处理下泡桐1201根部游离脯氨酸含量分别为对照的2.54、3.17、5.71、6.29倍,叶片游离脯氨酸含量分别为对照的1.18、2.41、2.88、3.12倍。

图5 Pb、Cd胁迫对游离脯氨酸含量的影响
2.5.2 Pb、Cd胁迫对可溶性蛋白质含量的影响 通过方差分析可知,Pb、Cd胁迫对泡桐1201幼苗可溶性蛋白质含量产生显著性差异(P<0.05)。由图6可知,Pb胁迫下,泡桐1201幼苗体内可溶性蛋白质含量随Pb、Cd胁迫浓度的增加呈先升高后降低的趋势。A3、B3处理根部及叶部中可溶性蛋白质含量均达最高值,A3处理根部、叶部分别为对照的2.27、2.46倍,B3处理根部、叶部分别为对照的1.57、1.56倍;随着Pb、Cd胁迫浓度的继续增加,泡桐1201幼苗根部及叶片可溶性蛋白质含量降低,A5处理根部、叶片可溶性蛋白质含量分别为对照的1.37、1.35倍,B5处理根部、叶片可溶性蛋白质含量分别比对照降低了4.65%、19.96%。各离子浓度胁迫处理下,泡桐1201幼苗叶片可溶性蛋白质含量均低于根部。
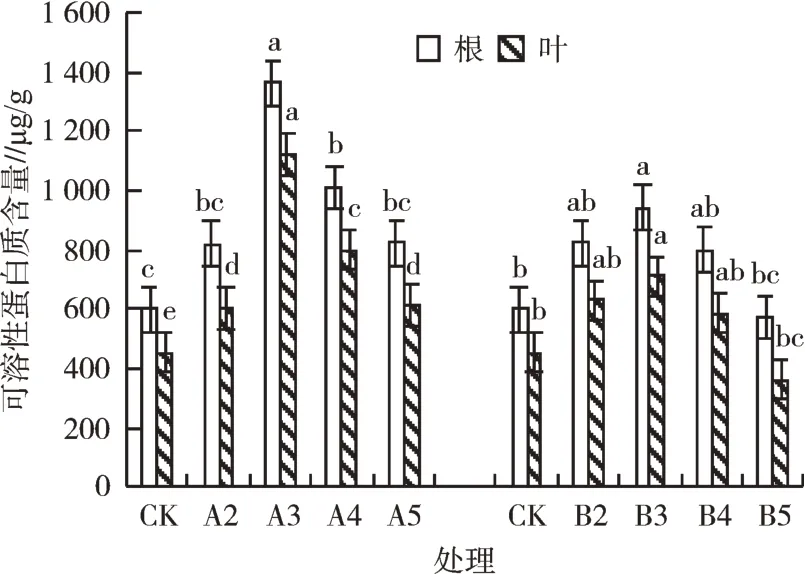
图6 Pb、Cd胁迫对可溶性蛋白质含量的影响
2.5.3 Pb、Cd胁迫对可溶性糖含量的影响 通过方差分析可知,Pb、Cd胁迫对泡桐1201幼苗可溶性糖含量产生显著性差异(P<0.05)。由图7可知,Pb、Cd胁迫处理下,随着胁迫浓度的增加,泡桐1201根部和叶片可溶性糖含量均呈先升高后降低的趋势。A3、B2处理叶片可溶性糖含量分别为对照的1.23、1.11倍,根部可溶性糖含量分别为对照的1.21、1.10倍,且均随胁迫浓度的增加,可溶性糖含量逐渐降低。各离子浓度胁迫处理下,泡桐1201幼苗根部可溶性糖含量均显著(P<0.05)高于叶片,但相同金属离子胁迫下泡桐1201幼苗根部与叶片的可溶性糖含量变化趋势保持一致。

图7 Pb、Cd胁迫对可溶性糖含量的影响
2.6 Pb、Cd胁迫对泡桐1201幼苗体内非蛋白巯基化合物含量的影响
2.6.1 Pb、Cd胁迫对NPT含量的影响 通过方差分析可知,Pb、Cd胁迫对泡桐1201幼苗NPT含量产生显著性差异(P<0.05)。由图8可知,Pb、Cd胁迫下,随着胁迫浓度的升高,泡桐1201幼苗各部位NPT含量呈先升高后降低的趋势,且叶片中NPT含量显著(P<0.05)高于根部。A3处理根部、叶片中NPT含量分别为对照的1.20、1.53倍;B3处理根部、叶片中NPT含量分别为对照的1.13、1.57倍。
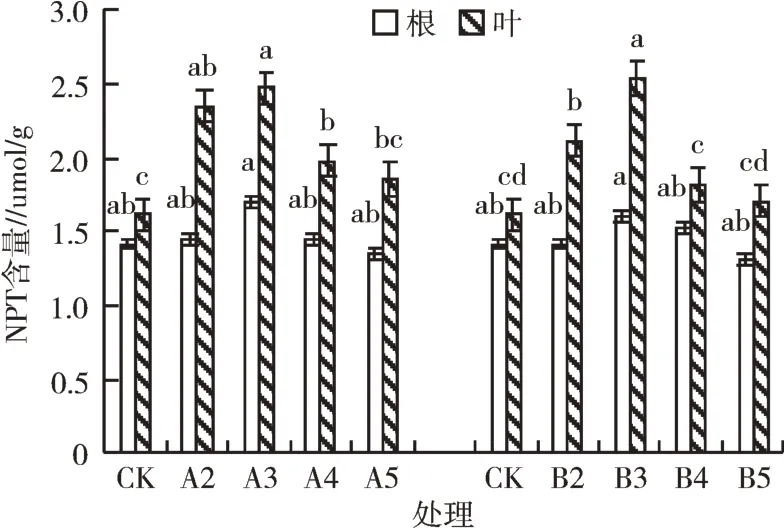
图8 Pb、Cd胁迫对NPT含量的影响
2.6.2 Pb、Cd胁迫对GSH含量的影响 通过方差分析可知,Pb、Cd胁迫对泡桐1201幼苗GSH含量产生显著性差异(P<0.05)。由图9可知,随着Pb、Cd胁迫浓度的增加,泡桐1201幼苗各部位GSH含量均呈降低的趋势,但是不同离子胁迫下根部GSH的含量均高于叶片。A5、B5处理根部GSH含量比对照分别降低27.94%、44.85%,叶片GSH含量比对照分别降低48.76%、52.07%。泡桐1201幼苗体内的GSH含量与Pb、Cd胁迫浓度呈显著负相关(P<0.05),随着胁迫浓度的增加,各部位GSH含量显著降低。

图9 Pb、Cd胁迫对GSH含量的影响
2.6.3 Pb、Cd胁迫对PCs含量的影响 通过方差分析可知,Pb、Cd胁迫对泡桐1201幼苗PCs含量产生显著性差异(P<0.05)。由图10可知,随着Pb、Cd胁迫浓度的增加,泡桐1201幼苗各部位PCs含量变化趋势不显著,但是叶片中PCs含量均显著高于根部(P<0.05)。不同浓度Pb胁迫下,泡桐1201幼苗体内PCs含量变化较复杂,A3处理中,泡桐1201根部及叶片PCs含量达峰值,分别为对照的3.58、4.51倍;不同浓度Cd胁迫下,泡桐1201幼苗各部位PCs含量随着胁迫浓度的增加呈先升高后降低的趋势,B3处理泡桐1201根部、叶片PCs含量分别为对照的3.41、4.17倍,达峰值;Pb、Cd胁迫均会促进泡桐1201幼苗PCs含量的增加,促进强度表现为Pb胁迫>Cd胁迫。

图10 Pb、Cd胁迫对PCs含量的影响
2.7 Pb2+、Cd2+在泡桐1201幼苗体内的亚细胞分布
由图11、图12可知,Pb、Cd胁迫下,泡桐1201幼苗体内Pb2+、Cd2+均主要分布在F1(细胞壁)和F3(可溶性组分)中。其中,Pb胁迫下,细胞壁和可溶性组分中Pb2+积累量分别占总量的49.62%~77.42%和12.14%~30.83%,在F2中占比较少,仅占10.45%~19.55%;Cd胁迫下,细胞壁和可溶性组分中Cd2+积累量分别占总量的50.61%~75.89%和12.74%~30.80%,在F2中Cd2+分布仅占11.37%~18.60%。随着Pb、Cd胁迫浓度的增加,Pb2+、Cd2+积累量在F1中占比均显著(P<0.05)增加,在F3中的占比显著(P<0.05)降低,在F2中占比也降低,表明细胞壁为吸收Pb2+、Cd2+的主要部位。

图11 Pb胁迫下Pb2+在泡桐1201幼苗体内的亚细胞分布
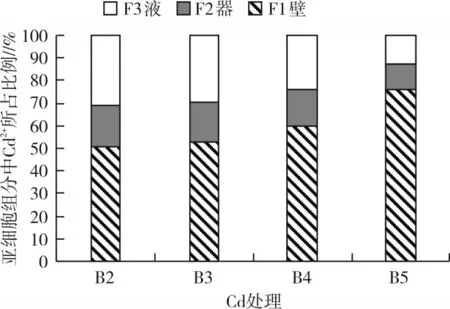
图12 Cd胁迫下Cd2+在泡桐1201幼苗体内的亚细胞分布
3 小结与讨论
在一定范围内,通过比较重金属胁迫下植物与对照组之间生物量的大小,可以反映植物对重金属的耐受性[16],生物量越大则表明植物越能固定和积累空间资源[17]。本试验中,当泡桐1201幼苗遭受低浓度Pb、Cd胁迫时,泡桐1201幼苗生物量略高于CK;但随着胁迫浓度的升高,泡桐1201幼苗生物量相比CK显著降低。这可能是因为低浓度重金属胁迫激发了泡桐1201幼苗自身防御系统,提高了新陈代谢水平,促进植物生长,所以在一定范围内泡桐1201幼苗的各部位生物量增加。高浓度Pb、Cd胁迫打破了泡桐1201幼苗自身防御承受能力,细胞结构和生理代谢功能被破坏,叶片萎缩,根系变黑,生物量显著下降。这与刘凤等[18]的研究结果类似,惠俊爱等[19]也证实了当Cd离子在玉米体内积累到一定程度时,其某些功能性细胞会被破坏。这说明重金属胁迫激活了植物代谢系统,加速植物对重金属的吸收,吸收的重金属又反过来抑制植物正常生长代谢[20]。
从本试验的相关结果可以看出,泡桐1201幼苗根部为富集重金属的主要部位,其次是叶片,最后是茎部,说明泡桐1201幼苗根部对Pb、Cd的滞留及富集作用强于茎、叶,从而减少Pb、Cd对地上部位的损伤,此结果与周振等[21]的研究结果相符。泡桐1201幼苗对Cd的吸收富集及转运能力强于Pb,地下部分重金属含量变化幅度大于地上部分,原因可能是与泡桐1201幼苗根系分泌物含量及由根系分泌物引起一系列变化有关。这与檀建新等[22]、阎雨平等[23]、石元值等[24]的研究结果一致。
MDA是生物体内自由基与脂质发生过氧化反应的最终产物之一,其含量与植物细胞膜脂过氧化和质膜被破坏程度呈正相关,是衡量植物逆境生长的重要指标[25]。本研究结果显示,Pb胁迫下,泡桐1201幼苗根部及叶片MDA含量均与胁迫浓度呈正相关;Cd胁迫下,幼苗根部及叶片MDA含量随着胁迫浓度的升高先降低后升高,但降幅不明显。表明泡桐1201幼苗抵抗Cd胁迫的能力强于Pb,高浓度重金属胁迫使幼苗体内活性氧大量累积,不能被及时清除,导致膜脂过氧化程度加重,植株受伤害程度增大,这与前人对Pb、Cd胁迫对芳樟幼苗的研究结果一致[26]。
植物体的抗氧化酶系统分为酶促系统和非酶促系统。当植物遭受重金属胁迫时,二者发挥协同作用可及时有效地抵御多种理化因子胁迫、清除细胞内活性氧、维护细胞膜结构完整性[27]。SOD属防御性酶,可清除活性氧[28,29],POD可把SOD的歧化产物H2O2转化成水,消除活性氧,产生细胞所需要的某些代谢物[30],CAT与SOD、POD具有协同作用,主要清除植物通过呼吸作用和光合作用等途径产生的过氧化物[31-33]。本研究结果显示,Pb、Cd胁迫下,泡桐1201幼苗叶片SOD活性无显著变化,随着胁迫浓度的增加,根部SOD活性呈先降低后升高的趋势。这可能是因为泡桐1201幼苗根部需要缓冲时间去适应重金属胁迫环境,导致根系SOD活性降低。随着重金属胁迫浓度的升高,3种酶活性均显著增强并产生协同作用,进而降低重金属胁迫环境对泡桐1201根部细胞造成的伤害。Pb、Cd胁迫处理下,泡桐1201幼苗叶片CAT活性呈先升高后降低的趋势,POD活性总体呈升高的趋势,这可能是因为泡桐1201幼苗叶片SOD活性可抵御低浓度重金属胁迫,POD和CAT在泡桐1201幼苗叶片遭遇高浓度重金属胁迫时,产生协同作用,联合清除ROS等物质。但有研究表明,随着Cd胁迫浓度的增加,鸡冠花幼苗叶片SOD活性先升后降,同期POD活性显著升高,CAT活性也先升后降,认为鸡冠花幼苗叶片清除细胞内活性氧时占主导作用的是POD[34]。这可能是由于试验材料、胁迫方式、处理时间等的不同,导致植物抗氧化酶系统受到不同程度的影响,后续机制可进一步深入研究。
Pb、Cd胁迫下,泡桐1201幼苗根部和叶部脯氨酸含量均与重金属胁迫浓度呈正相关,低浓度时,含量升高不显著;高浓度时,含量显著高于对照。说明低浓度重金属胁迫对泡桐1201幼苗伤害不明显,高浓度胁迫会导致泡桐1201幼苗体内活性氧大量累积,从而诱导植株体内积累的渗透调节物质脯氨酸发挥作用,联合其他抗氧化酶清除过量ROS,维持细胞内渗透压和含水量及质膜的完整性,增强植株的抗逆能力。
植物遭受逆境胁迫时,其体内的渗透调节物质可溶性蛋白质、可溶性糖及游离脯氨酸,可以清除活性氧自由基、维持细胞膜稳定、储存能量等,以满足植株正常生长代谢,同时可间接反映细胞损伤程度[35-37]。本试验结果显示,Pb胁迫下,随着胁迫浓度的升高,泡桐1201幼苗体内可溶性蛋白质及可溶性糖含量呈先上升后降低的趋势,但含量均高于对照。这说明面对低浓度的重金属胁迫,泡桐1201幼苗可通过调节自身可溶性蛋白质及可溶性糖含量来调节渗透势,抵御胁迫造成的伤害,但当胁迫浓度超出了泡桐1201幼苗自身承受能力时,细胞结构将被破坏,可溶性糖及可溶性蛋白质含量就会降低,这与张方静等[38]对月季的研究结果一致。同时,由于外界环境压力加强,泡桐1201幼苗需要利用更多的营养物质,导致体内可溶性糖含量降低。
植物在抵御重金属胁迫时,其体内产生的巯基化合物会缓解植物受毒害程度[39]。富集在植物细胞中的金属及重金属会诱导NPT的合成,并促使其螯合金属离子来降低重金属对植物的毒害作用[40]。金属离子的高度活性使其极易亲和-SH基团,细胞通过合成植物螯合素PCs,从而降低细胞质中游离金属离子浓度来保护基本生物分子的-SH基团[41,42]。本研究结果表明,Pb、Cd胁迫下,泡桐1201幼苗叶片NPT和PCs含量明显高于根部,说明重金属促进泡桐1201幼苗地上部分非蛋白巯基化合物的合成,以修复和保护蛋白质的-SH基团免受金属毒性而不被氧化,且NPT和PCs含量变化趋势均呈先升高后降低的趋势,表明低浓度Pb、Cd胁迫会诱导NPT和PCs的产生从而缓解植物所受重金属毒害作用;随着胁迫浓度的升高,二者含量逐渐降低,这可能是由于高浓度胁迫加剧了植物细胞过氧化损伤,植物体内ROS产生和清除的动态失衡,从而诱导合成NPT和PCs的能力下降。这与Mahdavian等[43]的研究结果一致。
GSH是一种重要的非酶抗氧化剂,能帮助细胞抵抗氧化反应,清除潜在的有毒ROS[44]。本试验结果表明,Pb、Cd胁迫下,泡桐1201幼苗中GSH降低的同时PCs显著增加,植物通过消耗较多的GSH合成PCs用于抵抗重金属胁迫;Cd胁迫下GSH含量降幅大于Pb胁迫,表明GSH在面对重金属胁迫时起重要作用。但当胁迫浓度较高时,GSH含量的急剧降低从而对其他细胞生长发育过程产生有害影响,最终表现为抑制生长,因此,泡桐1201幼苗体内对Pb、Cd具有更高耐受性可归因于PCs对金属元素的螯合能力增强。
泡桐1201幼苗在Pb、Cd胁迫后,Cd2+、Pb2+主要贮存在细胞壁中,其次是可溶性组分中,细胞器中积累量最低。这可能是因为泡桐1201幼苗细胞壁中多糖、蛋白质和木质素等物质对重金属离子的吸附固持,减少了金属离子的跨质膜运输,降低原生质体中的金属离子浓度,提高植株抗逆能力[45]。当细胞壁对Pb2+、Cd2+吸收达饱和状态时,Pb2+、Cd2+将进入可溶性组分。可溶性组分中柠檬酸、植物络合素、金属硫蛋白、硝酸和苹果酸等物质与游离Pb2+、Cd2+相结合,形成一种活性很弱的螯合态,从而避免造成细胞器损伤,甚至功能性丧失,此为液胞区室化效应[46]。因此,泡桐1201幼苗的耐性机理可能是植物通过细胞壁固持和细胞中液泡区室化实现对Pb、Cd的固定、络合、再分配,达到缓解Pb、Cd胁迫对细胞产生的毒害,从而增强泡桐1201幼苗对重金属Pb、Cd的耐性和富集能力。这与水稻[47]、龙葵[48]的耐性机理相似。
综合本试验以上分析可得,Pb、Cd胁迫对泡桐1201幼苗生物量的影响表现为低促高抑。泡桐1201幼苗对Cd的吸收及富集作用强于Pb,幼苗各部位重金属含量均表现为根>叶>茎,各部位生物富集系数及转运系数均呈下降趋势,泡桐1201幼苗根部起到了缓冲及保护屏障的作用,成为吸收富集Pb、Cd的主要部位。Pb、Cd胁迫下,随着胁迫浓度的升高,泡桐1201幼苗根部SOD活性先降低后升高,叶片SOD活性变化并不显著;叶片CAT活性随胁迫浓度的增加呈先升高后降低的趋势,根部POD活性和CAT活性与胁迫的浓度均呈正相关。可溶性糖含量随胁迫浓度的增强均呈先升高后降低的趋势,可溶性蛋白质含量也呈先升高后降低的趋势,游离脯氨酸含量与胁迫浓度呈正相关。NPT含量随着胁迫浓度的增加均呈先升高后降低的趋势,GSH含量呈降低趋势,PCs含量变化较复杂,但总体上呈先升高后降低的趋势,且叶片非蛋白巯基含量显著高于根部。亚细胞各组分中分布的Cd2+、Pb2+积累量与胁迫浓度呈正相关。结合以上结果分析可以看出,泡桐1201幼苗对低浓度Pb、Cd胁迫有较好的耐受性,从植株和细胞2个层次上探究泡桐1201幼苗对Pb、Cd的吸收规律及耐性机理,可以为泡桐在重金属污染修复方面的应用提供一定的理论研究和现实依据。

