透明细胞型肝细胞癌的临床及MRI特征分析
刘欣灵 林展 福建医科大学孟超肝胆医院医学影像科 (福建 福州 350025)
内容提要: 目的:探讨透明细胞型肝细胞癌的临床与MRI特征,提高对该病的认识。方法:回顾性分析2017年1月~2022年3月经手术病理证实的37例透明细胞型肝细胞癌的临床及MRI资料。结果:患者平均年龄56岁,男29例、女8例,24例合并有病毒性肝炎,肝硬化23例,甲胎蛋白升高21例。37例均单发,位于肝右叶最多见;肿瘤≥5cm有11例;30例形态规则,34例边界清楚,7例瘤内见脂肪信号,T2WI均为不均匀高信号,测得肿瘤ADC值为(1.09±0.31)×10-3mm2/s,31例表现为典型“快进快出”强化,6例表现为“慢进慢出”强化,27例病灶见假包膜样强化,3例合并门静脉癌栓,2例伴淋巴结转移。结论:透明细胞型肝细胞癌具有一定的临床及MRI特征,正确认识该病的特点,有助于该病的精准诊断与治疗。
原发性肝癌是我国常见的恶性肿瘤之一,具有生存率低、病死率高的特点,约75%~85%原发性肝癌为肝细胞癌(Hepatocellular carcinoma,HCC)[1,2]。HCC具有高度异质性,存在多种病理亚型,根据2019年WHO提出组织细胞学分类[3],其主要包括纤维板层型、硬化型、透明细胞型、富脂型、巨梁型、嫌色型、富中性粒细胞型和富淋巴细胞型,透明细胞型肝细胞癌(Clear cell hepatocellular carcinoma,CCHCC)临床少见,发病率低。据文献报道[4],CC-HCC预后优于非透明细胞型肝细胞癌。MRI因具有良好的软组织分辨力,以及多参数成像特点,在肝脏肿瘤诊断及治疗中具有重要价值,既往国内外对CC-HCC的MRI表现相关研究少见[5,6]。本研究旨在回顾性分析CC-HCC的临床及MRI表现,以提高对CC-HCC的认识,为临床精准治疗提供参考。
1.资料与方法
1.1 临床资料
收集本院2017年1月~2022年3月经手术病理证实为CCHCC患者37例。主要临床症状为右上腹不适,腹痛腹胀,食欲下降等,部分患者因体检超声检查发现肝脏肿块就诊。所有患者均行肝脏MRI多期动态增强检查,且术前均未接受过放射治疗、化疗、靶向治疗、射频消融或肝动脉碘油栓塞,各项临床及病理资料完整。
1.2 方法
采用Siemens Verio 3.0TMRI检查仪器,经常规定位后分别进行T1WI,T2WI及DWI扫描。各扫描序列及参数设置:T2WI FS横断位:TR2500ms,TE99ms,FOV380×380mm²,层厚5mm,层间距1mm;T2WI冠状位:TR1400ms,TE109ms,FOV400×400mm²,层厚4mm,层间距0.5mm;T1WI opp-in横断位:TR3.9ms,TE1.2ms,FOV380×380mm2,层厚5mm,层间距1mm;DWI横断位:TR4600ms,TE55ms,FOV:380×380mm²,层厚5mm,层间距1mm,b值为50、400和800s/mm²。增强检查采用T1WI vibe序列行多期动态增强扫描(TR4.5ms,TE2.0ms,FOV:380×380mm²,层厚3mm,层间距0.5mm)。对比剂注射方案:经肘静脉,按照0.2mmol/kg、流率2mL/s注射对比剂钆喷替酸葡甲胺注射液(Gd-DTPA),并于23s后启动动脉期扫描,50~60s行门脉期扫描,120s后行平衡期扫描。
1.3 图像分析
在PACS工作站回顾性分析MRI图像,主要观察指标包括肿瘤大小、数目、位置、形态、边界、肿瘤信号、有无假包膜、门静脉癌栓、淋巴结转移及强化方式。其中肿瘤大小以病灶所在最大层面进行最长径测量3次,取其平均值,ADC值测量是将ROI放置在肿瘤实性成分区域及相邻上下层面,尽可能避开血管、囊变、出血及坏死区域,测量三次取平均值。以上由2名5年以上专科经验的放射科医师分别对图像进行连续观察和评价,意见不统一时需协商讨论后得出。
2.结果
2.1 CC-HCC临床特点
37例CC-HCC患者年龄为34~79岁,平均56岁,男29例、女8例,合并有病毒性肝炎24例,其中乙型病毒性肝炎18例,丙型病毒性肝炎6例,肝硬化23例,甲胎蛋白升高21例。根据Edmondson-Steiner分级,Ⅰ级5例,Ⅱ级21例,Ⅲ级10例,Ⅳ级1例。
2.2 CC-HCC的MRI特点
37例CC-HCC患者均单发,有37个病灶;发生在肝脏单叶为主(33/37,89%),且以肝右叶最多;肿瘤最长径2.1~9.5cm,<5cm有26例,≥5cm有11例;绝大部分形态规则(30/37,81%),呈类圆形,7例表现为不规则形态;34例边界清楚,3例表现为边界模糊。在T1WI序列上,27例CCHCC表现为等-稍低混杂信号,5例为等信号,5例为低信号,T1WI反相位上观察到信号减低有7例,提示为瘤内脂肪,另有一例肿瘤破裂出血,在病灶内夹杂少量T1WI稍高信号区。而在T2WI序列上均表现为不均匀高信号,6例肿瘤可见坏死区域,表现为T1WI低信号T2WI高信号。37例CC-HCC在DWI序列均呈不均匀高信号,对应ADC图呈低或稍低信号,测得ADC值为(1.09±0.31)×10-3mm2/s,31例CC-HCC在多期增强扫描表现为典型“快进快出”强化,即动脉期肿瘤呈均匀或不均匀明显强化,门脉期和/或延迟期病灶强化低于肝实质。6例动脉期轻度强化,门脉期及实质期呈渐近性轻度强化。27例于门脉期和/或实质期见环形强化,提示为假包膜形成。此外,3例CC-HCC合并门静脉癌栓形成,2例伴有肝门区和/或腹膜后淋巴结转移,见图1~8。
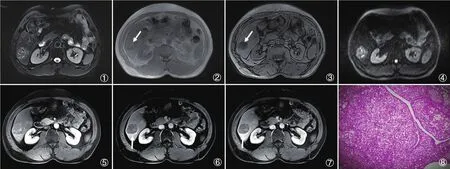
图1~8.CC-HCC,男,50岁[图1.T2WI抑脂轴位示肝VI段一类圆形混杂高信号肿块,边界清楚;图2~3.T1WI正反相位 正相位示病灶呈等稍低信号,反相位呈低信号,提示为瘤内脂肪(箭示);图4.DWI轴位示病灶呈混杂高信号;图5.T1WI动脉期示病灶呈不均匀明显强化;图6~7.分别为门脉期及实质期图像,病灶强化程度明显减退,并于病灶周围见一假包膜样强化(箭示);图8.镜下示肿瘤细胞部分为透明细胞,约占60%,细胞质丰富而透亮,间质见纤维增生分隔(HE×100)]。
3.讨论
3.1 CC-HCC临床及病理特点
CC-HCC是原发性HCC的一种特殊且罕见的亚型,发病率国内外学者报道存在一定差异[3],多数学者认为与CCHCC病理诊断标准不一致有关。CC-HCC病理特点是绝大部分肿瘤为透明细胞并见糖原在细胞质中蓄积,少部分肿瘤可同时呈现透明细胞和大泡性脂肪变性,通常边缘有一包膜存在。肿瘤分化程度以中高分化常见,糖原染色(PAS)几乎均为阳性[7]。目前,大多数学者认为透明细胞的比例>50%时诊断CC-HCC更可靠,但当临床怀疑为CC-HCC时,还需要进行额外的免疫组织化学检测以排除肝转移性透明细胞癌可能[8]。本文所回顾性分析的37例CC-HCC均以透明细胞成分>50%为标准,病理学所见与既往研究相仿。CC-HCC临床症状与其他类型HCC表现无殊,如右上腹痛、腹胀或腹部不适等。研究报道[9],CC-HCC好发于50岁以上人群,且男性发病率更高,男女比例约1.34:1。本研究CC-HCC发病平均年龄为56岁,但男性发病率明显高于文献报道[10],考虑与纳入研究样本量不一致有关。国内文献报道[5,11],CCHCC患有病毒性肝炎的比例高于非透明细胞型肝细胞癌,其中又以感染乙型病毒性肝炎常见,且多同时存在肝硬化基础疾病。AFP升高的患者比例低,且与非透明细胞型肝细胞癌及不同透明细胞含量的肝细胞癌无明显差异。本研究与既往研究报道基本一致。由于CC-HCC更容易形成包膜,因此外科手术切除是消除含有包膜的病变的有效方法,从而延长患者生存期。但尽管外科手术切除对治疗CC-HCC是有效的,但辅助治疗,如放射治疗,近年来也越来越受到关注。与普通型肝细胞癌相比,CC-HCC均具有良好的预后。
3.2 CC-HCC的MRI表现
既往学者主要是通过CT对CC-HCC影像特征进行分析研究,MRI研究相对少见[5-7,12]。笔者根据本组影像资料并复习国内外文献,对CC-HCC的MRI表现进行总结。在肿瘤一般特征中,CC-HCC多表现为单发,形态规则,边界清楚,且多位于肝右叶,部分肿瘤可位于肝脏边缘处。本组37例CC-HCC与文献报道类似。多数肿瘤体积较大,常常>5cm。本组37例CC-HCC最长径≥5cm仅11例,占比30%,与文献报道不同,但实际上各研究者观察到肿瘤大小差异显著,推测与各自所纳入研究样本量大小不一致有关[3-8,9]。本组有7例CC-HCC于T1WI正反相位上观察到脂肪信号,表现为T1WI正相位等或稍高信号,反相位对应区域见信号衰减,或在T1WI脂相上观察到高信号区。CC-HCC瘤内脂肪形成推测与该类肿瘤体积较大,肿瘤供血动脉不足和门静脉供血减少导致细胞质内糖原和/或脂肪堆积增加有关。有文献报道肿瘤内脂肪信号可能是CC-HCC的重要征象,但并非其特异性表现[13]。此外,CC-HCC亦可发生肿瘤破裂出血,但临床相对少见,在MRI上表现为病灶形态不规则,边缘模糊,出血在T1WI序列上呈稍高信号,T2WI呈等或低信号,增强扫描可见肿瘤包膜连续性中断,局部向外膨凸。本组有1例手术病理证实为CC-HCC破裂出血,MRI表现与既往报道一致[6]。CC-HCC在DWI序列上均呈不均匀高信号,ADC呈等或低信号,与普通型肝细胞癌所见类似。本组37例CC-HCC病灶ADC值为(1.09±0.31)×10-3mm2/s,与既往研究类似,但目前有关该类肿瘤的ADC值研究不多,其临床意义有待进一步研究[5]。大体病理标本上,CC-HCC多可见由肿瘤外周肝窦及局部纤维化组成的环形包膜,其形成可能与CC-HCC预后较好有关。据Liu QY等[6]报道CC-HCC假包膜形成率较高,MRI是检测HCC假包膜的可靠影像学检查,表现为在门脉期和/或延迟期环绕病灶边缘连续或断续均匀光滑,境界清楚的环形强化。本组有27例CC-HCC观察到假包膜样强化,与文献报道相符合[5,11,13]。文献报道[14]CC-HCC强化方式多样,其主要与透明细胞比例密切相关,当CC-HCC表现为典型“快进快出”强化方式,提示其透明细胞所占比例较低,该种强化方式与普通型肝细胞癌强化类似,其中“快进”即为动脉期非环形明显强化,形成的原因是肿瘤出现丰富新生血管,从而导致动脉血流量增多以及未成熟血管通透性增强。“快出”即为门脉期及实质期的非周边廓清,可归因于肝脏实质背景逐渐强化、肿瘤内对比剂早期静脉引流及肿瘤的门静脉供血减少等[15]。相反,当透明细胞比例较高时,肿瘤分化较好,表现为不典型“慢进慢出”强化方式。本组有31例CC-HCC表现为典型“快进快出”强化,6例表现为不典型“慢进慢出”强化。除此之外,本组有3例于门静脉期可见门静脉充盈缺损,考虑为癌栓形成,2例于肝门区及腹膜后观察到结节状软组织信号灶,术后病理证实为淋巴结转移。门静脉癌栓形成是HCC的特征性生长模式,门静脉侵犯是影响CC-HCC患者预后的独立危险因素,因此临床实际工作中,虽然门静脉癌栓及淋巴结转移出现率低,但仍需注意观察。
3.3 鉴别诊断
CC-HCC由于临床少见,影像医生对其认识缺乏,常常误诊为其他肝脏肿瘤。当CC-HCC病灶内含有脂肪组织时,需与其他含脂肝肿瘤相鉴别,如富脂型肝细胞癌和血管平滑肌脂肪瘤。富脂型肝细胞癌与CC-HCC的MRI表现类似,鉴别困难,但前者体积一般较CC-HCC小,通常表现出明显脂肪沉积,在T1WI反相位上呈现弥漫性或局灶性信号衰减区,临床上更常见于非酒精性脂肪肝和非酒精性脂肪性肝炎患者[16]。而血管平滑肌脂肪瘤属于肝脏血管周上皮样细胞肿瘤的一种特殊类型,好发于中年女性,而CC-HCC好发于男性,常合并有肝硬化基础疾病,且血管平滑肌脂肪瘤包膜少见,增强扫描动脉期发现病灶内粗大畸形血管及引流静脉早显,有助于与CC-HCC进行鉴别[17]。此外,CC-HCC还需与不典型肝血管瘤相鉴别,如硬化性血管瘤,后者一般无肝炎或肝硬化病史,好发于女性,在MRI平扫及增强检查上,不典型肝血管瘤与CC-HCC部分征象存在重叠,但不典型肝血管瘤的平均ADC值往往高于CC-HCC,这一点对于区分其他肝脏恶性肿瘤具有一定的价值[18]。
综上所述,CC-HCC在临床及MRI图像上具有一定的特征,多表现为肝右叶单发肿块,形态规则,边界清楚,部分瘤内可见脂肪信号,增强以典型快进快出强化方式多见且常可见假包膜样强化,熟悉该病MRI特点并结合临床资料,有助于提高诊断准确率,但确诊仍有赖于病理及免疫组织学检查。

