污水中微藻的生物絮凝采收技术及展望
孟倩雅,马桂霞,母锐敏,祁 峰,朱兆亮
(山东建筑大学市政与环境工程学院,山东济南 250000)
化石能源的过度使用导致以CO2为主的温室气体被大量排放〔1〕。为促进可持续发展,实现碳中和目标〔2〕,人类迫切需要寻求绿色可再生的新型能源,以应对环境恶化带来的挑战。作为第三代生物质能源,微藻因对环境适应力强、生长速率快、收获周期短、油脂含量高〔3〕,在生物燃料、高价值生物分子等方面具有潜在用途〔4〕,成为国内外学者研究的热点。利用微藻生产生物质能源包括微藻的培养、采收、油脂提取和转化几个环节,其中微藻的采收是微藻生物质利用的最关键步骤。
微藻的个体微小,细胞密度小,采收困难,采收成本较高(占总生产成本的20%~30%〔5〕)。此外,考虑到微藻的资源化利用,应尽可能减少采收导致的藻类死亡〔6〕。传统的物理、化学采收方法具有技术手段成熟、絮凝机理清晰、采收效率较高的优点,但成本高、能耗高,且往往对下游工艺造成影响,增加了微藻生物质能源的利用难度〔7〕。而微藻的单一培养对环境要求高,易被细菌污染,且需要额外的营养物质供给,难以实现工业化生产与利用。基于此,藻-菌共生生物技术应运而生。一方面,藻-菌共生体系对环境有高度的适应性〔8〕,拥有更强的抗逆能力;另一方面,该体系在减少CO2排放的同时〔9〕,还能利用生物絮凝方式促进藻类能源物质的产出和利用,实现污水净化与生物质能源回收利用的双重耦合。
微藻在污水处理及生物质能源产出中优势显著,但以生物絮凝法为重点的微藻生物絮凝采收技术尚未得到足够关注,目前有关研究也较为分散。笔者在简单梳理微藻采收主要技术方法的基础上,重点论述了以藻-菌共生污水处理系统中各种微生物为介导的新型生物絮凝法,旨在寻求节能高效、更具商业价值和发展潜力的新型絮凝采收技术,以期为今后微藻生物质能源的商业化应用提供理论和技术支持。
1 传统絮凝采收方法
1.1 物理采收法
传统的物理采收方法主要有浮选、离心、重力沉降、过滤及超滤、膜分离等〔10〕,其机理及优缺点如表1所示。

表1 传统物理采收方法的采收机理及优缺点Table 1 Harvesting mechanism,advantages and disadvantages of traditional physical harvesting methods
1.2 化学絮凝法
絮凝作用的一般机制有压缩双电层、电荷中和、吸附架桥、网捕卷扫。絮凝作用造成藻类悬浮液不稳定往往是一种或多种机制共同作用的结果〔15〕。常用化学絮凝剂及其特点见表2。
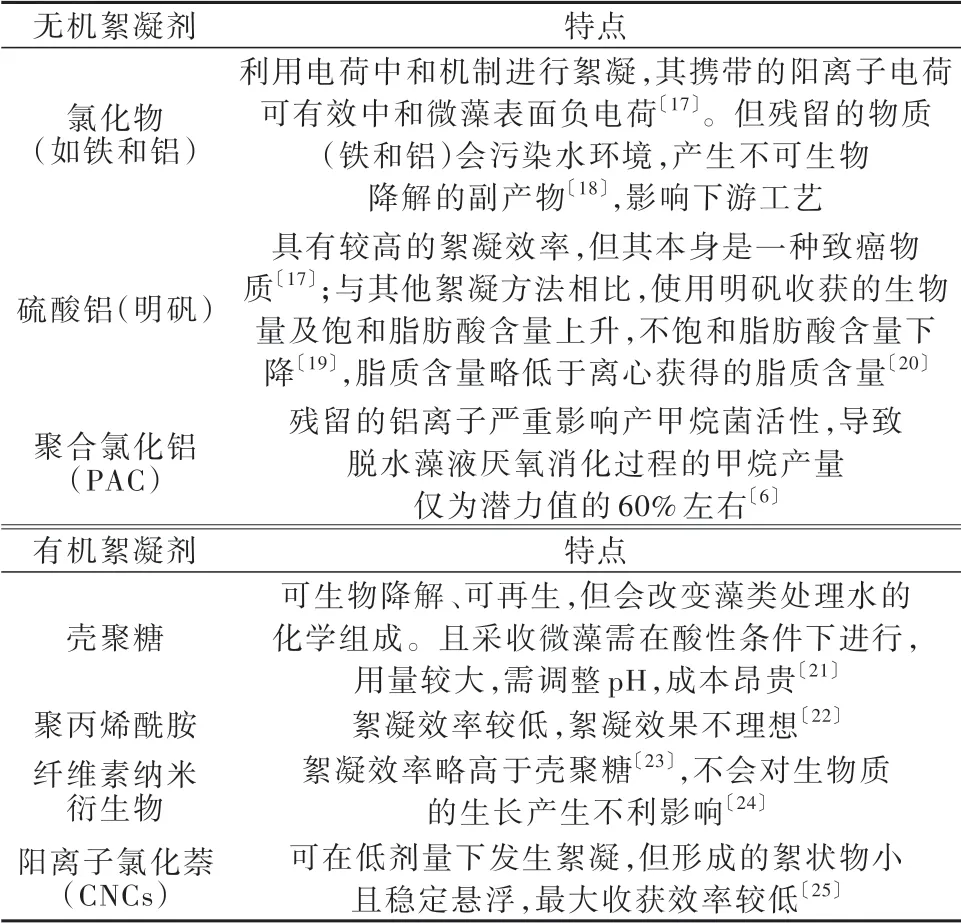
表2 传统无机絮凝剂和有机絮凝剂的特点Table 2 Characteristics of traditional inorganic and organic flocculants
综上可知,不同化学采收法对微藻中脂质含量的影响差别不大〔26〕,但会影响脂质成分〔27〕。使用絮凝剂帮助回收微藻需要向系统添加化学物质,使得总溶解固体增加〔28〕,根据絮凝剂和藻种的不同,其在循环水中的残留物可能会抑制或阻止藻类再次生长。
2 生物絮凝法
微藻的传统采收方法中,物理采收法普遍能耗较高,成本升高;化学絮凝剂会导致污染;电絮凝法则需要昂贵的交换电极〔26〕,且普适性较差。需开发成本低廉、环境友好且普适性高的新型絮凝方式,以满足当前微藻生物能源工艺的需要。生物絮凝法利用微藻自身分泌物或与微藻共培养的其他生物细胞诱导,促使目标微藻絮凝〔15〕。其中细菌和真菌均有良好的微藻收获潜力,其机理如图1所示。

图1 生物絮凝法机理Fig.1 Mechanism of bioflocculation
2.1 微藻自絮凝法
微藻自絮凝是培养基中的微藻在细胞特殊的表面特性或胞外分泌物作用下,不添加絮凝剂而彼此聚集黏附,自发生成絮凝物进而沉淀的现象〔16〕。1965年就有研究者发现,微藻在光线充足的池塘中能够自发形成絮体。研究表明,微藻自絮凝过程存在桥接和修补机制。当微藻细胞之间形成大的微藻细胞网时,涉及的机制为桥接;当微藻细胞之间更紧密附着,涉及的机制可能是通过絮凝微藻分泌的胞外多糖进行修补〔29〕。目前公认的微藻自絮凝机制有2种:(1)高pH条件下微藻悬浊液中形成带正电的离子沉淀物,在电荷中和作用下诱发絮凝〔30〕。微藻通过光合作用消耗水中的CO2,使pH升高,促进正磷酸盐的沉淀,吸附并与带负电的微藻反应,最终导致微藻的聚集和沉淀〔31〕。(2)部分藻种生理活动产生的胞外聚合物(EPS)能够作为生物絮凝剂诱发絮凝〔30〕。EPS是由微藻细胞壁分泌的一层黏性基质,主要由碳水化合物、蛋白质、脂类、核酸、糖蛋白和磷脂组成〔32〕。研究发现〔33〕,微藻絮凝活性的增强与EPS的碳水化合物浓度密切相关,虽然EPS作为生物絮凝剂不会增加微藻自身的脂质含量,但可提高38%~88%的微藻脂质产量,使藻类的絮凝收获速度提高1.4~1.9倍。Meng WANG等〔34〕研究表明,在高氮低磷的污水条件下培养有助于Chlorellasp.和Micractiniumsp.EPS的产生。
利用微藻的自絮凝直接进行絮凝采收,一方面可提高絮凝效率,避免二次污染,另一方面降低了微藻细胞收获过程的总成本〔35〕。其缺点在于并非所有种类的微藻都存在自絮凝〔36〕。
2.2 自絮凝微藻介导的微藻生物絮凝
目前已鉴定的微藻物种中只有少数具有自絮凝能力,如Ankistrodesmus falcutus〔37〕、C.vulgarisJSC-7、Ettlia texensisSAG79.80、Scenedesmus obliquus。一些研究者尝试用自絮凝藻种增强非絮凝微藻细胞的絮凝作用。Suolian GUO等〔38〕对自絮凝藻种Scenedesmus obliquusAS-6-1的胞外聚合物进行表征,发现其可诱导多种自由悬浮的微藻细胞发生强烈絮凝,这是对自絮凝微藻絮凝剂特性的首次报道。S.SALIM等〔39〕将自絮凝活性较好但脂质产量较低的自絮凝藻种Scenedesmus obliquus与非絮凝产油藻共同培养,明显缩短了非絮凝微藻的回收时间,并获得较高的脂质产量和采收率。M.A.ALAM等〔40〕用Chlorella vulgarisJSC-7作为自絮凝微藻絮凝剂,对自由悬浮的C.vulgarisCNW11和Scenedesmus obliquusFSP进行絮凝采收,采收率达到80%以上。
自絮凝藻种与非絮凝藻种共同培养不需要额外的营养物质和培养系统。此外,自絮凝微藻也可以积累脂质,进一步向下游加工成生物柴油,且不涉及额外的操作和投资成本来处理沉积物(微藻生物量)〔39〕。整个絮凝过程无需添加任何化学物质,是一种无污染、可持续且经济有效的采收方法。
与自絮凝微藻絮凝剂类似,近年来诸多研究者以低毒性且絮凝快速的天然植物基絮凝剂作为聚合物絮凝剂的替代品,将植物来源的生物聚合物絮凝剂用于废水处理,收获微藻生物量〔41〕。但与自絮凝微藻絮凝剂相比,天然植物基絮凝剂的絮凝效率中等,絮凝采收能力并未表现出明显优势,又因涉及提取工艺问题,采收成本增加,故在此不再赘述。
2.3 细菌介导的微藻生物絮凝
藻、菌之间的关系主要有互利共生与竞争抑制两类〔42〕,在自然条件下,微藻很难保持单一纯藻或混藻状态,而往往会与细菌形成藻-菌共生体。相比单藻培养和细菌培养,藻-菌共生培养方式对环境变化有高度适应性〔8〕,且在利用藻类处理污水的技术中,藻-菌共生系统具有更强的净化优势〔43〕。在藻-菌共生水处理体系中,微藻的絮凝过程是藻-藻、藻-菌、菌-菌与污水中物质等共同作用的结果〔30〕。Chun WAN〔35〕等从活性污泥中分离出一株生物絮凝剂产生菌Solibacillus silvestris,培养48 h后,产生的生物絮凝剂对具有良好产脂潜力的海洋微藻Nannochloropsis oceanicaDUT01的最高絮凝率可达90%。该生物絮凝剂对Nanno⁃chloropsis oceanicaDUT01藻细胞的生长无不良影响,因此可重复使用以降低采收成本。
事实上,藻-菌共生系统中细菌对藻类絮凝的影响是复杂的,细菌的多种代谢分泌物均可促进微藻细胞的絮凝。A.RAY等〔44〕研究发现,细菌产生的γ-谷氨酸可以产生聚γ-谷氨酸,而聚γ-谷氨酸被证明是一种有效的生物絮凝剂。当细菌胞外分泌物用作生物絮凝剂时,絮凝效率比化学絮凝剂(如聚丙烯酰胺和硫酸铝)高得多,收获率达到70%以上。Paenibacillussp.AM49在pH为11的条件下对Chlorella vulgaris的絮凝率达到86%。细菌培养物的上清液用作絮凝剂时,在适宜的pH和温度条件下,微藻细胞能在5 min内快速沉淀,絮凝率为83.67%。Jimin LEE等〔5〕对Chlorella vulgaris进行培养,发现无菌培养物获得2%的絮凝活性,细菌培养物则获得94%的絮凝活性。进一步研究证明,细菌通过胞外代谢物增加絮凝物的大小使微藻沉淀,絮凝物的尺寸比其实际性质更能影响微藻絮体的沉降特性。
细菌分泌产生的EPS在活性污泥表面和絮体内普遍存在,可通过吸附作用将悬浊液中的微藻富集起来,形成的聚生体在抵御对细胞有毒有害的物质时表现良好。除了能分泌EPS,微藻还能分泌可溶于水的前体物质,形成一种透明的胞外颗粒物(TEP)〔45〕。TEP类似于EPS,但在尺寸和结构上更大〔46〕。研究表明,异养细菌与微藻的相互作用可能影响TEP的形成和微藻聚集,增加聚集体的形成和颗粒的下沉〔47〕,对污水环境中的生物絮凝和收获有很大的潜在影响〔48〕。
酰基高丝氨酸内酯(AHLs)是革兰氏阴性菌产生的一种通讯信号,是细菌群体感应反应的介体〔49〕。研究发现,藻类能够感知并响应AHLs信号,细菌可利用AHLs影响微藻的基因表达,诱导微藻的自絮凝。Dandan ZHOU等〔50〕研究表明Chlorophytasp.通过分泌芳香蛋白对AHLs作出响应,促进该藻的自絮凝。没有AHLs存在下藻细胞基本处于自由悬浮状态,而AHLs存在时微藻的絮凝沉降效率高达41%。
污水处理中的藻-菌共生系统利用的是藻类和细菌之间的共生关系〔51〕。混合藻类的光合作用与细菌群落的呼吸作用之间存在有机、无机养分的交换,使得微藻生物量激增〔52〕,可沉降絮凝物的形成与微藻相关细菌及其胞外代谢物之间存在直接的相关性。在对微藻絮凝采收并加以利用的整体工艺过程中,细菌作为一个整体可能比单独的细菌胞外代谢物发挥更深远的作用〔5〕。微藻收获与油脂提取相结合是能量密集型工艺,约占工艺过程总能量的90%〔53〕。藻类细胞壁坚硬而厚,由复杂的碳水化合物和糖蛋白组成,因而需要额外的预处理步骤破坏微藻细胞壁,以大量回收脂质〔48〕。寄生于藻类细胞壁或其相关鞘中的细菌可促进微藻细胞壁降解〔54〕,从而大大降低操作能量。此外,细菌的倍增时间短、絮凝效率高,基于细菌的絮凝不受化学污染。但该过程会导致微生物污染,可能影响用于食品生产的微藻生物量的质量,因而以细菌为介导的微藻生物絮凝更适于生物燃料的生产〔26〕,该方法的物种特异性和环境安全性限制了其在工程中的规模化应用〔44〕。
2.4 真菌介导的微藻生物絮凝
不同于细菌通过细胞黏附或胞外分泌物诱导微藻絮凝,丝状真菌作为一类有代表性的生物絮凝剂,能够自行造粒,对微藻的捕获效率高〔55〕。真菌的自制粒可通过凝固机制和非凝固机制解释。在曲霉属代表中观察到的凝固机理涉及孢子凝结导致聚集体颗粒的形成,最终使真菌形成密集的球形聚集体〔56〕。非凝固机制则是孢子萌发成菌丝,进而交织成小球。
Hui WANG等〔57〕在激光扫描共聚焦显微镜下对其培养的藻菌群落进行观察,发现丝状真菌穿插在微藻细胞之间,与藻类细胞紧密结合。Wenguang ZHOU等〔58〕将丝状真菌球粒形成菌与微藻在连续搅拌下共培养,形成体积远大于藻类的真菌-藻类颗粒,通过简单的过滤即可收获。研究发现,真菌制粒对藻类脂质水平及废水处理效率起到添加剂和协同作用〔55〕。此外,一些真菌的脂质含量超过真菌总生物量的30%〔59〕,使得高油真菌成为良好的生物柴油原料,其可与含油微藻一起直接转化为生物燃料,获得更高的经济效益。
Jiao JIANG等〔60〕首次利用细菌和丝状真菌共同收获污水中的小球藻。与细菌-微藻共生体相比,细菌-真菌-小球藻共生系统中形成了更紧密的絮体。细菌通过黏附与微藻纠缠形成细菌-小球藻絮体,丝状真菌则通过桥接形成菌丝网捕获细菌-小球藻絮体〔61〕,形成更稳定的絮状物。研究发现,添加的细菌和真菌对产油微藻的含油量和品质并无负面影响。
生物絮凝,尤其是微藻辅助絮凝,是对其他需商业化的收获方法的创新性改进。采用这种方法可使微藻细胞不受损伤而保持完整性,相关投资成本可忽略不计。在工业规模上,培养基可以重复使用,减少了营养物质的投加成本和对水的需求〔29〕。
3 结论与展望
(1)在各项采收技术中,传统絮凝采收方式的技术手段相对成熟,但普遍存在高能低效或二次污染问题,生物絮凝则有良好的发展潜力。
(2)通过基因改造开发新的高脂絮凝菌株是未来获取微藻生产生物燃料的有效途径。利用基因转移对优质藻类菌株进行工程改造以引发絮凝,或将成为未来商业化收获微藻细胞最有前途的方法之一。
(3)对藻-菌系统中藻菌共生关系的深入研究,是人为调控和诱发微藻絮凝,获取更清洁绿色生物燃料的关键所在。结合基因工程技术,以收获生物质的最终用途作为首要考虑因素,制定合适的收获策略,同时在释放转基因菌株前评估其对生态环境的威胁,遵守环境友好、节能高效的生态要求,将为微藻生物燃料技术的工业化生产与应用提供有力的技术支持及长远的工艺保障。

