生慧汤对APP/PS1雄性AD小鼠海马内APP代谢产物的昼夜变化影响*
文 纯,游秋云,王 平,丁 莉**
(1.湖北中医药大学药学院 武汉 430065;2.湖北中医药大学老年医学研究所 武汉 430065)
据报道[1],阿尔兹海默病(Alzheimer Disease,AD)在我国65岁以上老年人群中发病率为5%。而随着中国社会人口结构迈入老龄化,老年人口基数的增大,预估2030年我国AD患者数量接近1500万,其治疗将会给社会带来沉重负担。目前研究认为[2],可溶性β淀粉样蛋白(Amyloid beta-Peptides,Aβ)的脑内水平变化与AD发病密切相关,而可溶性β淀粉样蛋白主要是由淀粉样前体蛋白(Amyloid beta-Protein Precursor,APP)的淀粉样蛋白代谢途径生成,早老蛋白基因1(Presenilin-1,PS1)是APP代谢过程中γ分泌酶的亚单位,PS1基因发生突变,会特异性地促进Aβ1-42的形成[3]。因此,研究APP代谢产物显得尤为重要。课题组前期研究发现[4-6],APP/PS1双转基因小鼠在5月龄时,白天活动时间增加、休息减少,丧失昼伏特性,白昼与黑夜的活动时间不具有昼夜差异性。这并不符合啮齿类动物昼伏夜出的生活习性,由此推测其自主活动节律性开始发生明显紊乱。同时也有研究表明[7],随着白昼与黑夜之间活动规律差异缩小,会影响认知行为以及突触的可塑性。已有研究显示[8],随着年龄增长,老年人群常发生的昼夜节律紊乱会增加AD的患病风险,这可能是由于中枢昼夜节律的紊乱会引起APP代谢紊乱,导致Aβ的异常沉积[9],同时Aβ在脑内的代谢与昼夜节律以及学习记忆联系紧密[10,11]。APP代谢受到α、β、γ三种酶共同调控[12-14],代谢产物包括sAPPα、sAPPβ和Aβ。根据调控APP代谢的酶不同[15],将APP水解分为两类:一是淀粉样蛋白代谢(β、γ酶调控),由β、γ酶对APP进行酶切水解,生成Aβ;二是非淀粉样蛋白代谢(α酶调控),由α酶对APP进行酶切,水解后的主要产物是sAPPα。
生慧汤出自《辩证录·健忘门》,常用于治疗失眠、健忘,由熟地黄、山茱萸、远志、生枣仁、柏子仁、人参、茯神、石菖蒲以及白芥子九味中药材组成。生慧汤研究主要与睡眠及昼夜节律有关[16,17],一是生慧汤可减轻睡眠剥夺对神经元的损伤,可能是与其调节PSD95和SYN表达及调控凋亡蛋白Bcl-2、Bax的表达有关;二是生慧汤能够上调节律基因Bmal1的表达,降低IL-6、TNF-α的含量,从而调节昼夜节律紊乱改善AD。而生慧汤对AD痴呆模型APP代谢产物的昼夜变化影响少有报道。
因此,本文采用生慧汤干预APP/PS1双转基因小鼠,通过酶联免疫吸附(ELISA)检测不同时间段取出的海马组织sAPPα表达水平,对海马β淀粉样蛋白1-40、β淀粉样蛋白1-42表达进行免疫印迹分析,免疫组化(IHC)检测海马CA1区Aβ1-40蛋白的表达,以此研究生慧汤对AD模型小鼠海马内APP代谢产物的昼夜变化影响。
1 材料与方法
1.1 实验动物
AD模型动物:5月龄SPF级雄性APP/PS1双转基因小鼠56只,购自辽宁长生生物技术股份有限公司,许可证号SCXK(辽)2020-0001,对照组动物:5月龄SPF级雄性C57BL/6J小鼠14只,许可证号SCXK(辽)2020-0002。饲养在湖北中医药大学老年医学研究所动物房屏障环境,允许自由摄食与饮水。
1.2 生慧汤的制备
生慧汤:由熟地黄30 g,山茱萸12 g,远志6 g,生枣仁15 g,柏子仁(去油)15 g,茯神9 g,人参9 g,石菖蒲1.5 g,白芥子6 g组成,购自湖北中医药大学药房,批号:20201201。所有药材按组方比例称取,加入称取药材总重量的8倍量水浸泡1 h,加热至沸腾开始计时,1 h后滤取药液。药渣加水重复以上操作,滤取药液。合并药液,浓缩至1.35 g/mL、2.70 g/mL,4℃保存。
1.3 试剂与仪器
一抗:GAPDH抗体;Aβ1-40抗体、Aβ1-42抗体(武汉赛培生物科技有限公司,货号:SP11457,SP11731);二抗:羊抗兔二抗,羊抗鼠二抗(Servicebio,货号:GB21302,GB21303);sAPPαELISA试剂盒(美国IBL公司,货号:27734),RIPA裂 解 液、SDS-PAGE凝 胶 制 备 试 剂 盒(Servicebio,货号:G2002,G2003)。
RT-6100酶标仪(Rayto),D3024R台式高速冷冻离心机(DRAGONLAB),TSY-B脱色摇床(Servicebio),BV-2垂直电泳仪(Servicebio),DMS-2型Morris水迷宫(中国医学科学研究院药物研究所),ZH自发活动分析系统(淮北正华生物仪器设备有限公司)。
1.4 实验分组及给药
将56只雄性APP/PS1转基因小鼠按随机数字表法分为:模型组、褪黑素组、生慧汤低剂量组、生慧汤高剂量组4组,每组14只。对照组为5月龄C57BL/6J小鼠,14只。按体表面积折算等效剂量,分别计算给药剂量,褪黑素组(0.78 mg·kg-1·d-1)、生慧汤高、低剂量组(27.0 g·kg-1·d-1、13.5 g·kg-1·d-1,等 效 剂 量 的2倍、1倍),对照组与模型组灌胃相同体积的生理盐水,给药容量均为10 mL·kg-1,每日上午9:00灌胃,连续30天。
1.5 水迷宫实验
第27天,进行水迷宫行为学实验,预先向水池中加水至没过平台2 cm,用奶粉将水池颜色染成乳白色掩盖平台,避免小鼠因视觉而找到平台。对小鼠进行训练,90 s内小鼠未找到平台,人工引导小鼠至平台,停留15 s,训练三天,第四天(第30天)进行定位航行试验,将小鼠面向池壁放入水中,找到平台停留3 s后,系统自动停止计时,找到平台时间为上平台潜伏期,90 s内未找到平台记录为90 s。第31天进行空间探索实验,撤去平台后,将小鼠面向池壁放入水中,记录90 s内小鼠穿越原平台次数。
1.6 动物取材
连续灌胃30天后,第31天行为学实验结束后,小鼠脱颈椎处死,断头,置于铺有一张滤纸的冰袋上,用眼科剪刀小心从正中矢状位剪开0.5 cm,用镊子剥去小鼠颅骨,分离脑组织,剥离海马组织置于EP管,放入冰中,取材结束后放入-80℃冰箱保存备用。
1.7 ELISA法检测不同时间段海马中sAPPα表达水平
从-80℃冰箱中取出海马组织,称取少量,置于匀浆机匀浆,离心15 min(相对离心力为3304 g),吸取上清液,按试剂盒说明书进行检测。
1.8 Western Blot法检测β淀粉样蛋白1-40和β淀粉样蛋白1-42
从-80℃冰箱中取出海马组织,剪碎,加入裂解液,匀浆,之后置于匀浆管中,放置冰上裂解30 min,每5 min震荡一次,12000 r/min,离心10 min,取上清液,按十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium Dodecyl Sulfate PolyAcrylamide Gel Electrophoresis,SDS-PAGE)制备试剂盒说明书制备凝胶,转膜,按抗体说明书加入一抗、二抗,凝胶图像分析系统进行分析,检测小鼠海马组织Aβ1-40和Aβ1-42蛋白表达水平。
1.9 免疫组织化学法检测小鼠海马CA1区β淀粉样蛋白1-40的表达
每组4只小鼠小心取出完整全脑,全脑表面若有血残留,用生理盐水冲去表面血,放入装有固定液的标本瓶,石蜡包埋,切片,染色,拍照,观察小鼠海马CA1区Aβ1-40蛋白表达情况,并采用image j软件分析计算平均光密度,进行比较。
1.10 统计学处理
2 结果与分析
2.1 水迷宫结果
结果如图1、图2所示,与对照组相比,模型组小鼠上平台潜伏期延长,穿越平台次数减少(P<0.01、P<0.01);与模型组相比,生慧汤给药组小鼠上平台潜伏期缩短,穿越平台次数增加(P<0.01、P<0.05)。
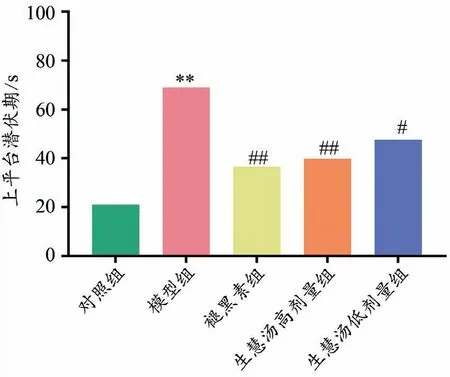
图1 各组小鼠上平台潜伏期(n=14)

图2 各组小鼠穿越平台次数(n=14)
2.2 生慧汤对各组小鼠海马sAPPα表达水平的影响
2.2.1 sAPPα总量比较
结果如图3所示,与对照组相比,模型组小鼠海马组织sAPPα总量减少(P<0.01);与模型组相比,生慧汤不同剂量组小鼠海马组织中sAPPα总量增加(P<0.01、P<0.05)。

图3 小鼠海马组织sAPPα总量比较(pg/mL,n=10)
2.2.2 sAPPα含量昼夜差异比较
结果如图4所示,通过比较两个不同时间段(12:00与24:00)sAPPα含量,发现对照组小鼠海马内sAPPα含量具有明显昼夜差异(P<0.01),而模型组sAPPα含量的昼夜差异现象消失(P>0.05);生慧汤高剂量能够恢复sAPPα含量的昼夜差异表达(P<0.01)。

图4 小鼠海马中sAPPα昼夜差异比较(pg/mL,n=5)
2.2.3不同时间段的sAPPα含量比较
结果如图5所示,12:00时,与对照组相比,模型组小鼠海马内sAPPα含量明显下降(P<0.01);与模型组相比,褪黑素组、生慧汤高剂量组sAPPα含量明显增加(P<0.01),生 慧 汤 低 剂 量 组sAPPα含 量 无 差 异(P>0.05);24:00时,与对照组相比,模型组sAPPα含量明显下降(P<0.01);与模型组相比,生慧汤高剂量组sAPPα含量无差异(P>0.05),生慧汤低剂量组sAPPα含量明显增加(P<0.05)。(见图5)
2.3 生慧汤对海马组织β淀粉样蛋白表达水平的影响
结果如图6所示,与对照组相比,模型组小鼠海马组织Aβ1-40和Aβ1-42蛋白表达水平明显升高(P<0.01);与模型组相比,生慧汤高剂量组小鼠海马组织Aβ1-40和Aβ1-42蛋白表达水平明显下降(P<0.01),生慧汤低剂量组小鼠海马组织中仅Aβ1-40蛋白表达下降(P<0.05),对Aβ1-42蛋白的表达影响不显著(P>0.05)。

图6 各组小鼠海马Aβ1-40和Aβ1-42蛋白表达
2.4 生慧汤对小鼠海马CA1区Aβ1-40表达的影响
与对照组相比,模型组小鼠海马CA1区中Aβ1-40表达明显增加(P<0.01);与模型组相比,生慧汤不同剂量组Aβ1-40表达不同程度减少(P<0.01、P<0.05)。
3 讨论

图7 小鼠海马CA1区Aβ1-40表达免疫组化染色图片(400×)

图8 各组海马CA1区中Aβ1-40含量差异比较(n=4)
目前,有关AD的发病机制主要分为:Aβ学说、Tau磷酸化学说、基因突变学说、炎症学说、胆碱能学说、氧化应激学说。其中,大脑内Aβ大量沉积所形成的老年斑块是AD患者最为明显的病理学特征,与此同时,研究较为关注的是Aβ与tau蛋白、炎症、胆碱能以及氧化应激之间的联系。本文从昼夜节律切入,旨在研究昼夜节律对Aβ前体蛋白APP的影响,以此探讨昼夜节律改善AD的可能机制。
3.1 sAPPα对APP代谢的影响及sAPPα的昼夜节律性
APP主要是通过非淀粉样蛋白代谢途径水解[18,19],在sAPPα含量达到某一特定值时,会对APP的淀粉样代谢途径进行负调控,可能正是这种负调控机制,能够减少Aβ的生成,降低Aβ脑内水平,起到了保护神经元细胞作用[20,21],发挥抗AD作用。另有研究证明[22],随着昼夜的交替,脑内的sAPPα水平也呈现昼夜节律性变化,含量从白天到夜间呈逐渐升高趋势,觉醒状态时降低而睡眠状态时升高。而节律的紊乱可能会引起APP的代谢发生异常:APP非淀粉样蛋白代谢途径减弱,降低了sAPPα水平,并且sAPPα水平的昼夜节律性变化消失,而APP的淀粉样蛋白代谢途径则会相应增强,该代谢途径会产生可溶性Aβ肽,也就是说促进了可溶性Aβ肽的生成[23,24],而Aβ的增加和异常沉积会引起AD的发生和加重。
3.2 结果
Morris水迷宫结果表明,生慧汤不同剂量组上平台潜伏期明显缩短,穿越平台次数明显增加。生慧汤高剂量组的sAPPα含量在全天总量、各时间段含量均明显增加,同时Aβ1-40和Aβ1-42蛋白表达受到抑制。sAPPα的含量升高提示APP非淀粉样代谢活动增强,结合Aβ1-40和Aβ1-42蛋白表达受到抑制,提示痴呆症状减轻的原因,可能是随着sAPPα含量的升高,减弱了APP淀粉样代谢活动,减少了Aβ的生成。
与对照组sAPPα含量具有明显昼夜差异不同的是:在模型组中,sAPPα含量不具有昼夜差异;而褪黑素组和生慧汤组能明显增加白天(12:00)sAPPα的含量,sAPPα的含量具有明显昼夜差异,提示生慧汤组改善学习记忆可能是通过调节sAPPα含量的昼夜节律紊乱来实现。
3.3 结论
结合以上实验结果,生慧汤改善5月龄APP/PS1阿尔茨海默病模型小鼠的学习记忆障碍,其机制可能与恢复海马内APP代谢产物sAPPα的昼夜节律性表达、从而减少Aβ的沉积有关。
参考文献2
1李晨阳.阿尔茨海默病的“中国处方”.科学新闻,2020,(5):60-61.
2 Panza F,Lozupone M,Logroscino G,et al.A critical appraisal of amyloid-β-targeting therapies for Alzheimer disease.Nature Reviews Neurology,2019,15(2):73-88.
3 Sun L,Zhou R,Yang G,et al.Analysis of 138 pathogenic mutations in presenilin-1 on the in vitro production of Abeta42 and Abeta40 peptides by gamma-secretase[J].Proc Natl Acad Sci U S A,2017,114(4):E476-E485.
4丁莉,呙霞,许湘,等.APP/PS1双转基因小鼠自主活动的节律性.中国老年学杂志,2017,37(14):3389-3390.
5丁莉,游秋云,王平.生慧汤对APP/PS1双转基因痴呆小鼠自主活动昼夜节律的影响及对下丘脑生物钟基因的调节.时珍国医国药,2017,28(2):301-304.
6丁莉.昼夜节律的中医理论探讨及生慧汤对APP/PS1痴呆小鼠昼夜节律的影响.武汉:湖北中医药大学博士毕业论文,2016:54-55.
7 He Y X,Li Y Y,Zhou F,et al.Decreased circadian fluctuation in cognitive behaviors and synaptic plasticity in APP/PS1transgenic mice.Metabolic Brain Disease,2020,35(2):343-352.
8 Sengoku R.Aging and Alzheimer's disease pathology.Neuropathology,2020,40(1):22-29.
9 Kress G J,Liao F,Dimitry J,et al.Regulation of amyloid-β dynamics and pathology by the circadian clock.Journal of Experimental Medicine,2018,215(4):1059-1068.
10 Li X P,Guan J W,Sun T,et al.Circadian learning and memory changes in Aβ1-42 induced Alzheimer's mice.Metabolic Brain Disease,2020,35(3):463-471.
11 Lucey B P,Hicks T J,McLeland J S,et al.Effect of sleep on overnight cerebrospinal fluid amyloid β kinetics.Annals of Neurology,2018,83(1):197-204.
12 Zhou R,Yang G H,Guo X F,et al.Recognition of the amyloid precursor protein by human γ-secretase.Science,2019,363(6428):eaaw0930.
13 Funamoto S,Tagami S,Okochi M,et al.Successive cleavage of β-amyloid precursor protein by γ-secretase.Seminars in Cell & Developmental Biology,2020,105:64-74.
14 Leong Y Q,Ng K Y,Chye S M,et al.Mechanisms of action of amyloidbeta and its precursor protein in neuronal cell death.Metabolic BrainDisease,2020,35(1):11-30.
15 Takahashi R H,Nagao T,Gouras G K.Plaque formation and the intraneuronal accumulation of β-amyloid in Alzheimer's disease.Pathology International,2017,67(4):185-193.
16张美娅,王平,游秋云,等.生慧汤对APP/PS1双转基因痴呆模型小鼠下丘脑区生物钟基因Bmal1及海马IL-6,TNF-α的影响.中国实验方剂学杂志,2019,25(20):7-12.
17谭爱华,龙清华,王平,等.生慧汤对慢性睡眠剥夺模型小鼠的神经保护作用及其机制.中国中西医结合杂志,2022,42(1):56-60.
18 Habib A,Sawmiller D,Tan J.Restoring soluble amyloid precursor protein α functions as a potential treatment for Alzheimer's disease.Journal of Neuroscience Research,2017,95(4):973-991.
19 Bandyopadhyay S,Hartley D M,Cahill C M,et al.Interleukin-1alpha stimulates non-amyloidogenic pathway by alpha-secretase(ADAM-10 and ADAM-17)cleavage of APP in human astrocytic cells involving p38 MAP kinase.Journal of Neuroscience Research,2006,84(1):106-118.
20 Sharma A,Mohammad A,Saini A K,et al.Neuroprotective effects of fluoxetine on molecular markers of circadian rhythm,cognitive deficits,oxidative damage,and biomarkers of Alzheimer's disease-like pathology induced under chronic constant light regime in wistar rats.ACS Chemical Neuroscience,2021,12(12):2233-2246.
21 Corrigan F,Thornton E,Roisman L C,et al.The neuroprotective activity of the amyloid precursor protein against traumatic brain injury is mediated via the heparin binding site in residues 96-110.Journal of Neurochemistry,2014,128(1):196-204.
22 Dobrowolska J A,Kasten T,Huang Y F,et al.Diurnal patterns of soluble amyloid precursor protein metabolites in the human central nervous system.PLoS One,2014,9(3):e89998.
23 Yun S M,Cho S J,Jo C,et al.Elevation of plasma soluble amyloid precursor protein beta in Alzheimer's disease.J.Arch Gerontol Geriatr,2020,87:103995.
24 Kirk R A,Kesner R P,Wang L M,et al.Lipopolysaccharide exposure in a rat sepsis model results in hippocampal amyloid--beta plaque and phosphorylated tau deposition and corresponding behavioral deficits.Geroscience,2019,41(4):467-481.

