全缝线锚钉治疗肩关节运动损伤研究进展
余承瑄 冯思嘉 王鹏 张健 李云霞 华英汇 陈世益 陈俊
复旦大学附属华山医院运动医学科,复旦大学运动医学研究所(上海 200040)
带线锚钉(suture anchor)是骨关节外科手术中的重要工具之一,其主要功能为将软组织如韧带或肌腱等固定于骨组织,形成坚固稳定的骨固定点。为了恢复受损部位的功能,锚钉必须提供足够的力学稳定性,同时减少对受损组织自身愈合的影响。Goble 和Somers于1985年获得第一个带线锚钉的专利[1],随着关节镜手术技术和材料学的快速发展,锚钉的材料也逐渐多样化(见表1)。最初带线锚钉以金属为主要材料,后因其造成软骨损伤、骨排除量过大和影像学伪影等原因,L/DL聚乳酸(poly-L/DL-lactide,PLDLA)等生物可吸收材料(biodegradable material)被用于构建生物可吸收锚钉(bioabsorbable anchor)[2]。不过,不少研究[1]发现部分生物可吸收锚钉因材料自体降解化进程过快,往往会引发锚钉周围无菌性炎症及囊肿,而且锚钉的失效载荷将随锚钉的吸收而逐渐降低。因此,可吸收锚钉存在由于不均匀降解而引起力学性能不稳定的风险。不可吸收高分子材料锚钉综合了金属锚钉与生物可吸收锚钉的优点,如聚醚醚酮(polyetheretherke⁃tone,PEEK)为一种不可降解高分子材料,因兼具不可降解和机械力学性能强度好的优势,成为目前临床应用的主流解决方案。
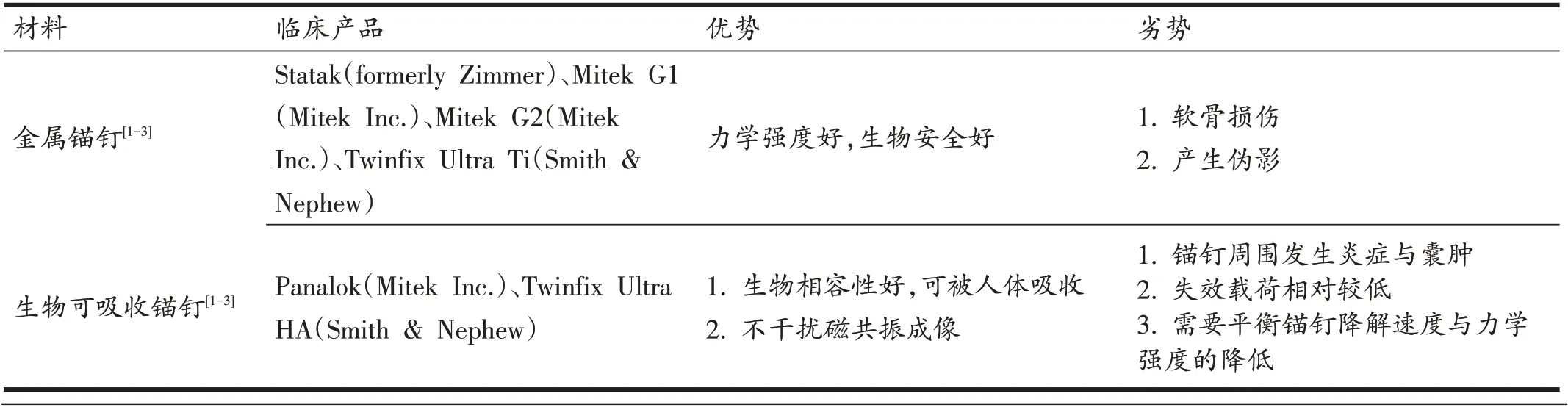
表1 全缝线锚钉与传统锚钉主要优势与劣势比较
近些年来,为改善传统锚钉骨排除量过大的问题,一种新型锚钉即全缝线锚钉(all-suture anchor,ASA)应运而生。全缝线锚钉具有尺寸较小、质地柔软、无结设计的优势,不会广泛破坏骨关节面,也避免误损周围组织,成为目前国内外各个运动医学医疗器械厂家和科研院所的研发重点。因此,本文总结全缝线锚钉的设计、基本性能以及在肩关节运动损伤治疗中的临床应用情况,总结其临床应用中的独特优势及局限性。

(续表1)
1 全缝线锚钉的设计
全缝线锚钉是一种新兴的带线锚钉,与传统带线锚钉相似,全缝线锚钉的结构设计可分为三个部分(如图1A 所示):锚钉体、孔眼(eyelet)、缝线[2]。除外锚钉体由编织物构成,其他结构与带线锚钉大体类似。根据不同的设计思路,锚钉的结构设计也有些许差别,但主要采用的设计思路为“M形”折叠(M shaped)与圆形的“结形”设计(knot shaped)[4]。使用时锚钉被植入一个狭窄的、预钻的骨隧道中,然后手术医生拉紧缝线,使锚钉套的结构改变形成锚钉体,当其直径大于骨隧道直径时,锚钉则无法从骨隧道中拉出,而尾部剩余的缝线可以根据手术具体情况进行裁剪或者继续保留。
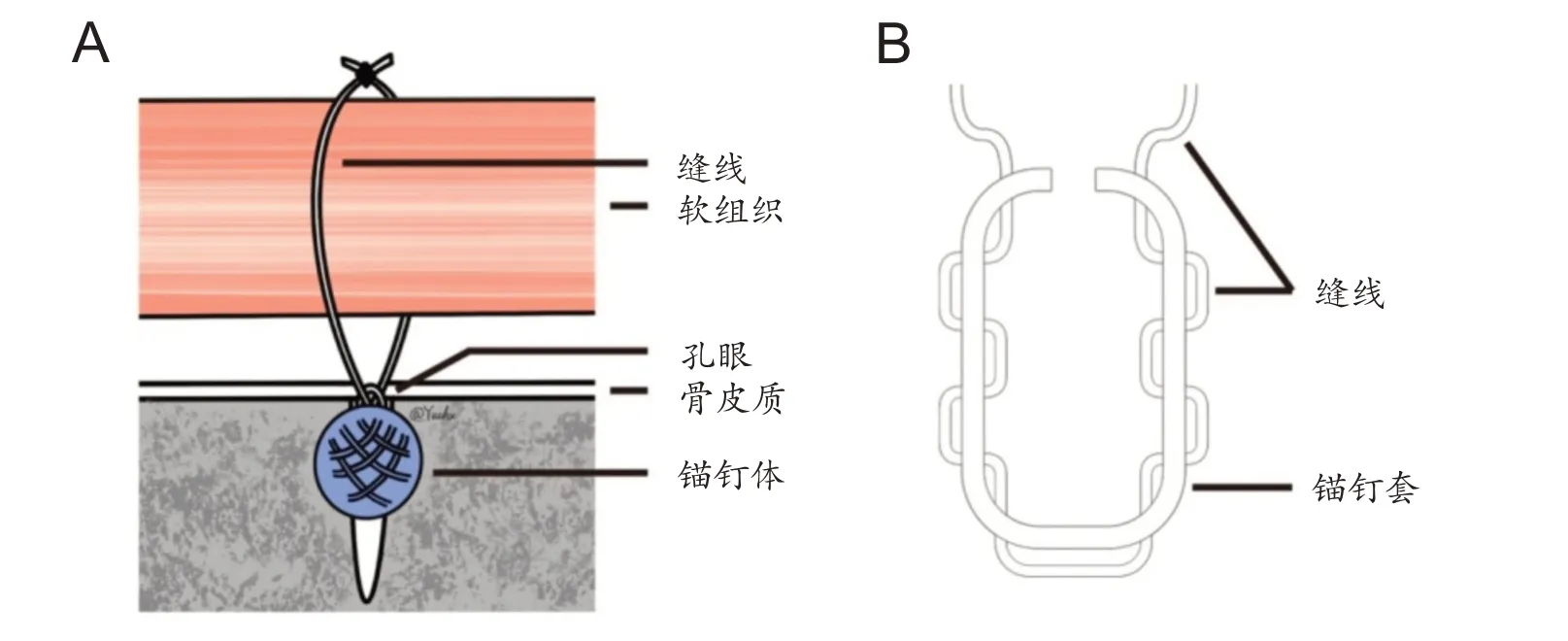
图1 全缝线锚钉的常见结构
如图1B,全缝线锚钉的锚钉体由锚钉套和穿过锚钉套的缝线组成[5],缝线和锚钉套的材料一般由高分子量材料编织制成,如聚酯纤维(polyester)、超高分子量聚 乙 烯(ultra- high molecular weight polyethylene,UHMWPE)等。全缝线锚钉的失效载荷与锚钉体部分设计密切相关。Barber 等发现全缝线锚钉的失效载荷与其缝线的数量密切相关,加载3 根缝线的全缝线锚钉的失效载荷可达564 N,而2根缝线与1根缝线构成的全缝线锚钉的失效载荷分别为465 N和256 N[3]。然而,更多的缝线数量也会需要预留更粗的骨隧道,意味着更多的骨排除量,因此还需根据手术部位、手术方式和患者的实际病情需求,选用合适数量缝线的全缝线锚钉。
目前设计高分子材料制成的全缝线锚钉的基本思路为使骨隧道中的锚钉在骨皮质下方“M型”折叠或圆形成结,锚钉体直径变宽且大于骨隧道直径,由此部署于骨皮质下方。但锚钉的最佳设计方案尚未统一,锚钉体积、缝线数量、锚钉套与缝线的编织结构均因厂家款式而异。因此,对于全缝线锚钉的选用应基于锚钉的基本特性和临床应用的特定场景需求。目前,市场中常见的全缝线锚钉种类包括Iconix(Stryker)、Y-Knot(Conmed Inc.)、Juggerknot(Zimmer Biomet)、Q-Fix(Smith & Nephew)和Draw Tight(Parcus Medical)等(如图2所示)。
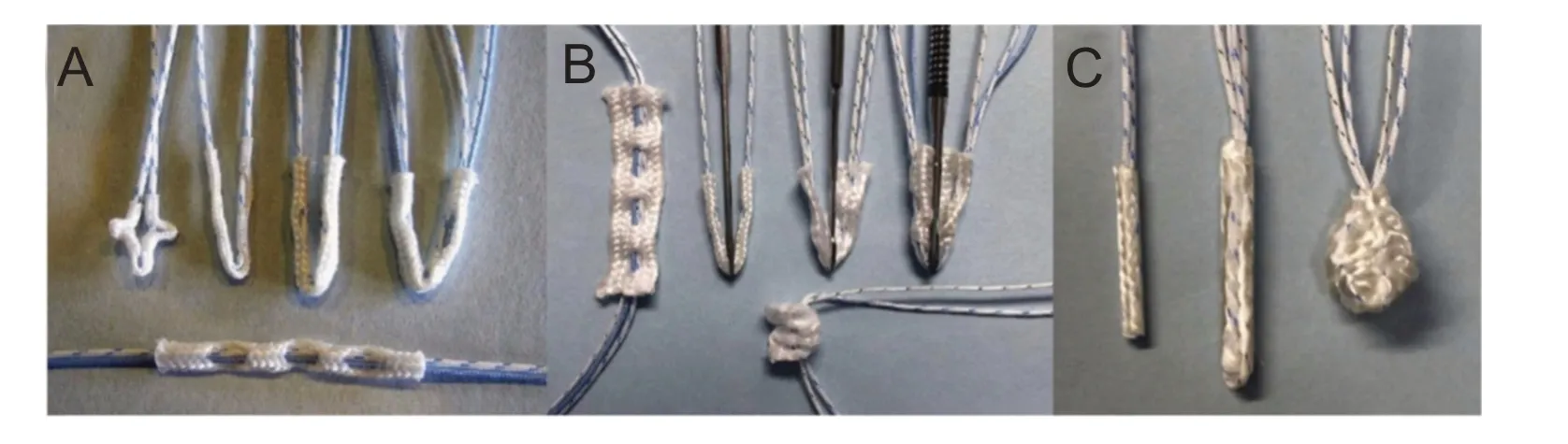
图2 常见的全缝线锚钉类型[3]
2 全缝线锚钉的设计与性能评价
许多团队已开展全缝线锚钉在肩关节镜手术中的临床研究(见表2),相关结果均显示患者术后肩关节功能评分显著提升。对比可吸收锚钉、金属锚钉等传统带线锚钉,全缝线锚钉的临床预后结果未出现明显差异。为进一步明确全缝线锚钉的性能,研究者们开展了一系列实验探究全缝线锚钉的生物力学性能与生物反应性。尽管带线锚钉种类繁多,但评价其设计主要遵循三个原则:①最大限度地提高最大承受力强度;②最大限度地减少急性医源性损伤;③最大限度地减少锚钉的生物反应及诱发关节炎的风险[1]。
2.1 全缝线锚钉的生物力学特性
多个研究团队评估了市场中常见的全缝线锚钉,例如Iconix、Y-knot(1.3、1.8、2.8)、Q-Fix(1.8、2.8)等,他们发现大部分的全缝线锚钉的失效载荷可以达到250 N[3,6]。在肩袖损伤修复术后的康复训练中,放置于大结节的锚钉将承受大约250 N 的拉力[3,7,8],且大于盂唇修复术后盂唇在康复时受到的力[9]。在肱二头肌近端肌腱固定术中,锚钉将承受大约110 N 的拉力[10]。在肱二头肌远端修复术中,术中承受的力至少为50 N,而在早期康复过程中则会达到167 N[11]。因此可认为,若全缝线锚钉的失效载荷大于250 N,则可以胜任大部分手术。
Bernardoni 等比较了全缝线锚钉和传统带线锚钉在修复肩袖时的生物力学特征,他们将14个未发生肩袖损伤的大体标本的冈上肌腱与足印区分离,并随机采用全缝线锚钉(Q-FIX,Smith & Nephew,Ando⁃ver,MA)或常规缝合锚钉(TWINFIX,Smith & Neph⁃ew,Andover,MA)进行解剖学修复,并在术后进行生物力学实验。通过对比失效载荷、运动后位移等参数,认为在肩袖损伤修复中,全缝线锚钉拥有与传统带线锚钉相似的生物力学特性[12]。另外,还有研究者也在其他病理损伤模型中发现全缝线锚钉与传统的锚钉具有相似的生物力学特性[13,14]。因此,可以认为全缝线锚钉是一可靠的临床锚钉新选择。
一旦全缝线锚钉于术后因意外失效拔出,临床仍有相应的补救治疗方案。Ntalos等在10例大体标本中进行实验,他们模拟了全缝线锚钉失效脱出,并在相应的缺损处重新使用传统带线锚钉进行翻修[15],通过检测失效载荷、位移等生物力学参数,未发现与修复前产生差异。因此,传统带线锚钉可以作为全缝线锚钉拔出失效后的处理方案,全缝线锚钉具有较好的临床应用安全性。
2.2 全缝线锚钉的易用性
在临床使用过程中,不仅需要考虑锚钉固定后的初始强度,注意手术中造成的医源性组织损伤,还要注意术后的并发症。全缝线锚钉被证明能通过其易用性与低骨排除量降低医源性损伤。在全缝线锚钉的植入过程中,借助适配的大角度置入器,拓展锚钉的可安置区域,便于施术者在术中准确安置锚钉,避免植入失误造成的损伤[4]。同时,区别于传统锚钉的螺纹锚钉结构,全缝线锚钉因其精简的体积,能够减小骨隧道直径,降低骨排除量,从而减少潜在的医源性损伤[16]。
2.3 全缝线锚钉的生物安全性
全缝线锚钉与传统锚钉一样具有良好的生物安全性,术后并发症发生率都较低。在2017 年,Thiébat 等通过测定骨髓间充质干细胞(bone marrow stromal cells,BMSCs)和外周血白细胞(peripheral blood leu⁃cocytes,PBLs)培养物的细胞存活率,分别评估了全缝线锚钉的细胞相容性和免疫原性,且通过检测碱性磷酸酶活性、钙化基质沉积及白介素-2的含量,评估了全缝线锚钉对BMSCs 分化成骨的影响和引起PBLs 炎症反应的强度[17]。他们发现全缝线锚钉不会显著影响细胞成骨的分化趋势,且不会显著促进炎症反应。此外,Kim等通过临床随访,73例术后随访发现相比于PEEK材质的锚钉,全缝线锚钉显示出更少的术后并发症,如锚钉周围积液的形成等[18]。为了评估全缝线锚钉术后诱发关节炎的风险,Uluyardimci 等分析了分别使用金属缝线锚钉和全缝线锚钉的67 名接受关节镜下Bankart 修复术的患者的临床预后[19]。结果显示,两组都没有发生骨关节炎。Jin 等对162 例Bankart 修复术患者进行回顾性分析,同样发现传统锚钉与全缝线锚钉两者疗效相似,锚钉周围发生囊肿的风险都较低[20],进一步证明了术后全缝线锚钉良好的生物安全性。
综上,由于科学合理的设计理念,全缝线锚钉具有良好的生物力学强度、较低医源性损伤与术后并发症的风险,是一种能有效缝合软组织如肌腱的植入物,在运动医学领域具有巨大的临床应用价值。
3 全缝线锚钉在肩关节的临床应用及其局限性
3.1 全缝线锚钉在常见肩关节运动损伤治疗中的应用
全缝线锚钉问世后,早期的相关研究均围绕锚钉在治疗肩关节运动损伤中的应用,例如盂唇损伤、肩袖损伤等。在肩关节损伤手术治疗中,全缝线锚钉一开始设计用于盂唇修复[21,22],后来被用于肩袖损伤修复(rotator cuff repair,RCR)[23,24]、肱二头肌长头腱损伤(long head of the biceps injury)[10]的修复以及多种类型的其他肌腱和韧带修复,因此全缝线锚钉在肩关节镜手术中具有广阔的临床应用前景。
肩袖(rotator cuff)是由冈上肌、冈下肌、肩胛下肌和小圆肌构成的一个袖套样结构,其在肩关节的正常生理活动中起重要的稳定和动力作用。肩袖损伤发生时,患者主要表现为肩关节疼痛和活动受限。当发生肩袖全层损伤后,可采用单排缝合、双排缝合进行手术治疗。目前一般采用传统带线锚钉进行单排缝合,而全缝线锚钉也正逐步应用于肩袖损伤的治疗。Ro等回顾性调查了88 例接受关节镜下全缝线锚钉单排修复肩袖损伤的患者,发现患者的骨密度(bone mineral density,BMD)越高,锚钉插入后距离骨皮质越远,即植入得更深,并且在后续随访中,并未发现锚钉沉降的情况[23]。Goschka 等通过36 个肩关节大体标本对比了全缝线锚钉在不同的双排缝合修复手术中的应用情况,发现全缝线锚钉的生物力学性能与传统实体锚钉相当,可以用于肩袖修复的双排缝合术[25]。
肩关节周围的软组织对肩关节的稳定性起到了重要的作用,而肩关节周围韧带发生断裂、盂唇损伤时,可能造成肩关节前向不稳(anterior shoulder instabili⁃ty)。盂肱下韧带复合体对于盂肱关节前方稳定性具有重要作用,当肱骨头发生前向脱位,最容易损伤的位置为该韧带位于前下盂唇侧的起点处,即Bankart 损伤。关节镜下Bankart 修复术已成为被广泛应用的治疗肩关节前向不稳的手术技术。Lacheta等在该术式中应用全缝线锚钉固定关节囊撕裂,发现该技术具有保留骨质多、固定牢固、节省手术时间等优点,能优化治疗效果,减少不稳复发的风险[26]。而Lubis 等更进一步尝试使用全缝线锚钉治疗镜下Bankart 修复术术后复发脱位[27]。依赖于全缝线锚钉体积小的优势,他们在旧锚钉之间分别插入全缝线锚钉,重塑肩关节稳定性,且1年后随访时发现患者可获得正常的关节活动度,未观察到并发症。另外,若术中需使用多个全缝线锚钉,应注意锚钉钉体之间的间距。Kramer等在一项关于肩关节不稳的研究中显示,对于直径为1.4 mm的全缝线锚钉,两锚钉之间至少间距2 mm才可以保持最大的强度[28]。此外,复发性肩关节前向不稳(recurrent anterior shoulder instability)可能伴有明显的关节盂骨缺损,若采用常规的关节镜下Bankart 修复术,则易造成复发[29]。因此,通常使用喙突截骨移植术,即Latarjet术治疗[30]。但Latarjet术的难度较高,学习曲线较长,存在金属螺钉突出和移植骨溶解[31,32]等并发症,且可能导致肩胛骨运动障碍等风险[29]。Jeong等应用全缝线锚钉探索治疗复发性肩关节前向不稳伴骨缺损的新术式。他们使用自体髂骨移植重建前关节盂缺损,并在术中使用全缝线锚钉代替传统螺钉固定,由此得以实现骨块的精确放置和固定,对复发性肩关节前向不稳伴有关节盂骨质严重缺失的情况进行骨性修复[33]。
肱二头肌长头腱损伤是引起肩部疼痛和功能障碍的一个常见原因。肱二头肌腱切断术和固定术均可以消除肩部疼痛的来源,前者有可能出现副作用,包括肌肉痉挛、疲劳、外观畸形和上举无力,常用于年龄较大、活动较少的患者,而后者则将肌腱固定在肱骨上,更适用于运动需求较高的年轻患者。研究显示,全缝线锚钉可用于肱二头肌肌腱固定术。Gifford等采用全缝线锚钉进行肱二头肌长头肌腱固定术,可有效和适当地固定肌腱,同时最大限度地减少潜在的并发症[34]。Shih等及其他研究团队同样采用全缝线锚钉将肱二头肌长头腱固定于肱骨,认为关节镜下肱二头肌肌腱固定术可靠、有效、易重复[35,36]。由此可见,全缝线锚钉在肱二头肌长头腱损伤的治疗中具有一定的发展前景。
3.2 全缝线锚钉的局限性
全缝线锚钉也存在一定的局限性,主要体现在以下三个方面:
(1)全缝线锚钉的固定及其生物力学强度取决于植入区域骨皮质的质量。Ntalos等在30例人类肱骨大体标本中研究锚钉失效后的骨形态学损伤,他们通过对 比 全 缝 线 锚 钉(Y- Knot RC®, ConMed, New York,NY)与PEEK 材质的传统带线锚钉(CrossFT™,ConMed,New York,NY)的相关参数,发现全缝线锚钉的失效载荷与其相邻的骨皮质厚度密切相关,且至少需要0.4 mm厚的皮质才能承受200 N拉力,而在传统带线锚钉中并不存在类似的相关性[15]。Ruder 等通过10 对肩部关节大体标本分别构建了保留皮质组和去骨皮质组,发现大结节骨皮质的缺少会使全缝线锚钉的失效载荷从386 N显著降低至314 N[37]。但他们也发现生物力学强度的降低,并不一定造成临床的失败。

表2全缝线锚钉治疗肩关节运动损伤的相关临床研究
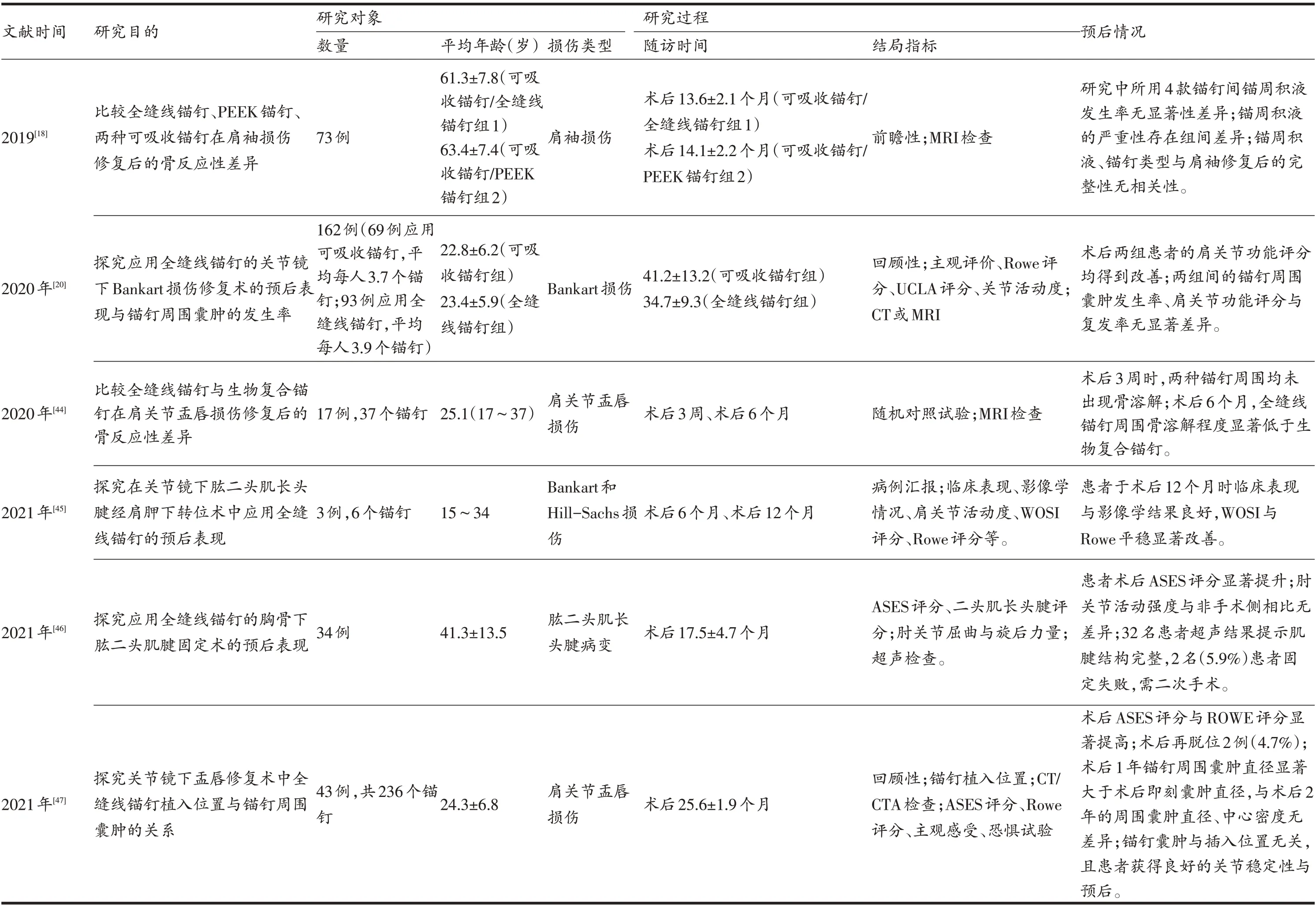
(续表2)

(续表2)
(2)全缝线锚钉的植入角度和深度会影响植入后的生物力学效果及临床预后。在Ntalos等的30例肱骨大体标本的研究中,他们还发现全缝线锚钉在拔出时形成的骨皮质缺损相比于传统锚钉更小,但若以45°角放置锚钉,则全缝线锚钉拔出形成的骨皮质缺损将最大[15]。而Oh 等通过对9 对人类尸体样本进行试验,发现与骨皮质垂直的方向插入锚钉,可获得更强的失效载荷,另外也可能产生更大的临床获益[38]。Ruder等通过8对肩关节大体标本,并针对3个不同的深度进行测试,发现当1.5 mm型号的全缝线锚钉在21 mm的预钻骨隧道中安置时,最佳的植入深度为17 mm,即在此处展开后,运动后位移显著降低,且失效载荷基本不变[39]。因此,全缝线锚钉的使用难度可能在于锚钉植入的空间准确性,这影响了锚钉在实际使用时的生物力学强度。
(3)全缝线锚钉存在骨隧道扩大的潜在风险。由于全缝线锚钉的轻微晃动或是其周围的炎症反应,锚钉植入后可能存在骨隧道扩大的风险。Pfeiffer等通过狗与人类尸体样本在组织学层面对全缝线锚钉进行生物力学研究[40],他们发现全缝线锚钉植入8 周后,其骨隧道周围出现囊肿样空洞,并且相比于传统锚钉,全缝线锚钉存在更大的位移。而在另一项研究中,Lee等纳入67名接受关节镜下Bankart修复术的患者,并比较术中使用全缝线锚钉和可降解带线锚钉在术后的临床结果和锚钉部位的放射学检查结果[21],发现在术后1年的计算机断层扫描分析中,全缝合锚钉的骨隧道直径增量明显大于生物可吸收锚钉,但这并不影响最终的临床疗效。并且在术后2 年,全缝线锚钉显示出与使用传统生物可吸收锚钉类似的临床效果和稳定性。
全缝线锚钉在肩关节运动损伤治疗中的使用逐渐成熟,而锚钉的局限性在于锚钉的固定及其生物力学强度取决于植入区域骨皮质的质量、锚钉的植入角度和深度会影响生物力学效果及临床预后、锚钉植入后可能存在骨隧道扩大的风险。这些缺点会造成锚钉失效、患者不良预后及增加施术者的手术难度。随着锚钉结构学、材料学的发展,全缝线锚钉的短板将得到改进,以拓宽其在运动损伤治疗中的应用前景。
4 总结与展望
全缝线锚钉作为一种新型的带线锚钉,其具有尺寸小、质地柔软、可无结设计、骨排除量少等特点,目前正逐步运用于运动损伤的关节镜微创手术治疗。全缝线锚钉的主流材质为超高分子量聚乙烯,失效载荷较高,且具有良好的生物相容性,有效降低了术后锚钉周围炎症反应及骨关节炎的发生率。全缝线锚钉的手术植入方式主要为拉动缝线收紧锚钉,使锚钉的直径大于骨隧道,从而固定于骨皮质下。操作方便、锚钉置入装置可弯曲等特点,进一步提升了其临床易用性,避免了临床医源性损伤的发生,也降低了医生的学习难度。因此,全缝线锚钉已应用于较多肩关节中运动损伤修复术,如肩袖损伤、盂唇损伤、肱二头肌长头腱损伤等,在运动医学领域具有广泛的临床应用前景。
值得注意是全缝线锚钉也存在一定的局限性:1)全缝线锚钉的固定及其生物力学强度取决于植入点骨皮质的质量;2)全缝线锚钉的植入角度和深度会影响生物力学效果及临床预后;3)全缝线锚钉植入后可能存在骨隧道扩大的风险。
目前全缝线锚钉与传统带线锚钉的差别主要在于结构性改进,即改进了锚钉的部署方式与结构设计。其锚钉体材料主要为超高分子量聚乙烯材质,虽然具有较好的耐磨性,但不可被人体吸收。因此,今后可探索全缝线锚钉的材料改进,通过改良锚钉体缝线材质,或在锚钉体中杂化添加相应物质,以解决当前暴露的临床缺陷。另外,全缝线锚钉的生物学特性与传统锚钉相比并未形成明显差异,因此亦可通过改进锚钉材料,提升全缝线锚钉的组织诱导活性,进一步拓展全缝线锚钉的临床应用范围。

