老年脑小血管病患者运动障碍危险因素及其与运动障碍的相关性
代 博,万亚存,王润润
(1.河南省人民医院医学影像科,3.神经内科,河南 郑州 450003;2.郑州澍青医学高等专科学校临床医学系,河南 郑州 450064)
脑小血管病(cerebral small-vessel disease, CSVD)指颅内小血管(包括小动脉、毛细血管及小静脉)病变所致颅内疾病,是老年人痴呆、运动障碍和脑卒中的主要原因,其发病率占全部脑血管疾病的83.8%,起病隐匿且进展缓慢,发展至晚期时临床结局较差[1];其临床表现异质性较大,难以通过病理检查确诊[2]。运动障碍是预后不佳CSVD患者常见症状,包括步态障碍、平衡障碍及跌倒发作等。基于MRI的影像学总负荷评分能全面评估CSVD对全脑的影响[3],有助于诊断及评估预后。实验室检查血清缺血修饰清蛋白(ischemia modified albumin, IMA)、脂蛋白磷脂酶A2(lipoprotein-associated phospholipase A2, Lp-PLA2)及脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)亦是临床评估CSVD的常用指标。本研究基于临床及影像学总负荷评分分析老年(年龄≥60岁)CSVD患者运动障碍的危险因素及其与运动障碍的相关性。
1 资料与方法
1.1 一般资料 回顾性分析2020年12月—2022年5月116例经河南省人民医院临床诊断CSVD的老年患者,男76例、女40例,年龄60~83岁、平均(71.3±6.7)岁;MRI表现包括单独46例脑白质病变、10例微出血、8例血管周围间隙扩大,52例可见上述及腔隙性脑梗死等2种及以上表现。纳入标准:①年龄≥60岁;②MRI显示符合影像学CSVD诊断标准[4],病因考虑为动脉粥样硬化。排除标准:①既往脑卒中病史和/或伴卒中后遗症;②合并多发性硬化、急性感染性多神经根炎等中枢神经系统脱髓鞘疾病、颅内感染及退行性神经变性;③无法配合完成运动功能评估及MR检查。检查前患者或家属签署知情同意书。
1.2 仪器与方法 采用Philips Ingenia 3.0T超导MR仪行头部扫描,行T1W、T2W、T2-液体衰减反转恢复(fluid-attenuated inversion recovery, FLAIR)序列扫描,以及弥散加权成像(diffusion weighted imaging, DWI)和磁敏感加权成像(susceptibility weighted imaging, SWI)。
由2名具有3年以上中枢神经影像学诊断经验的主治医师根据MRI表现得出CSVD影像学总负荷评分:①无症状腔隙性脑梗死部位≥1,计1分;②深部脑白质病变Fazekas评分≥2分或脑室旁脑白质病变(white matter lesion, WML)Fazekas评分3分,计1分;③大脑深部或幕下脑微出血(cerebral microbleed, CMB)≥1个,计1分;④基底核区扩大的血管周围间隙(enlarged perivascular space, EPVS)>10个,计1分[5]。见图1、2。意见存在分歧时,经讨论达成一致。

图1 患者男,66岁,CSVD,影像学总负荷评分为4分 A、B.头部轴位未标记(A)及标记(B)T2-FLAIR图示侧脑室旁脑白质高信号(图B中的黄色标记); C、D.头部轴位未标记(C)及标记(D)SWI示基底核区微出血灶(图D中的黄圈标记) 图2 患者女,64岁,CSVD,影像学总负荷评分为3分 A.头部T2 FLAIR图示左侧顶叶腔隙性梗死灶(箭); B.头部DWI示右侧大脑皮层(长箭)及右侧脑室旁白质(短箭)新发皮层下梗死
1.3 运动障碍评定 于入院次日采用Tinetti平衡与步态量表(performance oriented mobility assessment, POMA)评估患者移动及动态平衡能力。POMA包括步态测试(POMA-G,共12分)及平衡测试(POMA-B,共16分)共28分,总分>24分表示无运动障碍,19~24分提示有跌倒风险,<19分提示跌倒风险高。将POMA评分≤24分归为运动障碍组,>24分归为非运动障碍组。
1.4 临床及实验室指标 收集临床及实验室相关资料。以酶联免疫吸附法检测IMA、Lp-PLA2及BDNF,检测试剂盒购自广东中山生物工程有限公司。
1.5 统计学分析 采用SPSS 22.0统计分析软件。以±s表示计量资料,组间行t检验。采用χ2检验比较计数资料。针对单因素分析结果显示组间差异有统计学意义的参数,以二元logistic回归分析CSVD患者发生运动障碍的独立影响因素。以Spearman相关分析CSVD运动障碍患者POMA评分与影像学总负荷评分及实验室指标的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 单因素分析 116例中,14例POMA评分<19分,35例19~24分,67例>24分;运动障碍组49例,非运动障碍组67例。组间同型半胱氨酸(homocysteine, Hcy)、中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin, NGAL)、IMA、Lp-PLA2、BDNF、POMA评分及影像学总负荷评分差异均有统计学意义(P均<0.05),其余指标差异均无统计学意义(P均>0.05)。见表1。

表1 116例CSVD患者临床资料及影像学总负荷评分比较
2.2 二元logistic回归分析 血清Hcy、NGAL、IMA、Lp-PLA2、BDNF及影像总负荷评分均为CSVD患者发生运动障碍的独立危险因素(P均<0.05,表2)。
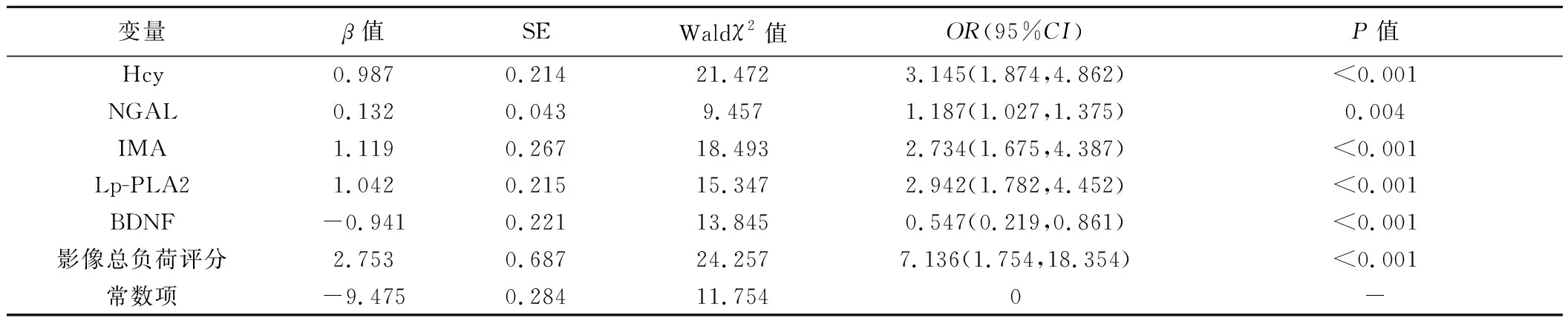
表2 CSVD患者运动障碍风险二元logistic回归分析结果
2.3 相关性分析 CSVD运动障碍患者POMA评分与血清Hcy、NGAL、IMA、Lp-PLA2水平及影像学总负荷评分均呈负相关(rs=-0.60、-0.48、-0.69、-0.65、-0.72,P均<0.05),与血清BDNF水平呈正相关(rs=0.63,P<0.05)。
3 讨论
CVSD发病率逐年增高,急性发作常表现为腔隙性脑梗死及脑实质出血;出现运动障碍可表现为肌张力障碍、行走困难、步态障碍及平衡障碍等[6],原因可能是脊髓运动系统与皮质、基底核纤维联系完整性被破坏及以执行功能下降为主的认知障碍,增大颅脑外伤、肢体骨折风险,加重患者心理负担[7]。
CSVD影像学总负荷评分是基于MRI表现的累积评分,可避免过度依赖CSVD单个MRI特征,更全面地反映CSVD对全脑的影响[8],故可作为影像学诊断CSVD的替代指标。既往研究[9]显示,年龄、深部脑白质病变程度及脑皮质萎缩等是CSVD步态障碍的独立危险因素。本研究运动障碍组CSVD影像学总负荷评分显著高于非运动障碍组,二元logistic回归分析显示影像学总负荷评分是CSVD患者发生运动障碍的独立危险因素,且与CSVD运动障碍患者POMA评分呈负相关,与苏岑等[10]的结果相符。
Hcy是人体必需氨基酸,也是细胞毒性因子,高Hcy水平是发生心血管疾病的独立危险因素,可通过氧化应激损伤内皮祖细胞功能等途径损伤内皮细胞,降低一氧化氮合成酶免疫活性,抑制内皮依赖性血管舒张反应,其对CSVD的影响显著超过脑大血管病变[11]。血浆Hcy与大脑深部或脑室周围WMH、脑白质疏松及基底核血管周围间隙扩大的高负担呈正相关,是认知障碍的独立危险因素,其水平有助于预测CSVD患者认知功能。本研究发现运动障碍CSVD患者Hcy水平显著高于非运动障碍者,提示Hcy是CSVD患者发生运动障碍的独立危险因素,且与CSVD运动障碍患者POMA评分呈负相关。
NGAL与炎症免疫反应、细胞凋亡、细胞分化等病理过程密切相关,参与多种疾病,如肥胖、慢性肾病、冠心病、急性脑梗死等的发生与发展,可调节基质金属蛋白酶9活性,进而调节炎症反应并促进动脉粥样硬化进展。在无症状颈动脉狭窄患者,血清NGAL可作为不稳定颈动脉斑块的重要生物标志物。血清NGAL升高的CSVD患者更易发生脑卒中,为CSVD患者影像总负荷评分升高的独立危险因素[12]。本研究运动障碍组NGAL显著高于非运动障碍组,提示NGAL是CSVD患者发生运动障碍的独立危险因素,并与CSVD运动障碍患者POMA评分呈负相关。
机体发生缺血/再灌注时,血清白蛋白通过缺血部位,其氨基酸序列被氧自由基破坏、降解修饰而生成IMA。CVSD患者脑血管病变可造成脑组织能量代谢障碍,使IMA升高;而IMA越高,影响机体运动功能的脑皮质及锥体束等组织损伤越严重[13]。Lp-PLA2可氧化水解氧化磷脂生成脂类促炎物质,导致血管内皮细胞死亡、刺激黏附因子和细胞因子生成,参与心血管病变[14];Lp-PLA2能加重CVSD损伤,增加运动障碍风险。BDNF是具有营养神经作用的蛋白质,脑血管疾病患者存在脑部能量供应障碍,导致BDNF过度消耗而使神经功能损伤并出现功能障碍[15]。本研究发现运动障碍组IMA和Lp-PLA2显著升高而BDNF显著降低,提示三者均为CSVD患者发生运动障碍的独立危险因素,并均与POMA评分相关。
综上,血清Hcy、NGAL、IMA、Lp-PLA2、BDNF及影像学总负荷评分均为CSVD患者发生运动障碍的独立危险因素,且与POMA评分相关。但本研究样本量有限,且为单中心研究,有待后续扩大样本量、开展多中心研究进一步观察。

