基于荧光PCR技术构建MGMT基因甲基化定性检测方法
康灿昆
(厦门飞朔生物技术有限公司,福建 厦门 361100)
神经胶质瘤是最常见的原发性恶性中枢神经系统肿瘤,年发病率为(5 ~ 8)/10万,5年病死率在全身肿瘤中仅次于胰腺癌和肺癌[1]。目前,胶质瘤的治疗方案主要是手术联合放化疗等综合治疗;其中,最具代表性的化疗药物是替莫唑胺[2]。替莫唑胺能在人体内迅速转化为活性产物MTIC,使肿瘤细胞DNA烷基化,从而引起细胞毒性损伤[3]。
MGMT基因编码的O6-甲基鸟嘌呤DNA甲基转移酶是一种DNA修复酶,可以将O6-甲基鸟嘌呤的甲基转移至自身的半胱氨酸残基上,修复细胞毒性损伤,从而提高肿瘤细胞对烷化剂的抗性[4]。因此,MGMT基因甲基化的胶质母细胞瘤患者能够受益于替莫唑胺治疗[4];同时,MGMT基因甲基化状态也是一个独立的预后指标,MGMT基因甲基化的神经胶质瘤患者治疗的近期客观疗效和无进展生存期明显优于未甲基化的患者[5]。
该研究以MGMT基因为靶标,利用高通量测序技术的优点,明确样本的亚硫酸氢盐转化效率和目标片段上每个CpG位点的甲基化水平,基于此构建MGMT基因甲基化荧光PCR定性检测方法,为MGMT基因甲基化研究提供一种新的研究思路。
1 资料与方法
1.1 样本来源
用于试验研究的41例神经胶质瘤样本由厦门飞朔生物医学检验实验室捐赠。
1.2 试剂和仪器
试验所用试剂和仪器如下:QIAamp DNA FFPE Tissue Kit(德国Qiagen)、EpiTect Fast DNA Bisulfite Kit(德国Qiagen)、基因测序用文库试剂盒(厦门飞朔)、MiSeq Reagent Kit v2(300-cycles)(Illumina)、全自动医用PCR分析仪SLAN-96S(上海宏石)以及基因测序仪MiSeq(Illumina)。
1.3 DNA提取
使用QIAamp DNA FFPE Tissue Kit从神经胶质瘤石蜡包埋组织样本中提取基因组DNA,通过微量分光光度计测定样本的浓度和纯度,要求样本浓度大于25 ng/μL,OD260/OD280值应为1.7~2.2。
1.4 亚硫酸氢盐修饰
根据EpiTect Fast DNA Bisulfite Kit说明书的要求对样本进行亚硫酸氢盐修饰转化,样本投入量为500 ng~1 000 ng,洗脱体积为20 μL。
1.5 文库构建
MGMT基因存在1个CpG岛(hg19:chr10:131264949~131265710),包括75个CpG位点。以Malley D S等人[6]定义的甲基化关键区域DMR2为靶向区间,设计扩增引物(表1)。直接取5 μL修饰后的产物,按照基因测序用文库试剂盒说明书步骤构建测序文库。

表1 MGMT扩增引物
1.6 高通量测序
使用毛细管电泳仪进行文库片段质控,文库主要片段大约分布在350 bp;使用Qubit 4.0进行文库浓度质控,浓度应不低于1 ng/µL。将文库稀释至4 nM后等比例混合变性,使用MiSeq Reagent Kit v2(300-cycles)上机检测。
1.7 测序结果分析
将靶向区间内所有C碱基替换成T碱基,以此构成一个模拟基因组。使用Flash软件(v1.2.11)对双端测序结果进行合并得到新的FASTQ文件,并通过BWA软件(v0.7.17)和Samtools软件(v1.9)进行比对、建立索引,得到BAM文件。
统计靶向区间内所有非CpG位点的C碱基转换成T碱基的频率,取平均值得到样本的亚硫酸氢盐转化效率P。再分别统计靶向区间内CpG位点的C碱基转换成T碱基的频率PN,P-PN即为CpG位点甲基化水平。
1.8 荧光PCR检测
根据高通量测序结果挑选特异性CpG位点设计引物探针,研发基于荧光PCR技术的人类MGMT基因甲基化检测试剂盒。用无核酸酶水将修饰后的样本稀释至5 ng/µL,取5 µL的稀释后样本、对照品进行扩增检测。
1.9 统计学分析
使用Heml软件(v1.0)对CpG位点的甲基化水平(百分比数据)进行聚类分析。聚类相似度计算方法选择Average Linkage和Euclidean Distance。
用SPSS软件(v21.0)进行统计学分析,将不同的ΔCt值作为分界点,以灵敏度为纵坐标、1-特异性为横坐标,绘制ROC曲线。
2 结果
2.1 高通量测序结果
以MGMT基因甲基化关键区域DMR2为靶标设计了1对扩增引物,覆盖MGMT基因第41号~75号CpG位点,其扩增产物大小为258 bp。当测序文库使用MiSeq Reagent Kit v2(300-cycles)上机检测时,无法对258 bp的测序片段进行双向测通。因此,当分析测序结果时,需要用双端测序结果进行数据拼接,以得到片段的完整序列信息。
利用高通量测序平台的技术优势排除CpG位点甲基化的干扰,计算靶向区间内所有非CpG位点的C碱基转换成T碱基的频率,取平均值得到41例样本的亚硫酸氢盐转化效率(图1)。所有样本的转化效率均大于99%,平均转化效率达到99.65%,排除修饰不完全干扰的可能性。
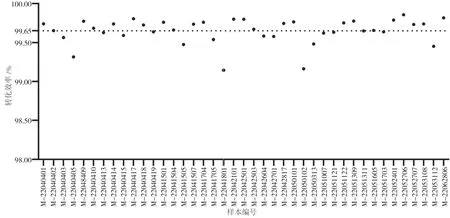
图1 亚硫酸氢盐转化效率汇总
分析高通量测序结果,统计41例样本中每个CpG位点的甲基化水平,使用Heml软件(v1.0)进行双向聚类分析(图2)。将41例样本分成3组,组1中所有CpG位点的平均甲基化水平小于1.5%,普遍缺乏甲基化。组3中所有CpG位点的平均甲基化水平大于5%,存在大量甲基化水平大于10%的CpG位点,显示高水平的甲基化。组2处于中间区域,其大部分CpG位点的甲基化水平小于5%。27个CpG位点可以聚类成4组,其中组2(图2中用虚线标示)包括第58号~64号、第66号共8个连续的CpG位点,其甲基化程度高于其他分组,各CpG位点的甲基化水平均一性好、关联性强。因此,选择第58号~64号、第66号CpG位点设计引物探针,研发基于荧光PCR技术的甲基化检测试剂盒。
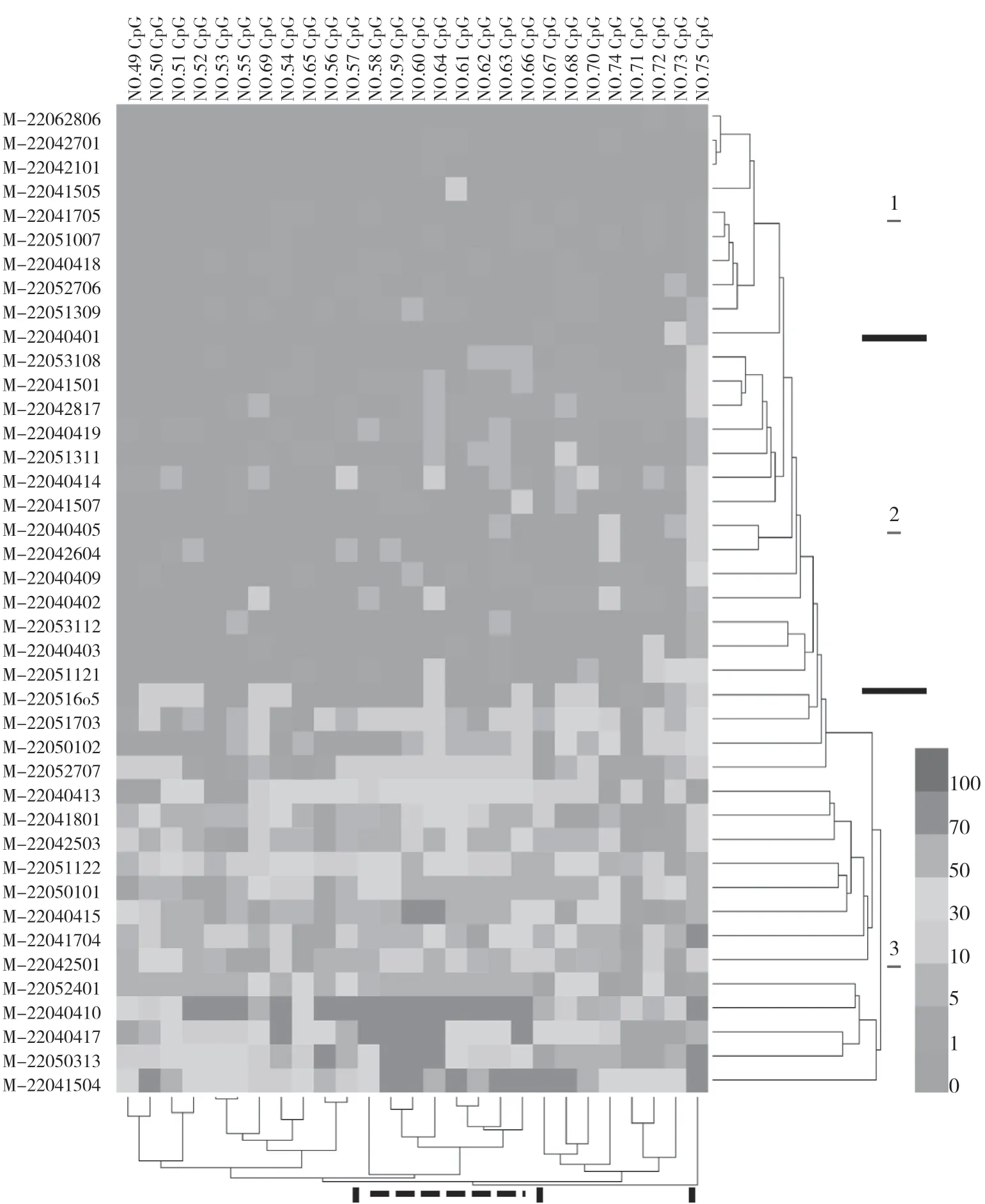
图2 MGMT基因第41号~75号CpG位点的甲基化水平聚类分析热图
2.2 荧光PCR检测结果
使用荧光PCR检测试剂盒对41例样本进行检测,汇总2个通道的Ct值结果,当FAM通道无扩增曲线时,以最大循环数30计算,并用FAM通道的Ct值减去HEX通道的Ct值,得到ΔCt值。取第58号~64号、第66号CpG位点的甲基化水平平均值作为样本的平均甲基化水平。以ΔCt值为纵轴、平均甲基化水平(百分比数据)为横轴绘制散点图(图3)。以平均甲基化水平5%为阈值线,ΔCt值为判读指标,利用ROC曲线法确定该试剂盒的ΔCtCut-off值为8,当样本FAM通道无扩增曲线或ΔCt值≥8时,判读为甲基化阴性或低于试剂盒检测下限;当ΔCt值<8时,判读为甲基化阳性。

图3 MGMT基因甲基化荧光PCR检测结果分析
3 讨论
MGMT蛋白的O6-甲基鸟嘌呤DNA甲基转移酶活性是神经胶质瘤细胞对烷化剂产生抗性的直接因素,与MGMT基因mRNA或者MGMT蛋白的表达水平相比,甲基化状态更能反映患者使用化疗药物辅助治疗的受益情况[7]。因此,当无法直接确定肿瘤样本中MGMT蛋白的活性时,首选以MGMT基因甲基化状态作为间接评价指标。
当前,甲基化特异性PCR技术(MSP)和焦磷酸测序技术是神经胶质瘤MGMT基因甲基化状态评估的常用方法。甲基化特异性PCR技术使用特异性引物进行PCR扩增,以电泳条带的有无进行判读。在特异性引物的设计过程中,CpG位点的选择至关重要,关系着样本的检测结果。以Esteller和Felsberg等人发表的引物组合对80例神经胶质瘤样本进行检测时发现,结果一致性仅为72.5%(58/80)[8]。焦磷酸测序是一种新型酶联级化学发光测序技术,可以同时分析多个CpG位点的甲基化水平,再以甲基化平均水平进行判读。在临床研究中,常以总生存期或无进展生存期为指标划定阈值线,不同方案划定的阈值各不相同。
为了克服以上2种技术的弊端,该研究采用高通量测序技术分析41例神经胶质瘤样本的亚硫酸氢盐转化效率以及MGMT基因第41号~75号CpG位点的甲基化水平。试验结果显示,样本的基因组DNA平均转化效率达到99.65%。对CpG位点的甲基化水平进行双向聚类分析,筛选第58号~64号、第66号CpG位点区域用于研发基于荧光PCR技术的甲基化检测试剂盒。
荧光PCR检测试剂盒以ΔCt值为判读指标,ΔCtCut-off值为8。以平均甲基化水平5%为阈值线,采用高通量测序和荧光PCR技术分别对41例样本的甲基化水平进行检测,对比结果后发现,有40例样本的检测结果完全一致。
4 结语
该研究基于高通量测序技术对目标片段上每个CpG位点的甲基化水平进行聚类分析,成功构建了MGMT基因甲基化荧光PCR定性检测方法,其与高通量测序方法检测结果有较高的一致性,而且具有操作简便、成本低以及效率高的优势,适用于临床MGMT基因甲基化状态常规化检测,可以为个体化治疗提供指导。

