基于食管鳞癌奥沙利铂耐药细胞测序差异表达分析
董慧玲,刘祥辰,孔鹏洲,徐恩伟,宋彬
1.山西医科大学第一医院,山西 太原 030001;2.中山大学附属第五医院,广东 珠海 519000;3.山西医科大学医学转化中心,山西 太原 030001;4.山西省肿瘤医院,山西太原030001;5.山西医科大学白求恩医院,山西 太原 030001
我国是食管癌高发国家,其中食管鳞癌(esophageal squamous cancer,ESCC)是食管癌的主要病理学类型,占90%以上[1]。随着医学技术的进步,ESCC治疗取得很大的进展,但晚期ESCC 的5年生存率仍很低[2-3]。化疗是晚期ESCC 的主要治疗手段[4-5],食管癌诊疗指南(2020版)将铂类联合氟尿嘧啶类或紫杉醇类作为ESCC 的一线化疗方案。治疗食管癌常用铂类化疗药主要有顺铂(cisplatin,DDP)、奥沙利铂(oxaliplatin,OXA、L-OHP)、卡铂(carboplatin,CBP)等,随着铂类药物在临床上的广泛应用,越来越多的食管癌患者表现出对铂类药物的耐药[6]。
本研究建立了ESCC L-OHP耐药细胞株,通过全转录组测序技术筛选差异表达基因和富集的可能信号通路,旨在探索食管癌L-OHP耐药性的可能机制,为临床ESCC的治疗提供参考。
1 材料与方法
1.1 细胞 人食管鳞癌细胞系KYSE150细胞购自中国科学院上海生命科学研究院细胞资源中心。
1.2 主要试剂及仪器L-OHP 为齐鲁制药有限公司生产;基础培养基RPMI1640购自美国Hyclone公司;胎牛血清(FBS)购自以色列BI公司;CCK-8试剂盒购自北京索莱宝科技有限公司;RNA提取试剂、逆转录及qRCR 试剂SYBRGreenl 购自宝生生物科技有限公司;Matrigel 胶购自美国BD Biscience 公司;Transwell小室为美国Corning公司产品。
1.3 细胞培养 将-80 ℃冻存的细胞取出,置于37 ℃温水中迅速解冻,225×g离心3 min,弃上清,用含10%FBS的RPMI1640完全培养基重悬细胞,均匀铺于小皿中,置37 ℃,5%CO2恒温培养箱中培养。
1.4 耐药细胞培养及形态学变化 L-OHP 分子量为397.29 g/mol,浓度范围0 ~200 μmol/L。用12.58 mL三蒸水溶解50 mg L-OHP,配制成浓度为10 mmol/L的母液,分装,100 μL/管,-80 ℃密封储存。分别将母液稀释成2、4、8、16、32、64、128、200 μmol/L的稀释液,CCK-8 法测定半数抑制浓度(50% inhibiting concentration,IC50)。用16 μmol/L 的L-OHP 冲击KYSE150 细胞24 h,去除含药培养基,PBS 洗去死细胞后换成新鲜完全培养基,细胞恢复正常生长速度,再用药物浓度递增方式诱导,直至细胞在16 μmol/L的L-OHP浓度下稳定传代即建成KYSE150/L-OHP细胞。每隔一段时间测定KYSE150和KYSE150/L-OHP组细胞的IC50值,并按下式计算耐药指数(resistance index,RI)。光学显微镜下观察KYSE150和KYSE150/L-OHP组细胞形态。
RI=L-OHP组耐药细胞IC50/亲本细胞IC50
1.5 细胞抑制率测定 将KYSE150 及KYSE150/LOHP 细胞用胰酶消化为单个细胞,225 ×g离心后,用培养基重悬细胞沉淀,并计数。将各组细胞以4 000个/孔接种于96孔板中,每组设5个复孔,培养24 h;试验组分别加入含不同浓度L-OHP 的完全培养基,对照组不加L-OHP,培养48 h;每孔加入10%CCK-8 试剂,作用2 h,酶标仪检测450 nm 波长处各孔吸光度值,并按下式计算药物对细胞的抑制率。
抑制率(%)=(对照组A450-试验组A450)/(对照组A450-空白组A450)×100%
1.6 细胞侵袭/迁移能力的检测
1.6.1 侵袭试验 采用Transwell小室试验。提前24 h将BD Matrigel 胶置4 ℃融化,与基础培养基按1∶7稀释,每个小室中加入100 μL,置于37 ℃,5%CO2恒温培养箱中培养;取各组细胞沉淀,用基础培养基重悬并计数,在24 孔板的下室加入600 μL 含10%FBS的完全培养基,上室加入200 μL 细胞悬液(8 × 104个细胞),置于恒温培养箱中培养24 h;用棉签将小室里面底部的细胞擦净,放入4%多聚甲醛中固定20 min,三蒸水洗涤1 次,用结晶紫染色30 min,显微镜下观察,随机选取4 ~6个视野拍照计数。
1.6.2 迁移试验 除小室不铺基质胶,其余步骤同1.6.1项。
1.7 转录组测序及差异表达基因筛选 RNA 提取、文库构建、质控由中国北京诺禾致源科技有限公司(简称诺禾致源)完成。文库检测合格,将各组文库按照有效浓度及目标数据汇集后进行Illumina 测序[7]。本研究采用诺禾致源illumina HiSeqTM2500/MiSeq 等测序平台对KYSE150 和KYSE150/L-OHP细胞进行测序[8]。利用edgeR 分析软件对miRNA、LncRNA、circRNA、mRNA表达谱数据均一化后,进行组间差异基因表达分析。用差异倍数(fold change)≥2倍,P值或矫正后的P值判断显著性水平,校正后的P值越小代表越显著。将P<0.05 作为差异显著性标准(若P<0.05 筛选差异过少,则使用q<0.05 进行差异筛选,筛选条件见火山图)。为探究差异表达基因的功能,通过KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库来寻找这些差异基因主要参与的信号通路。使用KOBAS(2.0)进行pathway 富集[9],FDR ≤0.05 的pathway 定义为在差异表达基因中显著富集的pathway。
1.8 差异表达基因的RT-PCR 验证 为验证所筛选的差异表达基因的准确性,从中选取5 个差异倍数相对较大的基因进行RT-PCR 验证。提取细胞总RNA,使用Prime Script TMRT Master Mix(Perfect Real Time)试剂盒(北京聚合美生物科技有限公司产品)将RNA 反转录为cDNA,体系为20 μL。利用在线引物设计工具Oligo设计qRCR特异性扩增引物,GAPDH正义链:5′-CCAGAACATCATCCCTGCCT-3′,反义链:5′-CCTGCTTCACCACCTTCTTG-3′;ACTG1正义链:5′-CATTGTCATGGACTCTGGAGAC-3′,反义链:5′-GAGGATCTTCATGAGGTAGTCG-3′;CKM正义链:5′-AGAGTCCTGCTCCCTCACTC-3′,反义链:5′-AGGATGGAGCCCATTGGTTG-3′;CCL3正义链:5′-TGCCCTTGCTGTCCTCCTCTG-3′,反义链:5′-GGCTGCTCGTCTCAAAGTAGTCAG-3′;HNRNPH1正义链:5′-CAGTTCAGCGACCACGTTTG-3′,反义链:5′-CACCACGAATCCCTCTCCAC-3′;STAT1正义链:5′-TCTGTGTCTGAAGTTCACCCT-3′,反义链:5′-ACAGAGCCCACTATCCGAGA-3′。引物由生工生物工程(上海)股份有限公司合成。以对照组管家基因GAPDH为内参照,采用△△Ct法计算目的基因相对表达量。
1.9 统计学分析 使用SPSS 20.0 软件进行统计分析。采用T检验和单向方差分析比较正态分布的测量数据,秩和检验比较非正态分布的测量数据。以P <0.05为差异有统计学意义。
2 结果
2.1 KYSE150 和KYSE150/L-OHP 细胞的IC50及耐药性 KYSE150/L-OHP 细胞的IC50[(74.6 ±4.43)μmol/L]明显高于KYSE150 细胞[(18.65 ±3.35)μmol/L](t= 22.9,P<0.01)。KYSE150/LOHP对L-OHP的耐药指数为(4.0±1.35)。见图1。
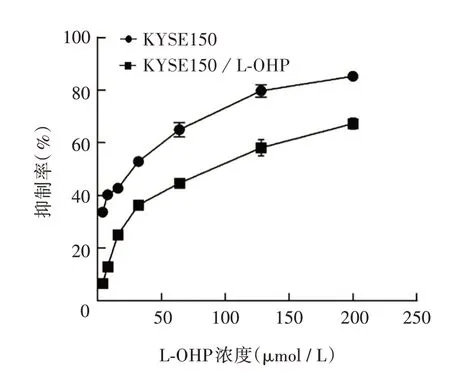
图1 L-OHP 对KYSE150 和KYSE150/L-OHP 细胞的抑制率Fig.1 Inhibition rate of L-OHP on KYSE150 and KYSE-150/L-OHP cells
2.2 KYSE150/L-OHP 细胞的形态学变化 显微镜下观察显示,KYSE150 细胞形态清晰,呈梭形;与亲代细胞相比,KYSE150/L-OHP 细胞大小不一,体积增大,形态不规则,个别细胞出现崩解、细胞核碎裂、固缩。见图2。

图2 KYSE150(A)和KYSE150/L-OHP(B)细胞形态的显微镜观察(×200)Fig.2 Microscopy of cell morphology of KYSE150(A)and KYSE150/L-OHP(B)(×200)
2.3 KYSE150/L-OHP细胞侵袭/迁移能力的变化 与亲本KYSE150细胞相比,耐药细胞KYSE150/L-OHP的侵袭和迁移能力均显著增强(t分别为25.49 和46.05,P均<0.000 1),见图3和表1。
表1 KYSE150 和KYSE150/L-OHP 细胞侵袭/迁移能力的差异(±s,n=3)Tab.1 Difference of cell invasion or migration ability of KYSE-150 and KYSE150/L-OHP(±s,n=3)

表1 KYSE150 和KYSE150/L-OHP 细胞侵袭/迁移能力的差异(±s,n=3)Tab.1 Difference of cell invasion or migration ability of KYSE-150 and KYSE150/L-OHP(±s,n=3)
细胞KYSE150 KYSE1150/L-OHP侵袭细胞数61.67±2.73 164.3±2.96迁移细胞数102.7±1.45 263.7±3.18

图3 KYSE150 和KYSE150/L-OHP 细胞侵袭/迁移能力的比较(结晶紫染色,×200)Fig.3 Comparison of cell invasion or migration ability of KYSE150 and KYSE150/L-OHP(crystal violet staining,×200)
2.4 KYSE150 和KYSE150/L-OHP 差异表达基因筛选 为探索ESCC L-OHP 耐药细胞的耐药机制,对耐药细胞及其亲代细胞进行了全转录组测序并筛选差异表达基因。KYSE150 和KYSE150/L-OHP(分别对应150NC 和150RS)miRNA 水平最终获得45 个差异性表达基因,其中31 个基因在150RS 中表达上调,14 个基因在150RS 中表达下调,见图4A;circRNA 水平最终获得514 个差异性表达基因,其中229 个基因在150RS 中表达上调,285 个基因在150RS 中表达下调,见图4B;LncRNA 水平最终获得24 个差异性表达基因,其中21 个基因在150RS 中表达上调,3 个基因在150RS 中表达下调,见图4C;mRNA 水平最终获得408 个差异性表达基因,其中256 个基因在150RS 中表达上调,152 个基因在150RS中表达下调,见图4D。

图4 KYSE150和KYSE150/L-OHP差异基因表达火山图Fig.4 Volcano map of differential gene expression of KYSE-150 and KYSE150/L-OHP
2.5 KYSE150 和KYSE150/L-OHP 差异表达基因KEGG 功能注释 miRNA 水平差异表达基因显著富集在磷脂酰肌醇、嘌呤代谢、PI3K/AKT/mTOR 和MAPK 等信号通路,见图5A;circRNA 水平差异表达基因富集在转录水平、紧密连接、内质网中的蛋白质加工、泛素介导的蛋白水解等相关信号通路,见图5B;LncRNA 水平差异表达基因富集在趋化因子信号通路、溶酶体、细胞因子受体相互作用等相关信号通路,见图5C;mRNA 水平差异表达基因富集在癌症相关途径、局灶性黏附信号通路、Hippo 信号通路、ECM-受体相互作用以及脂肪酸代谢等相关信号通路,见图5D。
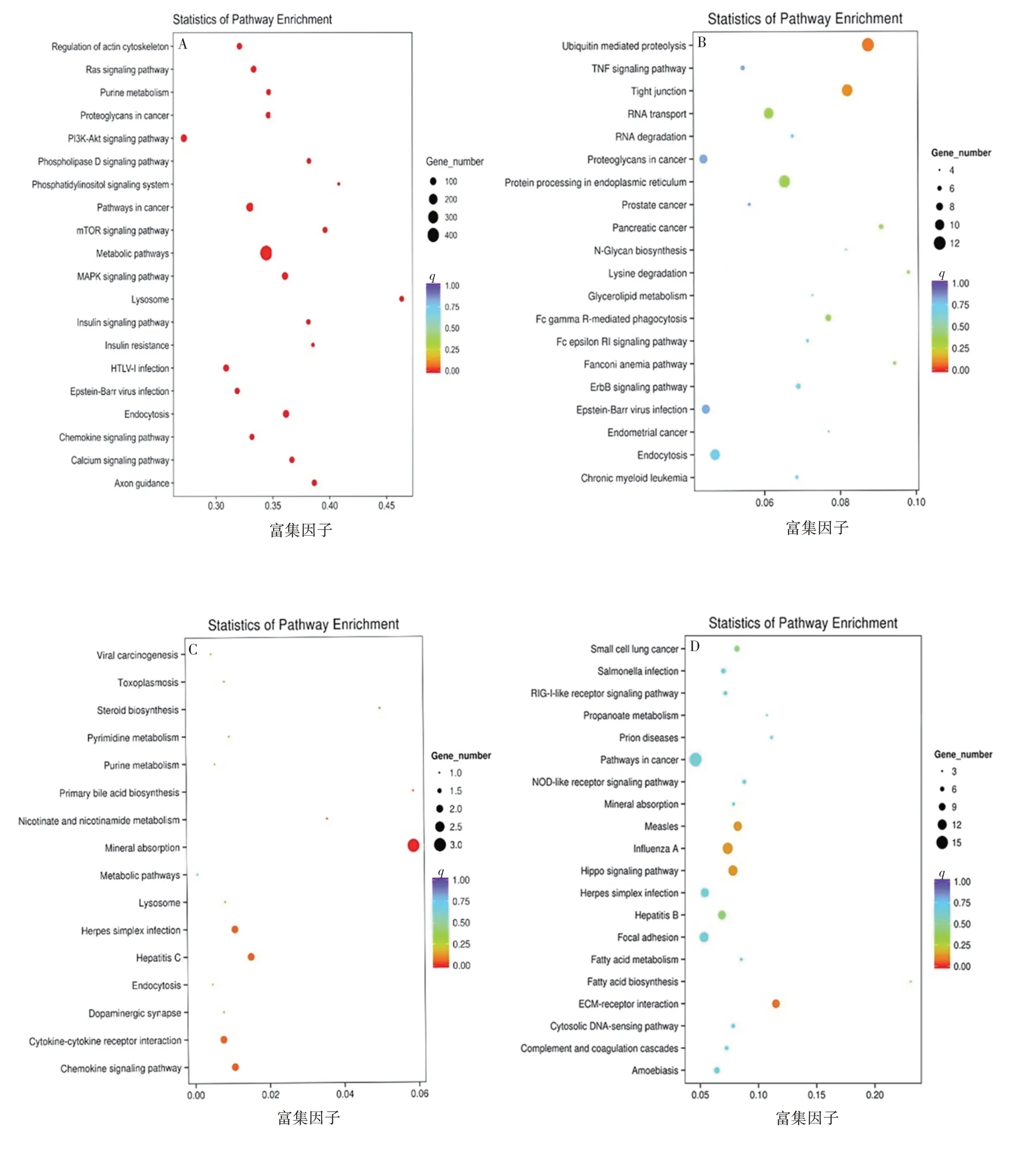
图5 KYSE150和KYSE150/L-OHP差异表达基因KEGG注释Fig.5 KEGG function annotation of differentially expressed genes of KYSE150 and KYSE150/L-OHP
2.6 KYSE150 和KYSE150/L-OHP 差异表达基因的验证 5 个差异倍数相对较大的基因ACTG1、CKM、CCL3、HNRNPH1、STAT1均在L-OHP 耐药细胞中高表达,其中CCL3、STAT1表达远高于其他基因,差异有统计学意义(t分别为47.62 和7.47,P均<0.001),见图6。

图6 KYSE150和KYSE150/L-OHP差异表达基因的RTPCR验证Fig.6 RT-PCR verification of differentially expressed genes of KYSE150 and KYSE150/L-OHP
3 讨论
由于ESCC 早期症状不明显和缺乏早期诊断分子标志物,50%的患者确诊时已处于中晚期,失去了最佳治疗时机。部分患者只能给予局部放射治疗或全身化学治疗、靶向治疗与免疫治疗[10]。全身化学治疗是大部分晚期ESCC患者的首选治疗方式,但原发性耐药和获得性耐药往往导致治疗失败。因此,急需寻找特异性的分子标志物来预测ESCC 治疗疗效及是否耐药,为ESCC的治疗提供指导。
本研究建立ESCC L-OHP 耐药细胞株后进行全转录本测序,通过差异表达基因筛选和通路富集进一步探索L-OHP耐药的分子机制。根据差异表达基因筛选结合文献发现,EBNA2 通过CCL3 和CCL4 介导的NF-κB 和Btk 激活来指导B 细胞淋巴瘤对阿霉素的耐药性[11]。CCL3基因可能与癌症耐药相关,对细胞的增殖、侵袭、迁移等均有影响,并参与免疫应答,可作为后续研究的靶分子。差异表达基因在KEGG数据库功能注释结果显示,参与耐药通路有P13KAkt、MAPK、Hippo 信号通路[12-14]。越来越多的证据表明,PI3K/AKT 途径与癌细胞的耐药性有关[15-17]。如WANG 等[18]证明,分泌型簇蛋白通过肝细胞癌中的Gadd45a/PI3K/Akt 信号通路介导L-OHP耐药;LI 等[19]证明,ATXN2L 可由EGF 通过PI3K/Akt 信号传导上调,促进细胞侵袭性和L-OHP 抗性;LIAO等[20]证明,正反馈激活CCN2-MAPK-Id1 信号能显著促肝癌L-OHP 耐药。Hippo 信号的失活使癌细胞对各种类型的癌症化学治疗药物具有抗性。Hippo 信号通路在人类多种癌症中均失调,且在肿瘤发生和发展中起着至关重要的作用[21]。Hippo 途径的失活将未磷酸化的YAP 入细胞核,诱导与细胞生长相关基因的转录[22]。TFAP2C 通过转录激活Hippo 信号传导的负调控因子ROCK1和ROCK2促进CSCs特征和化疗耐药,导致结肠直肠癌细胞中Hippo 信号的失活[23]。
综上所述,本研究成功构建了ESCC L-OHP耐药细胞模型,并通过全转录本测序技术初步筛选出耐药前后差异表达的基因,经过通路富集及生物信息学分析,探讨了耐药可能发生的分子机制,为寻找L-OHP耐药的新型分子标志物和治疗靶点提供了思路。

