LncRNA ZFAS1影响骨关节炎软骨细胞增殖和凋亡的机制研究
吴 昊,黄 震,李 磊
(1.恩施州中心医院关节外科,湖北 恩施 445000;2.恩施慧宜中西医结合风湿医院骨与关节外科,湖北 恩施 445000)
骨关节炎(osteoarthritis,OA)是一种退行性关节疾病,可引起局部炎症反应、软骨损伤和软骨结构改变。如果治疗不及时,不仅会影响患者的日常生活,还会增加心血管疾病的风险[1]。OA的特点是关节软骨变性,细胞外基质丢失,广泛的纤维化和裂隙,导致软骨表面完全破坏[2]。非甾体抗炎药或环氧合酶-2抑制剂是缓解OA症状的常用药物[3];而晚期患者需要手术治疗,手术方式包括关节镜手术和人工关节置换术,但行关节置换术的患者可能伴随不良的手术后果以及假体寿命有限[4]。有研究报道,自体软骨细胞移植可能成为关节炎和软骨缺损的新治疗策略[5]。然而,由于OA的发病机制尚不清楚,目前尚无有效的对症治疗方法。研究发现,软骨细胞凋亡是OA进展的关键因素[6]。了解软骨细胞凋亡的潜在分子机制可能是找到治疗OA新靶点的关键。长链非编码RNA(long non-coding RNA,lncRNA)是一类长度超过200个核苷酸的非蛋白质编码RNA,已成为人类疾病的关键调控因子。越来越多的研究表明,lncRNA可能在OA进展中发挥关键作用,如lncRNA MIR4435-2HG在OA中下调,并调节软骨细胞的增殖和凋亡[7];lncRNA HOTAIR通过靶向调控miR-130a-3p影响OA软骨细胞的增殖和调控炎症反应[8]。LncRNA锌指蛋白反义链1(zinc finger protein antisense strand 1,ZFAS1)是一种致癌基因,在大多数组织中都有表达[9-10]。有研究发现,lncRNA ZFAS1可能通过靶向Wnt3a信号通路促进OA软骨细胞增殖和迁移[11]。然而,lncRNA ZFAS1在OA进展中的分子机制尚不完全清楚。因此,本研究探讨lncRNA ZFAS1对OA中软骨细胞增殖和凋亡的影响,及其潜在的分子机制,以期为确定OA的新治疗靶点提供参考。
1 材料与方法
1.1 主要试剂与仪器
Annexin V-FITC/PI细胞凋亡检测试剂盒(批号:40302ES20)购自翌圣生物科技(上海)股份有限公司;TRIzol试剂(批号:15596018)购自美国Invitrogen公司;MTT溶液(批号:PB180519)购自武汉普诺赛生命科技有限公司;PrimeScript RT试剂盒(批号:RR037A)购自宝日医生物技术(北京)有限公司;转化生长因子-β受体2(transforming growth factor-beta receptor type 2,TGFβR2)抗体(批号:ab253617)购自美国Abcam公司;双荧光素酶报告基因试剂盒(批号:RG027)购自上海碧云天生物技术有限公司。酶标仪购自美国DYNEX Technologies公司;流式细胞仪购自美国BD公司;ABI PRISM 7000型定量PCR仪购自美国Applied Biosystems公司。
1.2 样本收集
收集2018年8月至2020年8月于恩施州中心医院进行膝关节置换术的OA患者软骨组织样本共 20份作为OA组,将同期外伤急诊截肢患者的正常膝关节组织样本20份作为对照(Control)组。排除类风湿关节炎和感染性关节炎患者。将组织样本置于-80 ℃冰箱保存,用于后续实验。本研究已获得恩施州中心医院医学伦理委员会的批准(20180720186),所有患者已签署对本研究的知情同意书。
1.3 原代软骨细胞分离和细胞转染
在无菌条件下去除关节软骨的纤维结缔组织后,将软骨组织切成1 mm3的大小。随后加入0.25%胰蛋白酶和0.2%Ⅱ型胶原酶消化细胞,6 h后将细胞悬液以1 200 r/min离心10 min,200目筛网过滤器过滤5 min。弃去上清液,用含10%胎牛血清的完全培养基吹打细胞制成单细胞悬液。将细胞以1×105/mL的密度接种于25 cm2培养瓶内,并置于5%CO2、37 ℃细胞培养箱中进行培养。将处于对数生长期的细胞接种于6孔板中,待细胞融合度达到80%时,使用LipofectamineTM2000转染试剂盒将Vector、pcDNA-ZFAS1、pcDNA-ZFAS1+NC mimic、pcDNA-ZFAS1+miR-590 mimic、NC mimic、miR-590 mimic质粒分别转染至细胞中,分别命名为Vector组、pcDNA-ZFAS1组、pcDNA-ZFAS1+NC mimic组、pcDNA-ZFAS1+miR-590 mimic组、NC mimic组、miR-590 mimic组,48 h后收集转染的细胞。
1.4 MTT实验
于转染后0 h、24 h、48 h、72 h将软骨细胞以每孔6×103个的密度接种于96孔板中。然后每孔加入20 μL的0.5%MTT溶液,孵育软骨细胞4 h。弃上清液并加入150 μL二甲基亚砜,充分溶解结晶物。用酶标仪检测在490 nm波长处的光密度(optical density,OD)值。
1.5 流式细胞术
使用Annexin V-FITC/PI细胞凋亡试剂盒检测细胞凋亡情况。用预冷的PBS洗涤各转染组处理的细胞,并用胰蛋白酶消化,然后将细胞重悬在100 μL含有Annexin V-FITC/PI的结合缓冲液中,室温下避光孵育15 min。最后用流式细胞仪检测细胞凋亡情况。
1.6 RNA提取和RT-qPCR实验
使用TRIzol法提取软骨组织和细胞总RNA。用紫外分光光度计测定RNA在260~280 nm处的OD值。使用PrimeScript RT试剂盒将总RNA逆转录为cDNA。使用SYBR Premix Ex Taq试剂盒以cDNA为模板,进行目的基因定量和分析。以U6和GAPDH作为内参,使用2-ΔΔCT法计算基因相对表达。
1.7 Western blot
用放射免疫沉淀分析裂解缓冲液从细胞中提取总蛋白。用Bio-Rad蛋白检测试剂盒定量蛋白浓度。将等量的蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,电泳条件为恒压(80 V、40 min,120 V、50 min),然后转移到聚偏氟乙烯膜上,电转条件为恒流(200 mA,60 min)。用5%脱脂牛奶在室温下封闭膜2 h,并与一抗(1∶1 000)在4 ℃下孵育过夜。用含0.05% Tween-20的PBS洗膜后,将膜与辣根过氧化物酶偶联的二抗(1∶5 000)在室温下孵育2 h。使用增强的化学发光底物试剂盒对蛋白条带进行可视化,最后用SynGene GeneTools软件进行分析。
1.8 双荧光素酶报告基因实验
使用生物信息学软件预测ZFAS1和miR-590潜在的结合位点 ,并将序列克隆到pmirGLO双荧光素酶表达载体上,构建ZFAS1野生型报告基因重组质粒(ZFAS1-WT)。使用相同的方法构建ZFAS1突变型报告基因重组质粒(ZFAS1-MUT)。将人胚肾细胞HEK293T接种在24孔板上培养24 h。然后根据说明书使用LipofectamineTM2000转染试剂盒将ZFAS1-WT、ZFAS1-MUT和miR-590 mimic或NC mimic共转染至细胞中,即分别为miR-590 mimic和3’UTR-ZFAS1-WT共转染组、miR-590 mimic和3’UTR-ZFAS1-MUT共转染组,NC mimic组为对照。转染48 h后,收集细胞用于荧光素酶活性评估。使用相同的方法验证miR-590与TGFβR2 3’UTR的靶向结合,根据说明书使用LipofectamineTM2000转染试剂盒将TGFβR2-WT、TGFβR2-MUT和miR-590 mimic或NC mimic共转染至细胞中,即分别为miR-590 mimic和3’UTR-TGFβR2-WT共转染组、miR-590 mimic和3’UTR-TGFβR2-MUT共转染组,NC mimic组为对照。其余方法与上述描述一致。
1.9 统计学分析

2 结果
2.1 LncRNA ZFAS1在OA软骨组织中的表达
通过RT-qPCR实验检测OA软骨组织和正常软骨组织中lncRNA ZFAS1的表达水平,结果显示,与Control组比较,OA组软骨组织中的lncRNA ZFAS1表达水平显著降低,差异有统计学意义(P<0.05),见图1。

*:与Control组比较,P<0.05
2.2 过表达lncRNA ZFAS1对软骨细胞增殖和凋亡的影响
与Vector组比较,pcDNA-ZFAS1组软骨细胞中lncRNA ZFAS1表达水平显著升高,软骨细胞增殖能力增强,细胞凋亡率降低,差异均有统计学意义(P<0.05),见图2。

a:RT-qPCR实验检测lncRNA ZFAS1表达水平;b:MTT实验检测细胞增殖;c:流式细胞术检测细胞凋亡 *:与Vector组比较,P<0.05
2.3 ZFAS1可直接靶向并调控miR-590的表达
通过生物信息学软件预测发现,miR-590与ZFAS1存在互补的结合位点,miR-590可能是ZFAS1的作用靶点。与Control组比较,OA组软骨组织中的miR-590表达水平显著升高(P<0.05)。与NC mimic组比较,miR-590 mimic和3’UTR-ZFAS1-WT共转染组的细胞荧光素酶活性显著降低(P<0.05),而miR-590 mimic和3’UTR-ZFAS1-MUT共转染组的细胞荧光素酶活性无统计学差异(P>0.05),见图3。
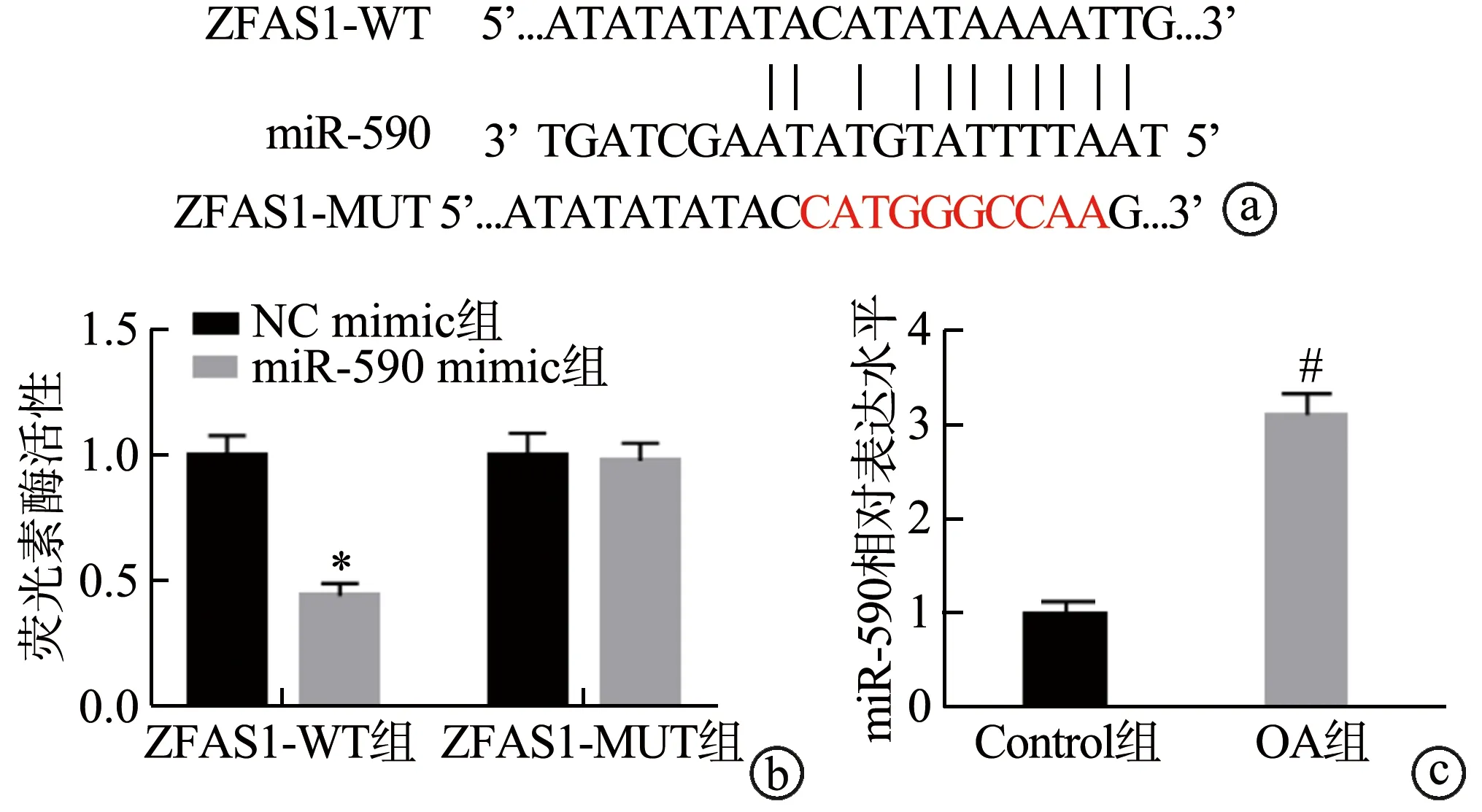
a:ZFAS1与miR-590的结合位点;b:双荧光素酶报告基因实验;c:RT-qPCR实验检测OA组织中miR-590的表达 *:与NC mimic组比较,P<0.05;#:与Control组比较,P<0.05
2.4 ZFAS1通过调控miR-590促进软骨细胞的增殖,抑制细胞凋亡
与Vector组比较,pcDNA-ZFAS1组软骨细胞中miR-590表达水平显著降低,软骨细胞增殖能力增强,细胞凋亡率降低,差异有统计学意义(P<0.05);与pcDNA-ZFAS1+NC mimic组比较,pcDNA-ZFAS1+miR-590 mimic组软骨细胞中miR-590表达水平显著升高,软骨细胞增殖能力减弱,细胞凋亡率升高,差异有统计学意义(P<0.05),见图4。
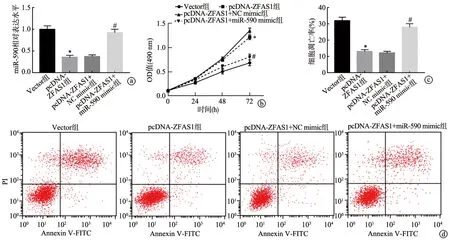
a:RT-qPCR实验检测miR-590表达水平;b:MTT实验检测细胞增殖;c:细胞凋亡率;d:流式细胞术检测细胞凋亡 *:与Vector组比较,P<0.05;#:与pcDNA-ZFAS1+NC mimic组比较,P<0.05
2.5 miR-590可直接靶向并调控TGFβR2的表达
通过生物信息学软件预测发现,TGFβR2与miR-590存在互补的结合位点,TGFβR2可能是miR-590的下游靶点。与NC mimic组比较,miR-590 mimic和3’UTR-TGFβR2-WT共转染组的细胞荧光素酶活性显著降低(P<0.05),而miR-590 mimic和3’UTR-TGFβR2-MUT共转染组的细胞荧光素酶活性无统计学差异(P>0.05)。与NC mimic组比较,miR-590 mimic组细胞中TGFβR2 mRNA和蛋白表达水平均显著降低(P<0.05),见图5。

a:miR-590与TGFβR2的结合位点;b:双荧光素酶报告基因实验;c:RT-qPCR实验检测TGFβR2 mRNA的表达;d:Western blot检测TGFβR2蛋白的表达 *:与NC mimic组比较,P<0.05
2.6 过表达ZFAS1通过调控miR-590促进TGFβR2 mRNA和蛋白的表达
与Vector组比较,pcDNA-ZFAS1组细胞中TGFβR2 mRNA和蛋白表达水平均显著升高(P<0.05);与pcDNA-ZFAS1+NC mimic组比较,pcDNA-ZFAS1+miR-590 mimic组TGFβR2 mRNA和蛋白表达水平均显著降低(P<0.05),见图6。

a:RT-qPCR实验检测TGFβR2 mRNA的表达;b:Western blot检测TGFβR2蛋白的表达 *:与Vector组比较,P<0.05;#:与pcDNA-ZFAS1+NC mimic组比较,P<0.05
3 讨论
OA是一种异质性疾病,影响所有滑膜关节,如脊柱、髋关节或膝关节,其特征是关节软骨逐渐退化,伴继发性滑膜炎和骨骼重塑。高龄是OA的主要危险因素,此外,肥胖和遗传等因素也可影响OA的发展。OA的分子机制目前尚未完全阐明,研究显示细胞外基质破坏、炎症反应或软骨细胞凋亡与OA的进展密切相关[12-13]。越来越多的证据表明,lncRNA是OA的生物调节因子,可作为OA早期预防、临床诊断和治疗的生物标志物。许多lncRNA的异常表达参与软骨细胞的细胞外基质降解、增殖和凋亡。如lncRNA HOTAIR通过上调FUT2促进细胞外基质降解和软骨
细胞凋亡[14]。LncRNA SNHG5通过调节miR-10a-5p/H3F3B轴促进OA中软骨细胞增殖并抑制其凋亡[15]。有研究报道ZFAS1参与多种癌症(如结肠癌、肺癌和乳腺癌)的发生发展[16-18]。此外,在类风湿性关节炎中,ZFAS1还可调节成纤维细胞样滑膜细胞的增殖、凋亡和自噬[19]。但lncRNA ZFAS1在OA发展中的具体分子机制目前尚不清楚。本研究结果显示,ZFAS1在OA软骨组织中表达下调,表明ZFAS1可能参与OA的进展。为了进一步探讨ZFAS1在OA中的作用,本研究通过过表达ZFAS1处理软骨细胞后,检测细胞增殖和凋亡能力,结果显示,过表达ZFAS1可促进软骨细胞增殖,抑制细胞凋亡,与之前的文献报道一致[11]。
研究表明,lncRNA在生物学或病理学过程中充当miRNA的海绵并调节其功能。如lncRNA HOTAIR通过miR-20a-5p/HMGA2轴影响乳腺癌细胞的增殖、迁移、侵袭和凋亡[20]。敲低lncRNA MFI2-AS1可通过miR-130a-3p/TCF4轴抑制脂多糖诱导的OA进展[21]。ZFAS1靶向miR-548e增强CXCR4表达,进而促进卵巢癌细胞的增殖和转移[22]。本研究通过生物信息学软件预测ZFAS1潜在的靶基因,并使用双荧光素酶报告基因实验验证了miR-590是ZFAS1的靶基因。有研究报道,miR-590可通过不同的分子网络调节癌症的发展,包括胰腺癌、结直肠癌、卵巢癌[23-25]。此外,在OA中,miR-590可通过调节PI3K/AKT信号通路促进骨细胞凋亡[26]。本研究结果显示,miR-590在OA患者中的表达显著上调,为了进一步研究miR-590在ZFAS1调节软骨细胞中的功能,将pcDNA-ZFAS1与miR-590 mimic共转染到软骨细胞中,结果显示pcDNA-ZFAS1可促进细胞增殖,抑制细胞凋亡,而miR-590 mimic转染后可显著逆转这一结果。以上数据表明ZFAS1可通过靶向miR-590促进软骨细胞增殖并抑制细胞凋亡。因此,本研究认为ZFAS1可以作为miR-590的分子海绵在OA进展中发挥作用。
越来越多的证据表明TGF-β参与了OA的发展。TGF-β在OA中上调,从而提高软骨细胞活性和蛋白多糖合成以促进软骨损伤修复[27]。TGFβR2作为一种跨膜丝氨酸-苏氨酸激酶,是启动下游TGF-β信号转导的主要因子,可能在OA进展中起关键作用。如敲除TGFβR2后,在小鼠模型中出现明显的OA样表型[28]。CircSERPINE2通过调节miR-495/TGFβR2轴抑制OA中软骨细胞凋亡和细胞外基质降解[29]。本研究结果显示,TGFβR2是miR-590的下游靶基因。ZFAS1过表达后TGFβR2 mRNA和蛋白水平显著增加,而miR-590 mimic转染后可以逆转这一结果。表明lncRNA ZFAS1通过miR-590/TGFβR2轴促进OA进展。
综上所述,lncRNA ZFAS1在人OA软骨组织中下调。此外,ZFAS1通过海绵吸附miR-590并诱导TGFβR2的表达促进软骨细胞增殖并抑制凋亡,提示ZFAS1/miR-590/TGFβR2轴可作为OA患者治疗的新靶点。然而,本研究仅通过体外实验探讨了lncRNA ZFAS1在OA中的作用机制,由于OA临床表型相对复杂,病程较长,因此还需要通过体内实验进一步验证lncRNA ZFAS1对OA进展的影响。